2020届全国2卷高考最后押题化学卷(三)
2020年高考最后押题化学卷(三)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39
一、选择题(每题6分,共42分。)
7.实现中国梦,离不开化学与科技的发展。下列说法不正确的是
A.2019年新冠肺炎“疫苗”等生物制剂需要冷冻保存
B.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
C.纳米复合材料实现了水中微污染物铅(Ⅱ)的高灵敏、高选择性检测,但吸附的量小
D.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
8.合成药物异搏定路线中某一步骤如下:
+
下列说法正确的是
A.物质X在空气中易被氧化
B.物质Z与氢气完全加成需要消耗6mol H2
C.物质Y能发生取代、消去、加成反应
D.等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶1
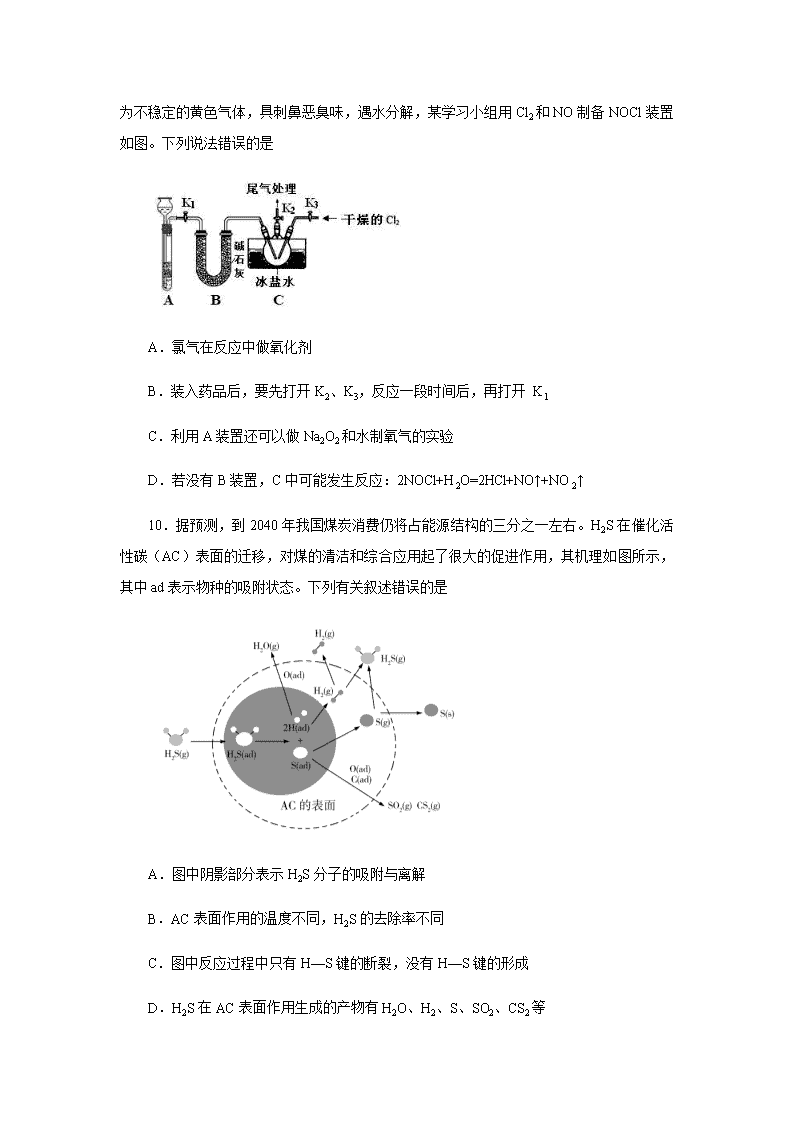
9.亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体,具刺鼻恶臭味,遇水分解,某学习小组用Cl2和NO制备NOCl装置如图。下列说法错误的是
A.氯气在反应中做氧化剂
B.装入药品后,要先打开K2、K3,反应一段时间后,再打开 K1
C.利用A装置还可以做Na2O2和水制氧气的实验
D.若没有B装置,C中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
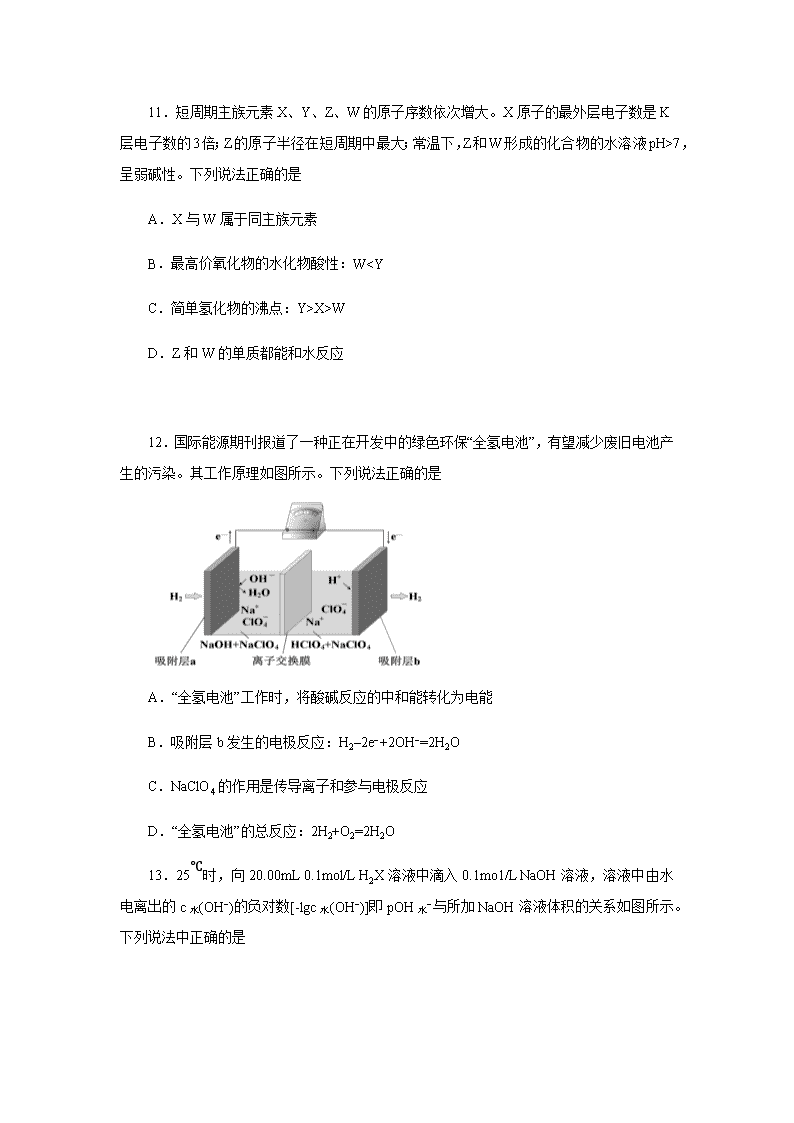
10.据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是
A.图中阴影部分表示H2S分子的吸附与离解
B.AC表面作用的温度不同,H2S的去除率不同
C.图中反应过程中只有H—S键的断裂,没有H—S键的形成
D.H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
11.短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是K层电子数的3倍;Z的原子半径在短周期中最大;常温下,Z和W形成的化合物的水溶液pH>7,呈弱碱性。下列说法正确的是
A.X与W属于同主族元素
B.最高价氧化物的水化物酸性:W
X>W
D.Z和W的单质都能和水反应
12.国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生的污染。其工作原理如图所示。下列说法正确的是
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层b发生的电极反应:H2–2e−+2OH−=2H2O
C.NaClO4的作用是传导离子和参与电极反应
D.“全氢电池”的总反应:2H2+O2=2H2O
13.25℃时,向20.00mL 0.1mol/L H2X溶液中滴入0.1mo1/L NaOH溶液,溶液中由水电离出的c水(OH−)的负对数[-lgc水(OH−)]即pOH水−与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
A.水的电离程度:M>P
B.P点溶液中
C.N点和Q点溶液的pH相同
D.图中P点至Q点对应溶液中逐渐增大
二、非选择题(共43分)
26.(14分)KI用于分析试剂、感光材料、制药和食品添加剂等。
制备原理如下:反应①3I2+6KOH=KIO3+5KI+3H2O;反应②3H2S+KIO3=3S↓+KI+3H2O
按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为________________________,用该装置还可以制备_________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到________
_____(填现象),停止滴入KOH溶液;然后______(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴入硫酸溶液,并对KI混合液水浴加热,其目的是________________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和_________,其中加入碳酸钡的作用是_______________。合并滤液和洗液,蒸发至析出结晶。滤出经干燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为_________g。
27.(14分)Li2CO3是生产锂电池的重要原料,电解铝废渣(主要含AlF3、LiF、NaF、CaO等物质)可用于制备Li2CO3。
已知:①Li2CO3的溶解度:0℃ 1.54g;20℃ 1.33g;80℃ 0.85g。
②20℃,Ksp[Ca3(PO4)2]=2×10−33,Ksp(CaHPO4)=1×10−7。
(1)在加热条件下酸浸,反应生成能腐蚀玻璃的气体,写出AlF3发生反应的化学方程式: 。
(2)滤渣B的主要成分是________。
(3)“转化”后所得LiHCO3溶液中含有的Ca2+需要加入Li3PO4除去。除钙步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如右图所示。
①随着温度升高最终Li2CO3的产率逐渐减小的原因是___________。
②当温度高于50℃时,除钙率下降的原因可能是__________________。
(4)热分解后,获得Li2CO3需趁热过滤的原因是_______________________。
(5)将酸浸时产生的气体通入Al(OH)3和Na2SO4溶液的混合物中可产生难溶物冰晶石(Na3AlF6),该反应的离子方程式为_______________________________________。
28.(15分)乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6(g)C2H4(g)+H2(g) ΔH1=+136.8kJ/mol
②H2(g)+O2(g)H2O(l) ΔH2=-285.8kJ/mol
③C2H4(g)+3O2(g)2CO2(g)+2H2O(l) ΔH3=-1411.0kJ/mol
则表示C2H6(g)燃烧热的热化学方程式为 。
(2)1000℃时,在某刚性容器内充入一定量的C2H6,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙烷的平衡转化率为40%。
①乙烷分解前容器压强为_____Pa,1000℃时,反应①的平衡常数Kp=_____Pa[气体分压(P分)=气体总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____40%(填“>”、“<”或“=”)。
(3) 乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6(g)+O2(g)C2H4(g)+H2O(g)
ΔH=-149kJ/mol,
①反应C2H6(g)+O2(g)C2H4(g)+H2O(g) ΔH=-149kJ/mol的正活化能和逆活化能中较大的是________。
②800℃时,控制原料气的总物质的量一定,当C2H6和O2的物质的量之比为2∶1时,乙烯的平衡产率最大,而当较小时,乙烯的平衡产率较低,可能的原因为_____。
(4)利用电解法可将C2H6转化为多种燃料,原理如图所示。铜电极为_____极,该电极上生成HCOOH的电极反应式为 。
三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。)
35.【化学——选修3:物质结构与性质】(15分)
Ni元素在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Ni原子价层电子的排布式为 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1mol La的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4
晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 (填“八面体空隙”或“四面体空隙”)。若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为___nm(用含d、M、NA的代数式表示)。
36. 【化学——选修5:有机化学基础】(15分)
麻黄素是中枢神经兴奋剂,其合成路线如图所示。
(1)F中的含氧官能团名称为________和________。
(2)E的结构简式为_______。
(3)写出B-C的反应类型:_______。
(4)请写出同时满足下列条件的F的一种同分异构体的结构简式________。
①能发生银镜反应;②水解产物能与FeCl3显色:③核磁共振氢谱显示有四组峰。
(5)请写出以乙醇为原料制备强吸水性树脂的合成路线流程图________(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)。
2020年高考最后押题 化学卷(三)
7. 【答案】D
【解析】光缆的主要成分是二氧化硅,故D错误;故选D。
8. 【答案】A
【解析】X中含有酚羟基,性质不稳定,易被氧气氧化,故A正确;物质Z与氢气完全加成消耗5mol H2,故B错误;酯基不能发生加成反应,故C错误;X中只有酚羟基能和NaOH反应,Y中酯基水解生成的羧基能和NaOH反应,溴原子水解生成的HBr能和NaOH反应,所以等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶2,故D错误;答案选A。
9. 【答案】C
【解析】由装置A制备NO,用铜和稀硝酸反应制备,制得的NO中可能有挥发的硝酸,故装置B用来净化和干燥NO,将氯气和NO干燥后在装置C中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间应该需加一个干燥装置。根据Cl2和NO反应生成了NOCl,氯元素化合价降低,得电子,Cl2为氧化剂,故A正确;先打开K2、K3,通入一段时间氯气,排尽三颈烧瓶中的空气,防止NO、NOCl变质,故B正确;该装置能制备用块状固体和液体反应生成的气体,过氧化钠为粉末状固体,故C错误;若无装置B,亚硝酰氯遇水分解,可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑,故D正确;故选:C。
10. 【答案】C
【解析】图中阴影部分H2S(g)→H2S(ad)为H2S在催化剂表面的吸附,H2S(ad)→2H(ad)+S(ad)表示H2S的离解,选项A正确;温度高时气态硫会反应生成H2S等,温度低时会变成固态的硫,选项B正确;图中阴影部分出现H(ad)、S(ad),有H—S键的断裂,部分S(g)与H2(g)生成H2S(g),存在H—S键的形成,选项C错误;观察图示可知H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等,选项D正确。
11. 【答案】A
【解析】短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是K层电子数的3倍,则X为O;Z的原子半径在短周期中最大,则Z为Na,Y为F;常温下,Z和W形成的化合物的水溶液pH>7,呈弱碱性,则为Na2S,即W为S。O与S属于同主族元素,故A正确;F无最高价氧化物对应的水化物,故B错误;水、氟化氢分子间存在氢键,沸点反常,常温下,水为液态、氟化氢为气态,所以简单氢化物的沸点:H2O>HF>H2S,故C错误;S和H2O不反应,故D错误。答案为A。
12. 【答案】A
【解析】由电子流向可知,左边吸附层为负极,发生了氧化反应,电极反应是H2-2e−+2OH−=2H2O,右边吸附层为正极,发生了还原反应,电极反应是2e−+2H+=H2。“全氢电池”工作时,将酸碱反应的化学能(中和能)转化为电能,故A正确;右边吸附层为正极,发生了还原反应,电极反应是2e−+2H+=H2,故B错误;NaClO4的作用是传导离子,没有参与电极反应,故C错误;总反应为:H++OH−=H2O,故D错误;故答案为A。
13. 【答案】B
【解析】-1gc水(OH−)越小,c水(OH−)越大,酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中c(H+)越大、碱中c(OH−)越大,其抑制水电离程度越大,则c水(OH−)越小,据此分析解答。M点水电离出的c水(OH−)为10−11.1mol/L,P点水电离出的c水(OH−)为10−5.4mol/L,水的电离程度M<P,故A错误;P点溶质为Na2X,溶液中存在质子守恒,c(OH−)=c(H+)+c(HX−)+2c(H2
X),故B正确;N点到Q点,加入的NaOH逐渐增多,溶液的pH逐渐增大,故C错误;水解平衡常数只与温度有关,P点至Q点溶液中c(OH−)逐渐增大,则 =×=逐渐减小,故D错误;故选B。
26. 【答案】(1)ZnS+H2SO4=H2S↑+ZnSO4 H2(CO2)
(2) 棕黄色溶液变为无色 打开启普发生器活塞,通入气体
(3) 使溶液酸化并加热,有利于H2S溢出,从而除去H2S
(4) 硫 除去多余的硫酸
(5) 33.2g
【解析】(1)启普发生器中发生的的反应用于制备H2S,化学方程式为:ZnS+H2SO4=H2S↑+ZnSO4,属于固体与液体不加热的反应制气装置,用该装置还可以制备H2(CO2)等。(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,发生①:3I2+6KOH=aKIO3+5KI+3H2O,待观察到棕黄色溶液变为无色,停止滴人KOH溶液;然后通入H2S,完成反应②:3H2S+KIO3=3S↓+KI+3H2O,打开启普发生器活塞,通入气体,待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。(3)滴人硫酸溶液使溶液酸化,并对KI混合液水浴加热,目的:使溶液酸化并加热,有利于H2S溢出,从而除去H2S。(4)沉淀中有反应②生成的硫,过量的硫酸用碳酸钡除去。把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和硫,其中加入碳酸钡的作用是除去多余的硫酸 。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。(5)如果得到3.2g硫单质,则理论上制得的KI为:反应①:3I2+6KOH=1KIO3+5KI+3H2O
反应②:3H2S+KIO3=3S↓+KI+3H2O得关系式S~2KI
则n(KI)=2×=0.2mol,m=0.2×166=33.2g。
27. 【答案】(1)2AlF3+3H2SO4(浓)Al2(SO4)3+6HF↑
(2) Al(OH)3
(2) 温度过高LiHCO3分解产生Li2CO3沉淀,与Ca3(PO4)2一同被过滤 温度过高PO水解,使PO离子浓度减小
(3) Li2CO3的溶解度随温度升高而降低,趁热过滤可减少Li2CO3溶解损失
(4) 6HF+Al(OH)3+3Na+=Na3AlF6+3H++3H2O
【解析】电解铝废渣用浓硫酸酸浸溶解,生成HF,形成含有Al3+、Li+、Na+、Ca2+、SO的溶液,浓硫酸具有强氧化性,铝废渣的铝单质发生钝化不参与反应,过滤得到的滤渣A含有铝单质,向滤液中加入碳酸钠溶液使Al3+、Li+、Ca2+转化为Li2CO3、Al2(CO3)3及CaCO3沉淀,过滤后向沉淀中加水,通入足量二氧化碳,使Al2(CO3)3转化为Al(OH)3,Li2CO3、CaCO3沉淀溶解转化为碳酸氢锂和碳酸氢钙,过滤则滤渣B为Al(OH)3,再向滤液中加入Li3PO4除去溶液中的Ca2+生成Ca3(PO4)2沉淀,过滤后得到碳酸氢锂溶液,对其加热分解生成碳酸锂,据此分析解答。(1)在加热条件下酸浸,AlF3与浓硫酸发生反应生成硫酸铝和氟化氢,化学方程式:2AlF3+3H2SO4(浓)Al2(SO4)3+6HF↑;(2)根据分析,滤渣B的主要成分是Al(OH)3;(3)①温度过高LiHCO3分解产生Li2CO3沉淀,与Ca3(PO4)2一同被过滤,导致最终的产率逐渐减小;②PO是弱酸根离子易水解,温度过高促进PO水解,使溶液中PO离子浓度减小,除钙率下降;(4)根据已知信息①,Li2CO3的溶解度随温度升高而降低,趁热过滤可减少Li2CO3溶解损失;(5)将酸浸时产生的气体通入Al(OH)3和Na2SO4溶液的混合物中可产生难溶物冰晶石(Na3AlF6),离子方程式为6HF+Al(OH)3+3Na+=Na3AlF6+3H++3H2O。
28. 【答案】(1)C2H6(g)+O2(g)=2CO2(g)+3H2O(l) ΔH=-1560kJ·mol−1
(2)1.5×105Pa 4×104Pa >
(3)逆活化能 较小时,C2H6发生深度氧化而导致乙烯的选择性产率降低
(4)阳 C2H6-10e−+4H2O=2HCOOH+10H+
【解析】(1)根据盖斯定律将第3个方程式相加,得到C2H6 (g)燃烧热的热化学方程式为C2H6(g)+O2(g)=2CO2(g)+3H2O(l) ΔH=-1560kJ·mol−1;(2)①1000℃时,假设在某刚性容器内充入一定量C2H6,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙烷的平衡转化率为40%,设开始时压强为p,
则0.6p+0.4p+0.4p=2.1×105,解得p=1.5×105Pa,1000℃时,反应①的平衡常数;故答案为:1.5×105Pa;4×104Pa。②若其他条件不变,该反应是体积增大的反应,刚性容器改为体积可变的密闭容器,则压强减小,向体积增大的方向移动即平衡正向移动,转化率增大,因此达到平衡时乙烷的转化率>40%。(3)①反应C2H6(g)+O2(g)C2H4(g)+H2O(g) ΔH=-149kJ·mol−1,ΔH=正反应活化能-逆反应活化能<0,正反应活化能<逆反应活化能,故答案为:逆活化能。②当较小时,乙烯的平衡产率较低,主要是C2H6发生深度氧化而导致乙烯的选择性产率降低;(4)根据图中信息可知乙烷变为CO或HCOOH,化合价升高,则为阳极,因此铜电极为阳极,该电极上生成HCOOH的电极反应式为C2H6-10e−+4H2O=2HCOOH+10H+。
35. 【答案】(1)3d84s2
(2) X射线衍射实验
(3) N sp3杂化 5∶4
(4) b
(5) 3NA 四面体空隙
【解析】(1)Ni的原子序数为28,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d84s2或[Ar]3d84s2,则其价电子排布为3d84s2;(2)确定某种金属互化物是晶体还是非晶体的方法是X射线衍射实验;(3)一般情况下,非金属性越强,第一电离能越大,但N原子最为层2p轨道为半满稳定状态,第一电离能高于相连元素,所以Ni(SCN)2中,第一电离能最大的元素是N;(SCN)2分子结构简式为N≡C-S-S-C≡N,其中S原子价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论可知硫原子的杂化方式为sp3杂化;共价单键为σ键,共价三键中含有1个σ键、2个π键,则σ键和π键数目之比为5∶4;(4)[Ni(NH3)6](NO3)2中,NH3与Ni2+之间为配位键;氨气分子之间存在氢键;[Ni(NH3)6]2+与NO之间为离子键,不存在金属键,故选b;(5)①晶胞中La原子数目=8×=1、H2分子数目==3,故含1mol La的合金可吸附H2的物质的量为1mol×3=3mol,数目为3NA;②Ni原子占据顶点和面心,Mg2+处于八个小立方体的体心,所以Mg2+位于Ni原子形成的四面体空隙;该晶胞中Ni原子个数=8×+6×=4、Mg2+个数为8,根据化学式知,H原子个数为16,所以晶胞的质量为,又已知晶胞的密度为d g/cm3,则晶胞的棱长为,根据晶胞结构可知Mg2+和Ni原子的最短距离为晶胞体对角线的,所以最短距离为。
36. 36. 【答案】(1)羟基 羰基
(2)
(3)取代反应或水解反应
(4)或
(5)CH3CH2OHCH3CHO
【解析】根据结构简式知,A发生取代反应生成B,B发生水解反应生成C,C发生催化氧化反应生成D,E发生信息中反应生成F,由F结构简式知,E为,F先发生加成反应然后发生消去反应生成G,G发生加成反应生成麻黄素;(1)根据流程图中F结构简式知,F中的含氧官能团名称为羟基和羰基;(2)通过以上分析知,E的结构简式为;(3)B中溴原子被羟基取代,该反应为取代反应或水解反应;(4)F的同分异构体符合下列条件:①能发生银镜反应,说明含有醛基;②水解产物能与FeCl3显色,说明含有酯基且酯基水解生成酚羟基;③核磁共振氢谱显示有四组峰,说明含有4种氢原子,符合条件的同分异构结构简式为或;(5)乙醇氧化生成乙醛,乙醛与NaC≡CH反应后酸化得到,再与氢气发生加成反应得到,最后发生加聚反应生成,其合成路线为:CH3CH2OHCH3CHO。