2019-2020学年山西大学附中高二上学期12月月考试题 化学 word版
山西大学附中 2019—2020 学年第一学期高二月考试题(总第四次)
化 学 试 题
考查时间:80 分钟 考查内容:选修四全部 满分:100 分
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Li:7 Mg:24 Al:
27 Fe:56
一、选择题:(本题包括 20 小题,每题 2 分,共 40 分。每小题只有一个....选项符合题意。)
1. 下列示意图与化学用语表述内容不相符的是( )
2.N2O 和 CO 是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量
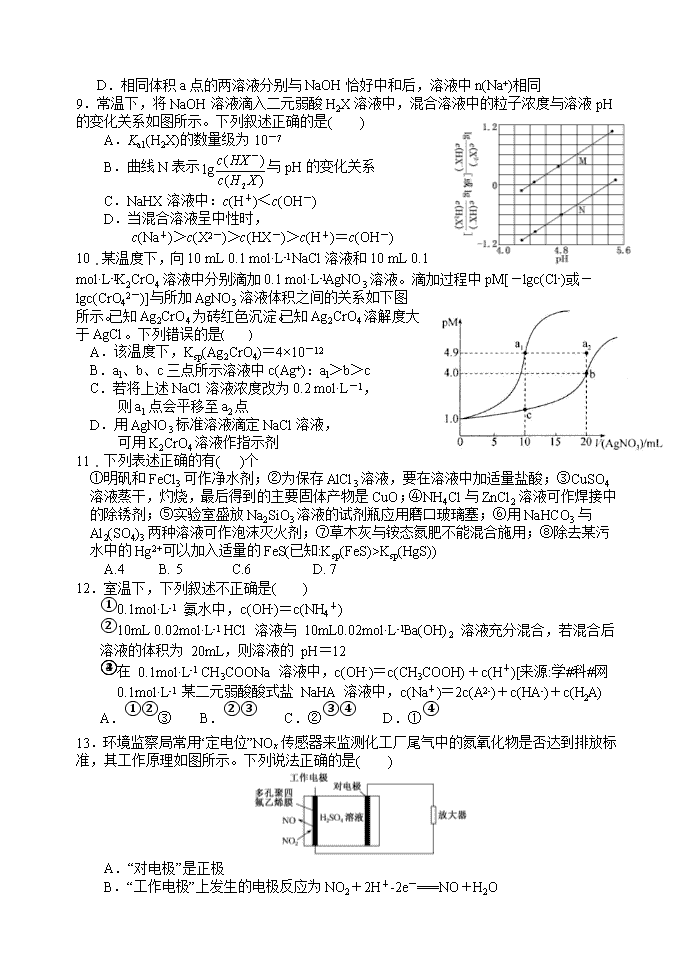
变化如图所示。下列说法正确的是( )
A.加入催化剂使反应的ΔH 变小
B.该反应的热化学方程式:N2O(g)+CO(g)===CO2(g)+N2(g) ΔH=-226kJ·mol-1
C.反应物的总键能大于生成物的总键能
D.该反应正反应的活化能大于逆反应的活化能
3.将 5 mL 0.005 mol·L-1 FeCl3 溶液和 5 mL 0.015 mol·L-1 KSCN 溶液混合,达到平衡后
溶液呈红色。再将混合液等分为 5 份,分别进行如下实验。下列说法不正确的是( )
实验①:滴加 4 滴水,振荡
实验②:滴加 4 滴饱和 FeCl3 溶液,振荡
实验③:滴加 4 滴 1mol·L-1 KCl 溶液,振荡
实验④:滴加 4 滴 1mol·L-1 KSCN 溶液,振荡
实验⑤:滴加 4 滴 6 mol·L-1 NaOH 溶液,振荡
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加生成物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
4.下列事实,不能用勒夏特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2O2 中加入 MnO2, 产生 O2 的速度加快
C.合成氨为提高 NH3 的产率,理论上应采取高压低温的条件
D.氨水应密闭保存、放置于低温处
5.用 CO 合成甲醇(CH3OH)的化学方程式为 CO(g)+2H2(g) CH3OH(g) ΔH<0,按照
相同的物质的量投料,测得 CO 在不同温度下的平衡转化率与
压强的关系如图所示。下列说法正确的是( )
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)
M(d)
6.温度为 T 时,向 2.0 L 恒容密闭容器中充入 1.0 mol PC15,反应 PCl5(g) PCl3(g)+Cl2(g)
经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s 0 50 150 250K 350
n(PCl3)/mol 0 0.16 0.19 0.20 0.20
下列说法不正确的是( )
A.反应在前 50 s 的平均速率ν(PCl3)=0.0016 mol ·L-1· s-1
B.保持其他条件不变,升高温度,平衡时 c(PCl3)=0.11 mol· L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入 1.0 mol PCl5、0.20 mol PCl3 和 0.20 mol Cl2,反
应达到平衡前ν(正)>ν(逆)
D.相同温度下,起始时向容器中充入 2.0mol PC13 和 2.0mol Cl2,达到平衡时,PCl3
的转化率小于 80%
7.强酸制弱酸是非常重要的一种离子反应。已知:
Ka1 Ka2
H2SO3 1.54×10-2 1.02×10-7
H2CO3 4.3×10-7 5.6×10-11
下列离子反应不正确的有( )个
①SO2 + 2CO32-+ H2O=SO32-+ 2HCO3
- ②SO2 + CO32-+ H2O=HSO3
- + HCO3
-
③2SO2 +CO32-+H2O=2HSO3
-+ CO2 ④2HSO3
-+ CO32-=2SO32-+ CO2 + H2O
A.0 个 B.1 个 C.2 个 D.3 个
8.某温度下,HNO2 和 CH3COOH 的电离常数分别为 5.0×10-4 和
1.7×10-5。将 pH 和体积均相同的两种酸溶液分别稀释,其 pH 随加
水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表 HNO2 溶液
B.溶液中水的电离程度:b 点>c 点
C.从 c 点到 d 点,溶液中
HA OH
A
c c
c
保持不变(其中 HA、A-分别代表相应的酸和
酸根离子)
D.相同体积 a 点的两溶液分别与 NaOH 恰好中和后,溶液中 n(Na+)相同
9.常温下,将 NaOH 溶液滴入二元弱酸 H2X 溶液中,混合
溶液中的粒子浓度与溶液 pH 的变化关系如图所示。下列叙
述正确的是( )
A.Ka1(H2X)的数量级为 10-7
B.曲线 N 表示
2
( )lg ( )
c HX
c H X
-
与 pH 的变化关系
C.NaHX 溶液中:c(H+)<c(OH-)
D.当混合溶液呈中性时,
c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
10.某温度下,向 10 mL 0.1 mol·L-l NaCl 溶液和 10 mL 0.1 mol·L-lK2CrO4 溶液中分别滴加
0.1 mol·L-lAgNO3 溶液。滴加过程中 pM[-lgc(Cl-)或-lgc(CrO42-)]与所加 AgNO3 溶液体积
之间的关系如下图所示。已知 Ag2CrO4 为砖红色沉淀。已
知 Ag2CrO4 溶解度大于 AgCl。下列错误的是( )
A.该温度下,Ksp(Ag2CrO4)=4×10-12
B.al、b、c 三点所示溶液中 c(Ag+):al>b>c
C.若将上述 NaCl 溶液浓度改为 0.2 mol·L-1,
则 a1 点会平移至 a2 点
D.用 AgNO3 标准溶液滴定 NaCl 溶液,
可用 K2CrO4 溶液作指示剂
11.下列表述正确的有( )个
①明矾和 FeCl3 可作净水剂;②为保存 AlCl3 溶液,要
在溶液中加适量盐酸;③CuSO4 溶液蒸干,灼烧,最后得到的主要固体产物是 CuO;④
NH4Cl 与 ZnCl2 溶液可作焊接中的除锈剂;⑤实验室盛放 Na2SiO3 溶液的试剂瓶应用磨
口玻璃塞;⑥用 NaHCO3 与 Al2(SO4)3 两种溶液可作泡沫灭火剂;⑦草木灰与铵态氮肥
不能混合施用;⑧除去某污水中的 Hg2+可以加入适量的 FeS(已知:Ksp(FeS)>Ksp(HgS))
A.4 B. 5 C.6 D. 7
12.室温下,下列叙述不正确是( )
①0.1mol·L-1 氨水中,c(OH-)=c(NH4
+)
②10mL 0.02mol·L-1 HCl 溶液与 10mL0.02mol·L-1Ba(OH)2 溶液充分混合,若混合后
溶液的体积为 20mL,则溶液的 pH=12
③在 0.1mol·L-1 CH3COONa 溶液中,c(OH-)=c(CH3COOH)+c(H+)[来源:学#科#网
④0.1mol·L-1 某二元弱酸酸式盐 NaHA 溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
A.①②③ B.②③ C.②③④ D.①④
13.环境监察局常用“定电位”NOx 传感器来监测化工厂尾气中的氮氧化物是否达到排放标
准,其工作原理如图所示。下列说法正确的是( )
A.“对电极”是正极
B.“工作电极”上发生的电极反应为 NO2+2H+-2e-===NO+H2O
C.传感器工作时,H+由“工作电极”移向“对电极”
D.“对电极”的材料可能为活泼金属锌
14.一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理
及电池中发生的主要反应如图所示。下列正确的是( )
A.镀铂导电玻璃的作用是传递 I-
B.电池工作时,光能转变为电能,X 为电池的正极
C.电池的电解质溶液中 I-和 I -
3 的浓度均不断减小
D.电解质溶液中发生反应 2Ru3++3I-===2Ru2++I-
3
15.化学用语是学习化学的重要工具,下列化学用语正确的是( )
A.惰性电极电解饱和食盐水时,阳极的电极反应为:2Cl--2e-==Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-==4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-==Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-==Fe2+
16.锂—空气电池充放电基本原理如图所示,下列说法不正确的是( )
A.充电时,锂离子向阴极移动
B.充电时,阴极电极反应式为 Li++e-===Li
C.放电时,正极电极反应式为 O2+4e-+2H2O===4OH-
D.电池装置中高分子隔膜允许水分子自由移动
17.高铁酸盐在环保能源领域有广泛的用途。用镍(Ni)、铁作电极电解浓 NaOH 溶液制备
高铁酸盐 Na2FeO4 的装置如图所示。下列推断合理的是( )
A.Fe 电极是阳极,电极反应式 Fe-6e-+4H2O===FeO2-
4 +8H+
B.电解时电子流向:负极→Ni 电极→电解液→Fe 电极→正极
C.若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有 FeO2-
4
D.电解时阳极区 pH 减小、阴极区 pH 增大,撤去隔膜,溶液
混合后,与原溶液相比,pH 减小(忽略体积变化)
18.储氢作为氢能利用的关键技术,是当前关注的热点之一。一定条件下,图示装置可实
现有机物的电化学储氢(忽略其它有机物)。下列说法错误的是( )
已知:电流效率(η= ×100%)
A.电源 B 为正极
B.导线中电子移动方向 A→D
C.电极 A 反应式为 C6H6+6H++6e-=C6H12
D.该储氢装置的电流效率η=24.3%
19.一种将燃料电池与电解池组合制备 KMnO4 的装置如图所示(电极甲、乙、丙、丁均为
惰性电极)。该装置工作时,下列说法不正确的是( )
A.电极丁的反应式为 MnO2-
4 -e-=== MnO-
4
B.电极乙附近溶液的 pH 减小
C.KOH 溶液的质量分数:c%>a%>b%
D.导线中流过 2 mol 电子时,理论上有 2 mol K+移入阴极区
20.高二化学组老师们在研究电化学知识时,设计如图所示装置,下列说法正确的是( )
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入 CH3OH 的电极反应为 CH3OH-6e-+2H2O=CO32-+8H+
C. 一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4 溶液复原
D. 甲池中消耗 280 mL(标准状况下)O2,此时丙池中理论上最多产生 1.45g 固体
二、非选择题:(本题包括 5 小题,共 60 分)
21.(9 分)水溶液中的离子平衡是中学学习的一个重要内容。
(1)下列溶液①0.1mol/L 盐酸②0.1mol/L H2SO4 溶液③0.1mol/L CH3COONa 溶液④0.1mol/L
NH4Cl 溶液⑤0.1mol/L 氨水,按 pH 由小到大顺序为 (填序号)
(2)等浓度的盐酸、氨水中,由水电离出的 H+浓度 c(H+)盐酸________c(H+)氨水(填“大于”
“小于”或“等于”) 。在 25℃下,将 a mol·L-1 的氨水与 0.01 mol·L-1 的盐酸等体积混合,
充分反应后溶液呈中性,则反应后溶液存在的离子浓度由大小顺序为
,氨水的浓度 a 0.01 mol·L-1(填“>”、“ <”或“=”)。
(3)某同学查阅资料发现,人体血液里存在重要的酸碱平衡:
CO2+H2O H2CO3 HCO3-,使人体血液 pH 保持在 7.35~7.45,否则就会发生
酸中毒或碱中毒。
①人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH 溶液 B.NaHCO3 溶液 C.NaCl 溶液 D.Na2SO4 溶液
②已知 25 ℃时,CO32-水解反应的一级平衡常数 Kh=2×10-4 mol/L,当溶液中
c(HCO3-):c(CO32-)=2:1 时,溶液的 pH=________
(4)已知 25 ℃时,AgCl 的 Ksp=1.8×10-10,该温度下向 1 L 0.03 mol/L 的 AgNO3 溶液中加
入 1 L 0.01 mol/L 的 NaCl 溶液之后,溶液中 c(Cl-)=______mol/L(忽略混合前后溶液体积的
变化)。平衡后,若向该体系中再加入少量 AgCl 固体,则 c(Cl-)___________(填“增大”或“减
小”或“不变”)。
22.(14 分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS
数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的 pH 等而
在中和滴定的研究中应用越来越广泛深入。
(1)田老师利用 DIS 系统探究强碱和不同酸的中和反应,实验过程如下:
I.分别配制 0.1000 mol/L 的 NaOH、HCl、CH3COOH 溶液备用。
II.用 0.1000 mol/L 的 NaOH 溶液分别滴定 10.00 mL 0.1000 mol/L 的 HCl 和 CH3COOH 溶
液,连接数据采集器和 pH 传感器。
III.由计算机绘制的滴定曲线如图:
①A 是_________(填“醋酸”或“盐酸”)
②两曲线图中 V1________V2(填“>”“=”或“<”),
A 点和 B 点,水的电离程度相比_____(填“A 大”、“B 大”、“一样大”或“无法判断”)
(2)程老师利用 DIS 系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴
定终点,实验步骤如下:用________(填仪器名称)量取 20.00 mL 醋酸溶液样品,倒入洁
净干燥锥形瓶中,连接好 DIS 系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结
果?______(填“是”“否”或“不能确定”)。向锥形瓶中滴加 0.1000 mol/L 的 NaOH 溶液,计
算机屏幕上显示溶液导电能力与加入 NaOH 溶液体积关系的曲线图
(如图 2)。
①图中 b 点时,c(CH3COOH)+c(CH3COO-)=_________mol/L。
②若图中某一点 pH 等于 8,则 c(Na+)-c(CH3COO-)的精确值
为________mol/L。
23.(15 分)知识的梳理和感悟是有效学习的方法之一。山大附中高二化学兴趣小组将有关
“电解饱和食盐水”的相关内容进行梳理,形成如下问题(所有电极均为石墨)。电解所用的
氯化钠溶液需精制,除去有影响的 Ca2+、Mg2+、NH4+、SO42-及泥沙,其精制流程如下:
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的 pH 如下表。
Ca(OH)2 Mg(OH)2
pH ≥11.5 ≥9.2
②Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
(1)盐泥 a 除泥沙外,还含有__________(填化学式)。
(2)过程 I 中,NaClO 的作用是将 NH4+转化为 N2,反应的离子方程式为_________________。
(3)过程 III 中,沉淀 c 主要成分的化学式为_________。
(4)过程 IV 调 pH 目的是除去____________ (填离子符号)。
(5)利用图 1 装置电解精制氯化钠溶液一段时间后,气球 b 中的气体是________(填化学式)。
(6)利用图 2 制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分 NaClO,
则 c 为电源的 极;该发生器中反应的总离子方程式为 。
(7)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消
毒剂。如图是目前已开发出用电解法制取 ClO2 的新工艺。
①阴极发生的反应有: 、 。
②当阳极产生标准状况下 112 mL 气体时,通过质子交换膜离子的数目为___ 。
24.(14 分)研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中
液柱的上升缓慢,为更快更清晰观察到水柱上升的现象,下列措施错误的______(填序号)。
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)为探究铁钉腐蚀实验 a、b 两点所发生的反应,张老师进行以下实验,证明铁发生了电
化学腐蚀。请完成表格空白:
实验操作 实验现象 实验结论
ⅰ.向 NaCl 溶液中滴
加 2~3 滴酚酞指示剂 a 点附近溶液出现红色 a 点电极反应为____________________
ⅱ.然后再滴加 2~3 滴
铁氰化钾溶液 b 点周围出现蓝色沉淀 b 点电极反应为
沉淀的化学式为
(3)孔老师认为仅通过 b 中现象不能证明铁发生了电化学腐蚀,补充进行下列实验,在实
验几分钟后的记录如下:
实验 滴管 现象
1.0 mol·L-1 NaCl 溶液
0.5 mol·L-1K3[Fe(CN)6]溶液 铁片表面产生大量蓝色沉淀
以上实验表明:K3[Fe(CN)6]具有__________性。
(4)赵老师设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中
氧气的体积分数随时间变化见图,从图中可分析,t1~t2 之间主要发生_______腐蚀(填吸氧
或析氢)。
(5)金属阳极钝化形成保护膜是一种电化学防腐方法。将 Fe 作阳极置于 H2SO4 溶液中,一
定条件下 Fe 表面形成致密 Fe3O4 氧化膜,试写出该阳极电极反应式 。
25.(8 分)“绿水青山就是金山银山”,研究脱硝和脱硫技术成为人们共同关注的课题。
(1)2NO(g)+O2(g) 2NO2(g)的反应历程如下:
反应 I : 2NO(g) N2O2(g)(快); v1 正=k1 正·c2(NO) v1 逆=k1 逆·c(N2O2)
反应Ⅱ:N2O2(g)+O2(g) 2NO2(g)(慢) v2 正=k2 正·c(N2O2)▪c(O2) v2 逆=k2 逆·c2(NO2);
在一定条件下,反应 2NO(g)+O2(g) 2NO2(g)达到平衡状态,
平衡常数 K=___________(用含 k1 正、k1 逆、k2 正、k2 逆的代数式表示)。
(2)烟道气中的 NO 是主要的大气污染物之一,为了监测其含量,选用如下检测方法。
将 v L 气样通入适量酸化的 H2O2 溶液中,使 NO 完全被氧化成 NO3
-,加水稀释至
100.00 mL。量取 20.00 mL 该溶液,加入 v1mL、c1mol·L-1 FeSO4 标准溶液(过量),充分反
应后,用 c2mol·L-1 K2Cr2O7 标准溶液滴定剩余的 Fe2+,终点时消耗 v2mL。
①NO 被 H2O2 氧化为 NO3
-的离子方程式为 。
②加水稀释到100.00ml 所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要 。
③滴定过程中发生下列反应:3Fe2++NO3
-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中 NO 的含量为 mg/L。
下列操作会使滴定结果偏高的是_________
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4 标准溶液部分变质
山西大学附中 2019—2020 学年第一学期高二月考试题(总第四次)
化 学 试 题 参 考 答 案
一、选择题:(本题包括 20 小题,每题 2 分,共 40 分。每小题只有一个....选项符合题意。)
题号 1 2 3 4 5 6 7 8 9 10
答案 B B B B C D B C D B
题号 11 12 13 14 15 16 17 18 19 20
答案 C D D D A D D D D D
21【共 9 分】第一空 2 分,其余均为 1 分,原样选填,否则不得分
②①④③⑤
小于 c(Cl-)=c(NH4+)>c(H+)=c(OH-) >
B 10
1.8×10-8 不变
22【共 14 分】每空 2 分,原样选填,否则不得分
盐酸 > 一样大
酸式滴定管 否 0.05 9.9×10-7(或 10-6-10-8)
23【共 15 分】Mg(OH)2 (1 分)
3ClO-+2 NH4++2OH-=3Cl-+ N2↑+5H2O (2 分)
CaCO3 (1 分)
CO32-、OH- (1 分,漏写、有错均不得分)
H2(1 分)
负 (1 分) Cl-+H2O ClO-+H2↑ (2 分)
2 2ClO e ClO , 3 2 2 2ClO ClO 2H 2ClO H O (2+2 分)
0.02NA(2 分)
24【共 14 分】 每空 2 分
B
O2+4e-+2H2O=4OH-
Fe -2e-=Fe2+ Fe3[Fe(CN)6]2
氧化
吸氧 3Fe-8e-+4H2O=Fe3O4+8H+
25【共 8 分】
1 2
1 2
k k
k k
正 正
逆 逆 (1 分) 2NO+3H2O2=2H++2NO3-+2H2O (2 分)
100mL 容量瓶 (1 分) 1 1 2 250 (c v -6c v )
v
(2 分)
CD (2 分,漏选得 1 分,错选不得分)