- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习电化学基础学案(全国通用)(2)
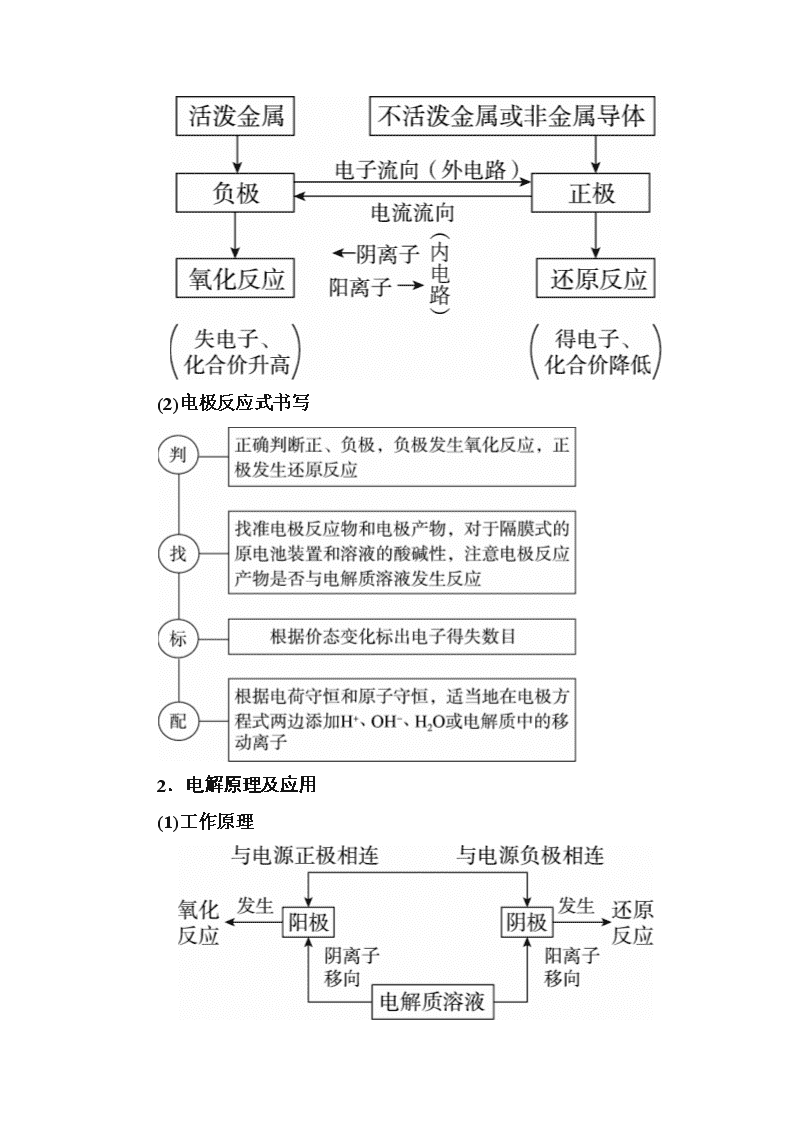
考情分析——对考题理解要深(把握备考方向) [试做真题找感觉] 1.(2017·全国卷Ⅰ)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有 关表述不正确的是( ) A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 答案:C 解析:A对:外加强大的电流可以抑制金属电化学腐蚀产生的电流。B对:被保护的钢管桩作阴极,高硅铸铁作阳极,电解池中外电路电子由阳极流向阴极,即从高硅铸铁流向钢管桩。C错:高硅铸铁为惰性辅助阳极,其主要作用是传递电流,而不是作为损耗阳极。D对:保护电流要抑制金属电化学腐蚀产生的电流,应根据环境条件变化进行调整。 2.(2017·全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 答案:C 解析:A对:该电解池阳极发生的电极反应为2H2O-4e-===4H++O2↑,氧气将铝制品表面氧化形成致密的氧化膜,所以待加工铝质工件应为阳极。B对,C错:阴极发生的电极反应为2H++2e-===H2↑,阴极可选用不锈钢网作电极。D对:电解质溶液中的阴离子向阳极移动。 [基础点回顾主线] 1.原电池 (1)工作原理 说明:①在电解质溶液中只有离子的定向移动,没有电子流动。 ②盐桥的作用:连接内电路,形成闭合电路;离子移动,平衡电荷。 (2)电极反应式书写 2.电解原理及应用 (1)工作原理 (2)电解池电极反应式的书写模式 (3)应用 氯碱工业:2NaCl+2H2O2NaOH+H2↑+Cl2↑ 电镀:待镀金属作阴极,镀层金属作阳极,含镀层离子的溶液作电解质溶液 电解精炼铜:粗Cu作阳极,纯Cu作阴极,含Cu2+的溶液作电解质溶液 3.金属的腐蚀与防护 (2)金属防护 ①电化学保护法 a. b. ②加防护层 [命题点无缝排查] 一、判断正误 1.根据两极发生的反应类型可判断原电池的正负极:负极上发生氧化反应,正极上发生还原反应。 ( ) 2.电解池的工作原理:电解池中与直流电源正极相连的是阳极,阳极发生氧化反应;与电源负极相连的是阴极,阴极发生还原反应。通电时,电子的流向为负极→阴极→电解质→阳极→正极。( ) 3.电解稀硫酸溶液实质上是电解水,故溶液pH不变。( ) 4.电解稀氢氧化钠溶液要消耗OH-,故溶液pH减小。( ) 5.电解硫酸钠溶液,在阴极发生反应:4OH--4e-===2H2O+O2↑。( ) 6.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1。 ( ) 7.电解池发生电解时,溶液中阳离子移向阴极。( ) 8.原电池中电子由负极经导线流向正极,电解质溶液中阴离子移向负极。( ) 9.电镀时,电镀池里的阳极材料发生氧化反应。( ) 10.用原电池作电源进行电解时,电子从原电池负极经导线流向电解池阴极。( ) 二、书写规范再落实 1.钢铁的吸氧腐蚀(负极—Fe、正极—C、电解液—中性或碱性)负极:________________,反应类型:________________; 正极:________________,反应类型:________________; 铁锈生成过程中的化学反应方程式 ①_________________________________________________; ②_________________________________________________; ③_________________________________________________。 2.甲烷燃料电池 (1)碱性电解质(铂为两极、电解液为KOH溶液) 正极:____________________________________(还原反应); 负极: ___________________________________(氧化反应); 总反应方程式:______________________________________。 (2)酸性电解质(铂为两极、电解液为H2SO4溶液) 正极:____________________________________(还原反应); 负极:____________________________________(氧化反应); 总反应方程式:_____________________________________。 3.氯碱工业 阳极:_____________________________________________; 阴极:____________________________________________; 电解总反应式:____________________________________。 4.电解精炼铜(如图) 阳极(粗铜):_________________________________________; 阴极(纯铜):_________________________________________。 5.用惰性电极电解硫酸铜溶液 阴极:______________________________________________; 阳极:______________________________________________; 电解总反应式:______________________________________。 一、答案:1.√ 2.× 3.× 4.× 5.× 6.√ 7.√ 8.√ 9.√ 10.√ 二、1.答案:2Fe-4e-===2Fe2+ 氧化反应 O2+2H2O+4e-===4OH- 还原反应 ①2Fe+O2+2H2O===2Fe(OH)2 ②4Fe(OH)2+O2+2H2O===4Fe(OH)3 ③2Fe(OH)3===Fe2O3+3H2O 2.答案:(1)2O2+4H2O+8e-===8OH- CH4+10OH--8e-===CO+7H2O CH4+2KOH+2O2===K2CO3+3H2O (2)2O2+8e-+8H+===4H2O CH4-8e-+2H2O===8H++CO2 CH4+2O2===CO2+2H2O 3.答案:2Cl--2e-===Cl2↑ 2H++2e-===H2↑ 2NaCl+2H2O2NaOH+Cl2↑+H2↑ 4.答案:Cu-2e-===Cu2+ Cu2++2e-===Cu 5.答案:2Cu2++4e-===2Cu 2H2O-4e-===O2↑+4H+ 2CuSO4+2H2OO2↑+2Cu+2H2SO4查看更多