- 2021-08-24 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年普通高等学校招生统一考试化学模拟卷2
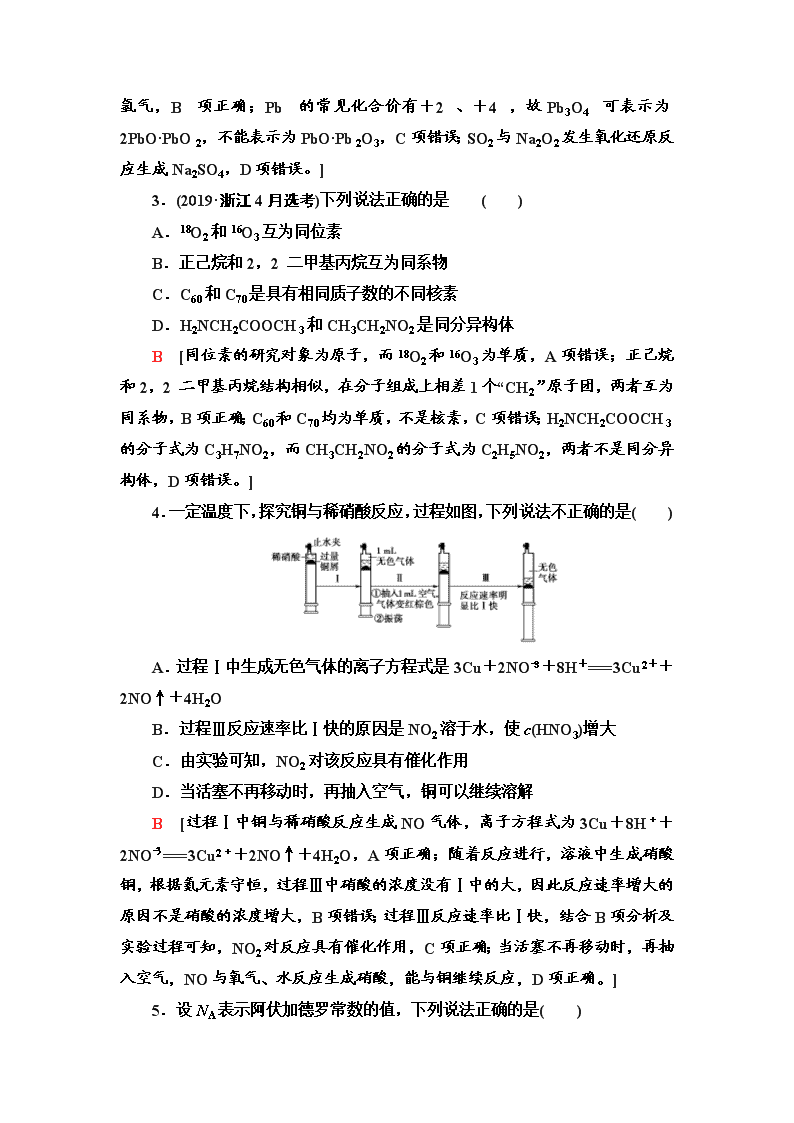
2020年普通高等学校招生统一考试 化学卷(二) (分值:100分,建议用时:90分钟) 可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 Na 23 Fe 56 一、选择题(本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的) 1.化学与生活密切相关。下列说法中正确的是( ) A.水泥、水玻璃、水晶均属于硅酸盐产品 B.防晒霜能够防止强紫外线引起皮肤中蛋白质的盐析 C.利用肥皂水处理蚊虫叮咬,主要是利用肥皂水的弱碱性 D.食品包装盒中的生石灰或铁粉,都可以起到抗氧化作用 C [水泥、水玻璃的主要成分为硅酸盐,属于硅酸盐产品,但水晶的主要成分为二氧化硅,不属于硅酸盐,A错误;紫外线能使蛋白质变性,不是盐析,应注意防晒,B错误;铁在食品包装盒中起到了吸收氧气的作用即抗氧化作用,生石灰不能与氧气反应,可以作干燥剂,不能作抗氧化剂,D错误。] 2.在化学学习与研究中,运用类推的思维方法有时会产生错误的结论,因此类推所得结论要经过实践的检验才能确定其是否正确。下列几种类推结论中正确的是( ) A.由2Cu+O22CuO可推出同族的硫也可发生反应Cu+SCuS B.Na能与水反应生成氢气,则K、Ca也能与水反应生成氢气 C.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3 D.CO2与Na2O2反应只生成Na2CO3和O2,则SO2与Na2O2反应只生成Na2SO3和O2 B [S的氧化性较弱,与Cu反应生成Cu2S,正确的化学方程式为2Cu+SCu2S,A项错误;Na、K、Ca的化学性质比较活泼,都能与水反应生成氢气,B项正确;Pb的常见化合价有+2、+4,故Pb3O4 可表示为2PbO·PbO2,不能表示为PbO·Pb2O3,C项错误;SO2与Na2O2发生氧化还原反应生成Na2SO4,D项错误。] 3.(2019·浙江4月选考)下列说法正确的是 ( ) A.18O2和16O3互为同位素 B.正己烷和2,2二甲基丙烷互为同系物 C.C60和C70是具有相同质子数的不同核素 D.H2NCH2COOCH3和CH3CH2NO2是同分异构体 B [同位素的研究对象为原子,而18O2和16O3为单质,A项错误;正己烷和2,2二甲基丙烷结构相似,在分子组成上相差1个“CH2”原子团,两者互为同系物,B项正确;C60和C70均为单质,不是核素,C项错误;H2NCH2COOCH3的分子式为C3H7NO2,而CH3CH2NO2的分子式为C2H5NO2,两者不是同分异构体,D项错误。] 4.一定温度下,探究铜与稀硝酸反应,过程如图,下列说法不正确的是( ) A.过程Ⅰ中生成无色气体的离子方程式是3Cu+2NO+8H+===3Cu2++2NO↑+4H2O B.过程Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大 C.由实验可知,NO2对该反应具有催化作用 D.当活塞不再移动时,再抽入空气,铜可以继续溶解 B [过程Ⅰ中铜与稀硝酸反应生成NO气体,离子方程式为3Cu+8H++2NO===3Cu2++2NO↑+4H2O,A项正确;随着反应进行,溶液中生成硝酸铜,根据氮元素守恒,过程Ⅲ中硝酸的浓度没有Ⅰ中的大,因此反应速率增大的原因不是硝酸的浓度增大,B项错误;过程Ⅲ反应速率比Ⅰ快,结合B项分析及实验过程可知,NO2对反应具有催化作用,C项正确;当活塞不再移动时,再抽入空气,NO与氧气、水反应生成硝酸,能与铜继续反应,D项正确。] 5.设NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,22.4 L的H2和22.4 L的F2混合后,气体分子数为2NA B.30 g乙酸和葡萄糖混合物中的氢原子数为2NA C.常温下,pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA D.标准状况下,2.24 L C2H6含有的σ键数为0.6NA B [标准状况下,HF是液态,22.4 L的H2和22.4 L的F2混合后,气体分子数少于2NA,A错误; 乙酸和葡萄糖的实验式均为CH2O,相对原子质量为30,30 g乙酸和葡萄糖混合物中的氢原子数为2NA,B正确; 常温下,pH=12的NaOH溶液,由于缺少溶液的体积,水电离出的氢离子无法计算,C错误;1 mol C2H6含有7 mol σ键数,标准状况下,2.24 L C2H6含有的σ键数为0.7NA,D错误。] 6.三种常见单萜类化合物的结构如下图所示。下列说法正确的是( ) A.香叶醇和龙脑互为同分异构体,分子式均为C10H20O B.香叶醇和龙脑均可发生消去反应 C.龙脑分子中所有碳原子在同一个平面上 D.1 mol月桂烯最多能与2 mol Br2发生加成反应 B [根据两者的结构可得,二者的分子式均为C10H18O,A错误;龙脑分子中含有甲基、亚甲基和次甲基,故所有碳原子不可能共平面,C错误;1 mol月桂烯中含3 mol碳碳双键,则最多可与3 mol Br2发生加成反应,D错误。] 7.下列有关实验操作的叙述合理的是( ) A.用pH试纸检测气体的酸碱性时,需要预先润湿 B.蒸馏实验中,忘记加沸石,应立即趁热加入沸石 C.要量取15.80 mL溴水,须使用棕色的碱式滴定管 D.用酸性KMnO4溶液检验FeCl3溶液中混有的Fe2+ A [蒸馏实验中,忘记加沸石,需要先冷却后再加入沸石,以防剧烈的暴沸,B错误;溴水具有强氧化性,应该用酸式滴定管量取,C错误;由于Cl-能被酸性高锰酸钾溶液氧化,所以不能用酸性KMnO4溶液检验FeCl3溶液中混有的Fe2+,D错误。] 8.已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是( ) A.原子半径:Z>Y>X B.B、C的空间构型均为直线形 C.Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质 D.气态氢化物的稳定性:A查看更多