- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第三章晶体结构与性质第二节第2课时原子晶体同步练习新人教版选修32
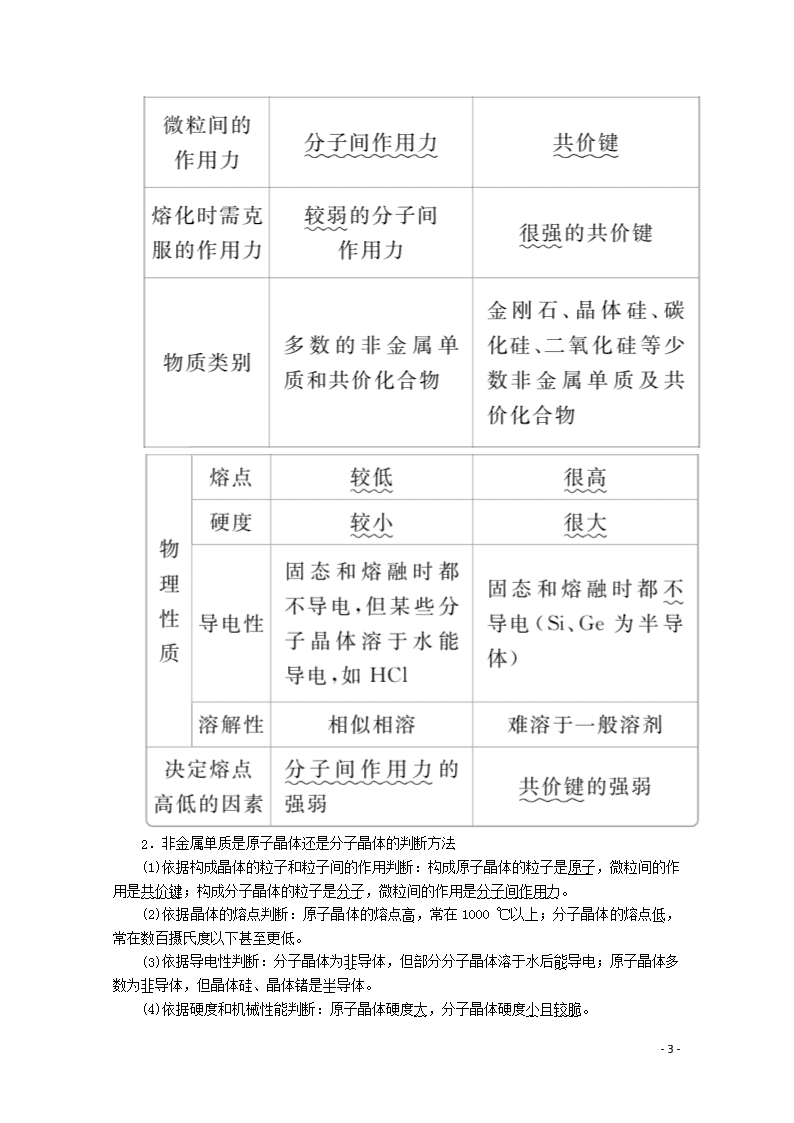
第2课时 原子晶体 [明确学习目标] 了解原子晶体的晶体结构模型及其性质的一般特点;能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 学生自主学习 一、原子晶体及其物理性质 1.原子晶体 所有原子都以共价键相互结合形成三维的共价键网状结构的晶体叫原子晶体。原子晶体又叫共价晶体。 2.常见的原子晶体 (1)某些单质,如硼(B)、硅(Si)、锗(Ge)、灰锡(Sn)等。 (2)某些非金属化合物,如碳化硅(SiC),俗称金刚砂、氮化硼(BN)、氮化硅(Si3N4)等。 3.原子晶体的物理性质 (1)熔点很高。原子晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。因此,原子晶体一般都具有很高的熔点。如金刚石的熔点大于3550 ℃。 (2)硬度高。如金刚石是天然存在的最硬的物质。 (3)一般不导电,但晶体硅是半导体。 (4)难溶于一般的溶剂。 二、典型原子晶体的结构分析 金刚石 (1)每个碳原子都采取sp3杂化,被相邻的4个碳原子包围,以共价单键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四面体的中心。 (2)这些正四面体向空间发展,构成一个坚实的、彼此联结的空间网状晶体。 (3)金刚石晶体中所有的C—C键键长相等(154 pm),键角相等(109°28′)。 - 7 - (4)晶体中最小的碳环由6个碳组成,且不在同一平面内。 (5)晶体中每个碳参与了4条C—C键的形成,而在每条键中的贡献只有一半,故碳原子与C—C键键数之比为1∶2。 1.从结构上说明同族氧化物CO2和SiO2的性质差异。 提示:CO2属于分子晶体,由分子间作用力形成晶体,硬度小、熔点低,而SiO2为原子晶体,由共价键构成立体空间网状结构,硬度大,熔点高。 2.晶体硅中的最小环为几元环? 提示:Si与C为同族元素,晶体硅的结构与金刚石相同,只不过是金刚石结构中的碳原子改为硅原子了。因此晶体硅中的最小环为六元环。 课堂互动探究 一、原子晶体及其物理性质 1.分子晶体与原子晶体的比较 - 7 - 2.非金属单质是原子晶体还是分子晶体的判断方法 (1)依据构成晶体的粒子和粒子间的作用判断:构成原子晶体的粒子是原子,微粒间的作用是共价键;构成分子晶体的粒子是分子,微粒间的作用是分子间作用力。 (2)依据晶体的熔点判断:原子晶体的熔点高,常在1000 ℃以上;分子晶体的熔点低,常在数百摄氏度以下甚至更低。 (3)依据导电性判断:分子晶体为非导体,但部分分子晶体溶于水后能导电;原子晶体多数为非导体,但晶体硅、晶体锗是半导体。 (4)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。 - 7 - [即时练] 1.下列关于原子晶体和分子晶体的说法不正确的是( ) A.原子晶体硬度通常比分子晶体大 B.原子晶体的熔点较高 C.分子晶体中有的水溶液能导电 D.金刚石、水晶和干冰都属于原子晶体 答案 D 解析 由于原子晶体中粒子间以共价键结合,而分子晶体中分子间以分子间作用力结合,故原子晶体比分子晶体的熔点高,硬度大。有些分子晶体溶于水后能电离出自由移动的离子而导电,如H2SO4、HCl等;D选项中的干冰(CO2)是分子晶体,D错。 2.氮化碳晶体是新发现的高硬度材料,该晶体类型应该是________晶体。试根据物质结构推测,氮化碳晶体与金刚石相比较,硬度更大的应该是________晶体,熔点较低的应是________晶体。 答案 原子 氮化碳 金刚石 解析 由于氮化碳为高硬度材料且是由非金属元素组成的,因此该晶体应为原子晶体,又因为C—C键的键长大于C—N键的键长,故C—N键的键能大于C—C键,硬度更大的是氮化碳,熔点较低的为金刚石。 二、二氧化硅晶体的结构分析 (1)SiO2晶体可看成在晶体硅(结构类似于金刚石)的每个Si—Si键中插入1个氧原子而形成的,1个硅原子和4个氧原子形成4个共价键,同时,每个氧原子与2个硅原子相结合形成2个共价键。 (2)每个硅原子与相邻的4个氧原子以共价键相结合构成正四面体结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点,则每个正四面体占有1个完整的硅原子、2个氧原子。因此,二氧化硅晶体中硅原子和氧原子的个数比为1∶=1∶2,化学式为SiO2。最小的环由6个硅原子和6个氧原子组成的12元环;1 mol SiO2中含有4 mol Si—O键。 [即时练] 3.下列说法正确的是( ) A.在含4 mol Si—O键的二氧化硅晶体中,氧原子的数目为4NA - 7 - B.金刚石晶体中,碳原子数与C—C键数之比为1∶2 C.30 g二氧化硅晶体中含有0.5NA个二氧化硅分子 D.晶体硅、晶体氖均是由相应原子直接构成的原子晶体 答案 B 解析 在二氧化硅晶体中,每个硅原子形成4个Si—O键,故含有4 mol Si—O键的二氧化硅晶体的物质的量为1 mol,即含有2NA个氧原子,A项错误;金刚石中每个碳原子均与另外4个碳原子形成共价键,且每两个碳原子形成一个C—C键,故1 mol金刚石中共有2 mol C—C键,因此碳原子与C—C键数目之比为1∶2,B项正确;二氧化硅晶体中不存在分子这种微粒,C项错误;氖晶体是由单原子分子靠分子间作用力结合在一起形成的,属于分子晶体,D项错误。 4.根据SiO2晶体的结构,回答下列问题。 (1)在二氧化硅晶体中有若干环状结构,最小的环状结构由________个原子构成。 (2)在二氧化硅晶体中,硅原子的价电子层原子轨道发生了杂化,杂化的方式是________,O—Si—O夹角是________。 (3)二氧化硅属于重要的无机非金属材料之一,请列举两项二氧化硅的主要用途:①________;②________。 (4)下列说法中正确的是________。 ①凡是原子晶体都含有共价键 ②凡是原子晶体都有正四面体结构 ③凡是原子晶体都具有空间立体网状结构 ④凡是原子晶体都具有很高的熔点 答案 (1)12 (2)sp3 109°28′ (3)①制造石英玻璃 ②制造石英表中的压电材料(也可以答制造光导纤维等) (4)①③④ 本课归纳总结 学习效果检测 1.在金刚石的晶体结构中含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C—C键间的夹角分别是( ) A.6、120° B.5、108° C.4、109°28′ D.6、109°28′ 答案 D - 7 - 解析 金刚石中最小的碳环含有6个碳原子,两个C—C键间的夹角是109°28′。 2.W、X、Y、Z是元素周期表中短周期主族元素,其中X元素的某种原子其核内无中子,Y元素在地壳中含量最丰富,Z元素形成的单质是一种半导体材料,W与Z是同主族元素。下列有关叙述不正确的是( ) A.点燃WX4前要验纯 B.W与Z均可形成熔点高、硬度大的单质 C.Z、W可形成原子晶体 D.Y和Z、Y和W都可形成结构相似的AB2物质 答案 D 解析 根据题意可推出:X为H,Y为O,Z为Si,W为C。CH4是可燃性气体,点燃可燃性气体前要验纯,A正确;C与Si均可形成熔点高、硬度大的单质,B正确;SiC是原子晶体,C正确;Y和Z、Y和W分别形成SiO2和CO2,二者结构有很大区别。 3.C3N4晶体和Si3N4晶体的结构相似,下列说法正确的是( ) A.C3N4晶体和Si3N4晶体中都含有共价键 B.C3N4和Si3N4都易与水反应生成NH3 C.C3N4和Si3N4中N的化合价都为+3 D.C3N4晶体的硬度比Si3N4晶体小 答案 A 解析 C3N4、Si3N4都为原子晶体,原子晶体中含有共价键,A正确;原子晶体难溶于水,也不与水反应,B错误;氮元素的非金属性比碳和硅的强,故在C3N4、Si3N4中氮均显-3价,C错误;C的原子半径比Si小,故C—N键的键能比Si—N键大,则C3N4晶体的硬度比Si3N4晶体大,D错误。 4.D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的立体结构依次是正四面体、三角锥形、正四面体、V形、直线形。回答下列问题。 (1)Y的最高价氧化物的化学式为________。 (2)D和Y形成的化合物,其分子的立体结构为________。 (3)D和X形成的化合物,其化学键类型为________,其晶体类型为________。 (4)试比较D和X的最高价氧化物熔点的高低并说明理由:______________________________________________________________________ ______________________________________________________________________ ____________________________________________________________________。 答案 (1)SO3 (2)直线形 (3)共价键 原子晶体 (4)D的最高价氧化物是CO2,X的最高价氧化物是SiO2,前者比后者的熔点低。因为前者为分子晶体,由分子间作用力结合,而后者为原子晶体,由共价键结合;共价键强度大于分子间作用力 解析 前20号元素的最简氢化物分子的立体结构是正四面体的有CH4和SiH4、三角锥形的有NH3和PH3、V形的有H2O和H2S、直线形的有HF和HCl。由于D、E、X、Y、Z的原子序数依次增加,这样就可以确定D为C、E为N、X为Si、Y为S、Z为Cl。Y的最高价氧化物为三氧化硫。D和Y形成CS2 - 7 - ,由二氧化碳的结构迁移,确定其结构为直线形。D和X形成的SiC是由共价键形成的原子晶体。二氧化碳与二氧化硅的熔点不同主要是晶体的类型不同,二氧化碳是分子晶体,二氧化硅是原子晶体。由于分子间作用力和共价键的强度差距较大,造成熔点前者低后者高。 - 7 -查看更多