- 2021-08-24 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习能力提升训练6化学反应与能量含解析
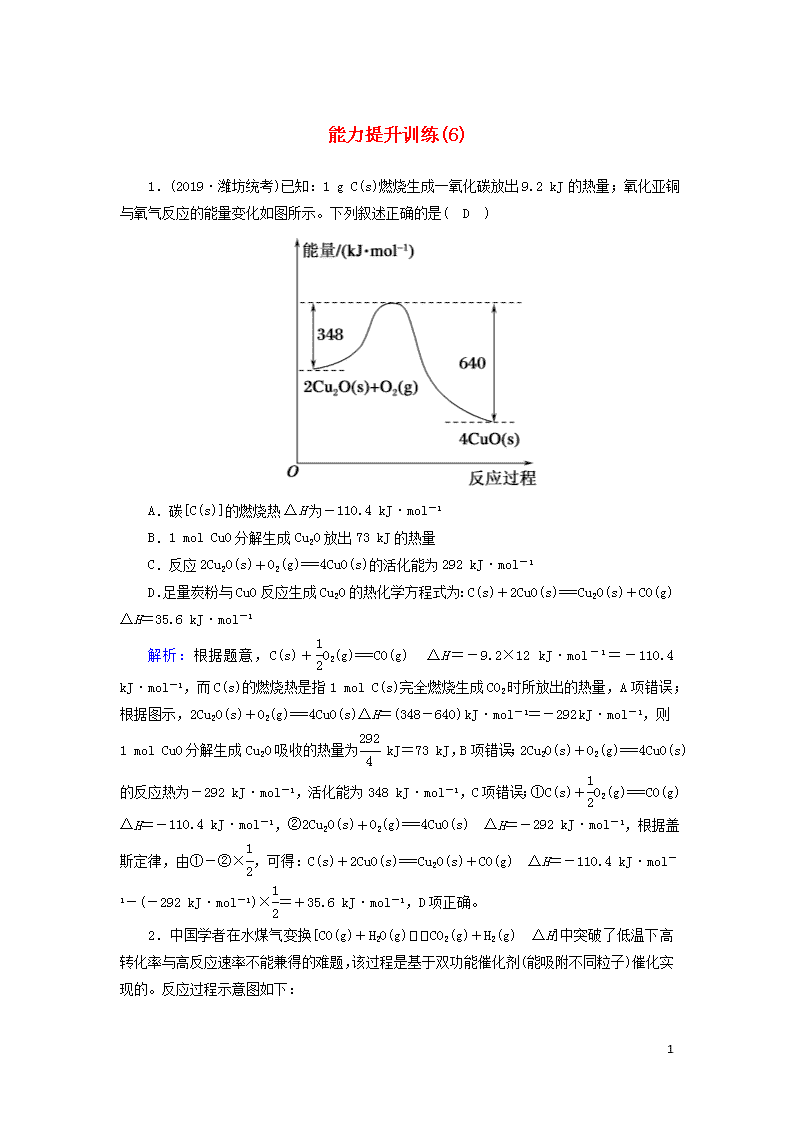
能力提升训练(6) 1.(2019·潍坊统考)已知:1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( D ) A.碳[C(s)]的燃烧热ΔH为-110.4 kJ·mol-1 B.1 mol CuO分解生成Cu2O放出73 kJ的热量 C.反应2Cu2O(s)+O2(g)===4CuO(s)的活化能为292 kJ·mol-1 D.足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)===Cu2O(s)+CO(g) ΔH=35.6 kJ·mol-1 解析:根据题意,C(s)+O2(g)===CO(g) ΔH=-9.2×12 kJ·mol-1=-110.4 kJ·mol-1,而C(s)的燃烧热是指1 mol C(s)完全燃烧生成CO2时所放出的热量,A项错误;根据图示,2Cu2O(s)+O2(g)===4CuO(s)ΔH=(348-640) kJ·mol-1=-292 kJ·mol-1,则1 mol CuO分解生成Cu2O吸收的热量为 kJ=73 kJ,B项错误;2Cu2O(s)+O2(g)===4CuO(s)的反应热为-292 kJ·mol-1,活化能为348 kJ·mol-1,C项错误;①C(s)+O2(g)===CO(g) ΔH=-110.4 kJ·mol-1,②2Cu2O(s)+O2(g)===4CuO(s) ΔH=-292 kJ·mol-1,根据盖斯定律,由①-②×,可得:C(s)+2CuO(s)===Cu2O(s)+CO(g) ΔH=-110.4 kJ·mol-1-(-292 kJ·mol-1)×=+35.6 kJ·mol-1,D项正确。 2.中国学者在水煤气变换[CO(g)+H2O(g)CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下: 9 下列说法正确的是( D ) A.过程Ⅰ、过程Ⅲ均为放热过程 B.过程Ⅲ生成了具有极性共价键的H2、CO2 C.使用催化剂降低了水煤气变换反应的ΔH D.图示过程中的H2O均参与了反应过程 解析:A.根据反应过程示意图,过程Ⅰ中水分子中的化学键断裂的过程为吸热过程,故A错误;B.过程Ⅲ中CO、氢氧原子团和氢原子形成了二氧化碳、水和氢气,H2中的化学键为非极性键,故B错误;C.催化剂不能改变反应的ΔH,故C错误;D.根据反应过程示意图,过程Ⅰ中水分子中的化学键断裂,过程Ⅱ也是水分子中的化学键断裂的过程,过程Ⅲ中形成了水分子,因此H2O均参与了反应过程,故D正确。 3.金属铝分别和O2、O3发生反应生成Al2O3,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol 产物的数据)。下列有关说法中错误的是( C ) A.Al(s)与O3(g)反应生成Al2O3(s)的热化学方程式为2Al(s)+O3(g)===Al2O3(s) ΔH=-1 559.5 kJ·mol-1 B.等质量的O2比O3的能量低 C.1 mol O2完全转化为O3,需吸收142 kJ的热量 D.给3O2(g)2O3(g)的平衡体系加热,有利于O3的生成 解析:O2(g)===O3(g) ΔH=+142 kJ·mol-1,故C项错误。 4.已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)===2CO(g) ΔH2 9 2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5 下列关于上述反应焓变的判断正确的是( C ) A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 解析:C、CO的燃烧都是放热反应,故ΔH1<0、ΔH3<0,A项错误;CO2与C生成CO的反应为吸热反应,则ΔH2>0,铁的氧化为放热反应,则ΔH4<0,B项错误;将第二、三个热化学方程式相加可得第一个热化学方程式,C项正确;将第五个热化学方程式化学计量数同时乘以2后与第四个热化学方程式相加,再将化学计量数同时除以3可得第三个热化学方程式,故ΔH3=,D项错误。 5.下列说法或表示方法正确的是( D ) A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B.由C(金刚石,s)===C(石墨,s) ΔH=-1.90 kJ·mol-1可知,金刚石比石墨稳定 C.氢气的燃烧热为285.8 kJ·mol-1,氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1 D.氢氧化钡晶体与氯化铵晶体混合加热,反应物的总键能高于生成物的总键能 解析:等质量的硫固体和硫蒸气相比,硫蒸气所具有的能量高,所以等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多,A错误;由C(金刚石,s)===C(石墨,s) ΔH=-1.9 kJ·mol-1可知,金刚石能量高,石墨更稳定,B错误;1 mol 氢气燃烧生成液态水时放热285.8 kJ,氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,C错误;氢氧化钡晶体与氯化铵晶体的反应是吸热反应,反应物的总键能高于生成物的总键能,D正确。 6.一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)的能量相对大小如图所示。下列有关说法正确的是( D ) 9 A.a、b、c、d、e中,c最稳定 B.b→a+c反应的活化能为反应物能量减生成物能量 C.b→a+d反应的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=+116 kJ·mol-1 D.一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2 解析:根据氯元素的化合价,a、b、c、d、e依次代表Cl-、ClO-、ClO、ClO、ClO。物质能量越低越稳定,由图可得a、b、c、d、e中,a最稳定,c最不稳定,A错误;反应物总能量-生成物总能量=-ΔH,依据图中数据无法判断b→a+c反应的活化能,B错误;a为Cl-、b为ClO-、d为ClO,b→a+d的方程式为3ClO-===ClO+2Cl-,结合曲线提供的数据,反应热ΔH=64 kJ·mol-1+2×0 kJ·mol-1-3×60 kJ·mol-1=-116 kJ·mol-1,C错误;氧化还原反应遵循得失电子守恒,Cl2与NaOH溶液反应生成的产物有a(Cl-)、b(ClO-)、d(ClO),氯元素化合价由0价降为-1价、升为+1价和+5价,由得失电子守恒得n(Cl-)=n(ClO-)+5n(ClO),当溶液中a、b、d的浓度之比为11∶1∶2时上述得失电子守恒式成立,D正确。 7.利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。 下列推断正确的是( B ) A.2H2O2(l)2H2O(l)+O2(g) ΔH>0 9 B.N2O4(g)2NO2(g) ΔH>0 C.烧瓶A中气体颜色比烧瓶B中的深 D.2 mol NO2(g)的总能量低于1 mol N2O4(g)的总能量 解析:由图(a)可知,H2O2的分解反应是放热反应,即ΔH<0,A项错误;由图(b)知,NO2生成N2O4时放出热量,则N2O4分解时吸收热量,B项正确;对于图(c),因为NO2呈红棕色,B对应烧杯中水的温度较高,促进平衡2NO2(g)N2O4(g)ΔH<0向左移动,故烧瓶B中气体颜色加深,C项错误;根据图(b)知,2 mol NO2(g)的总能量高于1 mol N2O4(g)的总能量,D项错误。 8.已知几种化学键的键能和热化学方程式如下: 化学键 H—N N—N Cl—Cl N≡N H—Cl 键能/(kJ·mol-1) 391 193 243 946 432 N2H4(g)+2Cl2(g)===N2(g)+4HCl(g) ΔH。下列推断正确的是( C ) A.H(g)+Cl(g)===HCl(g) ΔH=+432 kJ·mol-1 B.断裂1 mol Cl—Cl键吸收能量比断裂1 mol N≡N键多703 kJ C.上述反应中,ΔH=-431 kJ·mol-1 D.上述反应中,断裂极性键和非极性键,只形成极性键 解析:形成化学键时放出能量,A项错误;根据表格数据知,氯氯键的键能小于氮氮三键键能,B项错误;反应热等于断裂化学键的总键能与形成化学键的总键能之差,ΔH=(391×4+193+243×2-946-432×4) kJ·mol-1=-431 kJ·mol-1,C项正确;反应物N2H4中含极性键和非极性键,氯气中含非极性键,产物氮气中含非极性键,氯化氢中含极性键,所以该反应中断裂和形成的化学键都有极性键和非极性键,D项错误。 9.重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业可用重晶石制备BaS。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知: ①BaSO4(s)+4C(s)===BaS(s)+4CO(g) ΔH=+571 kJ·mol-1 ②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ③2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1 由此推出的下列结论不正确的是( C ) A.BaSO4(s)+2C(s)===BaS(s)+2CO2(g) ΔH=+226 kJ·mol-1 B.C(s)+CO2(g)===2CO(g) 9 ΔH=+172.5 kJ·mol-1 C.C(g)+CO2(g)===2CO(g) ΔH>+172.5 kJ·mol-1 D.实际生产中必须加入过量的碳使BaSO4得到充分的还原,同时还要通入空气 解析:由盖斯定律①+②×2-③×2可知,A项正确;由盖斯定律③-②可知,B项正确;C(g)+CO2(g)===2CO(g)的反应热小于172.5 kJ·mol-1,C项错误;过量的碳不仅有利于使BaSO4得到充分的还原,而且可与通入的空气反应放出热量,维持反应进行,D项正确。 10.向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示。下列说法正确的是( B ) A.反应HCO(aq)+H+(aq)===CO2(g)+H2O(l)为放热反应 B.CO(aq)+2H+(aq)===CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3 C.ΔH1>ΔH2,ΔH2<ΔH3 D.H2CO3(aq)===CO2(g)+H2O(l),若使用催化剂,则ΔH3变小 解析:由题图可知,反应物具有的总能量低于生成物具有的总能量,则反应HCO(aq)+H+(aq)===CO2(g)+H2O(l)为吸热反应,A错误;反应CO(aq)+2H+(aq)===CO2(g)+H2O(l)分三步进行:CO(aq)+2H+(aq)―→HCO(aq)+H+(aq)―→H2CO3(aq)―→CO2(g)+H2O(l),则该反应的ΔH=ΔH1+ΔH2+ΔH3,B正确;由图可知,反应CO(aq)+2H+(aq)===HCO(aq)+H+(aq)放出的能量比反应HCO(aq)+H+(aq)===H2CO3(aq)放出的能量多,则有ΔH1<ΔH2,C错误;使用催化剂能改变反应的活化能,从而改变反应速率,但反应热不变,故ΔH3不变,D错误。 11.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1 下列选项不正确的是( C ) A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) 9 ΔH=-867 kJ·mol-1 B.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l)ΔH3<ΔH1 C.若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ D.若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol 解析:A项,得出:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH= kJ·mol-1=-867 kJ·mol-1,正确;B项,H2O(g)===H2O(l) ΔH<0,因此两式相加,ΔH3<ΔH1,正确;C项,根据A选项,放出热量为(867×0.2) kJ=173.4 kJ,但没有说明H2O的状态,若是气态,则正确,若是液态,则大于173.4 kJ,不正确;D项,根据A选项,消耗1 mol CH4转移8 mol e-,则消耗0.1 mol CH4转移电子为0.8 mol,正确。 12.已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。试回答问题: (1)写出氢气燃烧的热化学方程式:H2(g)+O2(g)===H2O(l) ΔH=-286 kJ·mol-1。 (2)若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出热量<(填“>”“<”或“=”)890 kJ。 (3)若将a mol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水时,则放出热量(Q)的取值范围是283a_kJ查看更多
相关文章
- 当前文档收益归属上传用户