- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019学年高一化学下学期期末调研考试试题 新人教版
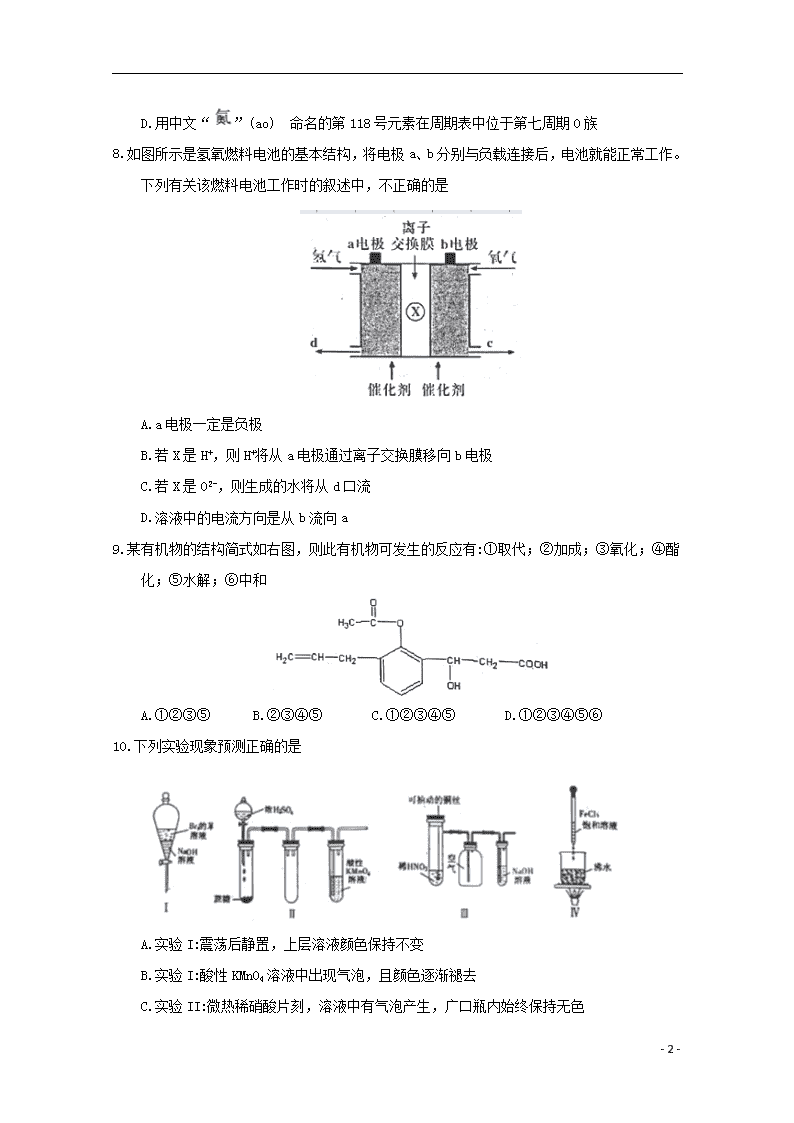
2019学年高一化学下学期期末调研考试试题 可能用到的相对原子质量: H.1 O.16 Fe.56 Cu.64 Zn.65 S.32 一、选择题(本题共16小题,每题3分,共48分。每题只有一个选项符合题意) 1.苏轼的《格物粗淡》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指 A.甲烷 B.脱落酸 C.乙烯 D.生长素 2.假设x是第IIB族中元素的原子序数,那么原子序数为x+1的元素在 A.IB族 B.IIA族 C.IIB族 D.IA族 3.下列反应既是氧化还原反应,又是吸热反应的是 A.灼热的炭与CO2反应 B.氧化铁与铝反应 C.钠与乙醇反应 D.Ba(OH)2·8H2O与NH4C1反应 4.下列有关电子式的书写正确的是 A. N2的电子式 B. NH4Cl的电子式 C. HClO的电子式 D. CO2的电子式 5.下列物质中既有离子键又有共价键的可溶性化合物是 A.H2SO4 B.BaSO4 C.N2 D.NaOH 6.下列各组大小关系比较中错误的是 A.热稳定性:NaHCO3>Na2CO3 B.酸性: H2CO3>HClO C.氧化性:稀硝酸>稀硫酸 D.结合OH-的能力: Fe3+>NH4+ 7.根据元素周期表和元素周期律,判断下列叙述不正确的是 A.气态氢化物的稳定性: H2O>NH3>SiH4 B.氢元素与其他元素可形成共价化合物或离子化合物 C. 如图所示实验可证明元素的非金属性:Cl>C>Si - 7 - D.用中文“”(ao) 命名的第118号元素在周期表中位于第七周期0族 8.如图所示是氢氧燃料电池的基本结构,将电极a、b分别与负载连接后,电池就能正常工作。下列有关该燃料电池工作时的叙述中,不正确的是 A.a电极一定是负极 B.若X是H+,则H+将从a电极通过离子交换膜移向b电极 C.若X是O2-,则生成的水将从d口流 D.溶液中的电流方向是从b流向a 9.某有机物的结构简式如右图,则此有机物可发生的反应有:①取代;②加成;③氧化;④酯化;⑤水解;⑥中和 A.①②③⑤ B.②③④⑤ C.①②③④⑤ D.①②③④⑤⑥ 10.下列实验现象预测正确的是 A.实验I:震荡后静置,上层溶液颜色保持不变 B.实验I:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 C.实验II:微热稀硝酸片刻,溶液中有气泡产生,广口瓶内始终保持无色 - 7 - D.实验IV:滴入FeCl3饱和溶液后,可形成带电的胶体,该分散系导电能力增强 11.在可以溶解氧化铝的溶液中,一定能大量共存的离子组是 A.NH4+、Na+、S2-、 SO32- B.Na+、K+、Cl-、SO42- C.Ca2+、Fe2+、NO3-、Br- D.K+、AlO2-、I-、SO42- 12.一定温度下,某密闭恒容的容器内可逆反应A(g)+3B(g)2C(g)达到平衡状态的标志 A.A的消耗速率是C的分解速率1/2倍 B.容器内混合气体的密度不随时间而变化 C.单位时间内生成nmolA,同时生成3nmolB D.A、B、C的分子数之比为1:3:2 13.根据下表信息,判断以下叙述正确的是 部分短周期元素的原子半径及主要化合价 元素半径 L M Q R T 原子半径/nm 0.166 0.143 0.112 0.104 0.066 主要化合价 +2 +3 +2 +6、-2 -2 A.氢化物的沸点为H2T查看更多