超级全能生2020高考全国卷24省1月联考甲卷试题 化学
秘密★启用前
“超级全能生”2020高考全国卷24省1月联考甲卷
化学
注意事项:
1.本试题卷共14页,满分300分,考试时间150分钟。
2.答题前,考生务必将自己的姓名、准考证号等填写在答题卡的相应位置。
3.全部答案在答题卡上完成,答在本试题卷上无效。
4.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
5.考试结束后,将本试题卷和答题卡-并交回。
可能用到的相对原子质量:H1 C12 N14 O16 Al27 S32 Fe56 Cu64
一、选择题(本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的)
7.2019年起全国地级及以上城市全面启动生活垃圾分类工作。城市垃圾分类是在源头将垃圾分类投放、清运、回收,使之重新变成资源。以下说法正确的是
A.废旧玻璃属于可回收垃圾,其主要成分为新型无机非金属材料
B.废旧电池属于有害垃圾,因含有重金属,故采用深挖填埋的方式进行处理
C.食品包装塑料袋属于其他垃圾,其主要成分聚氯乙烯为有机高分子化合物
D.茶叶果皮属于厨余垃圾,可通过转化变为有机氮肥
8.设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L二氯甲烷中含有的原子数目为0.5NA
B.常温常压下,46 g C2H6O中含C-H键的数目一定为5NA
C.25℃时,1.0 L pH=12的Na2CO3溶液中由水电离出的OH-的数目为0.01NA
D.1.0 L 0.5 mol·L-1 FeBr2溶液与1 mol Cl2反应时转移的电子数目为2NA
9.分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有
A.4种 B.8种 C.10种 D.12种
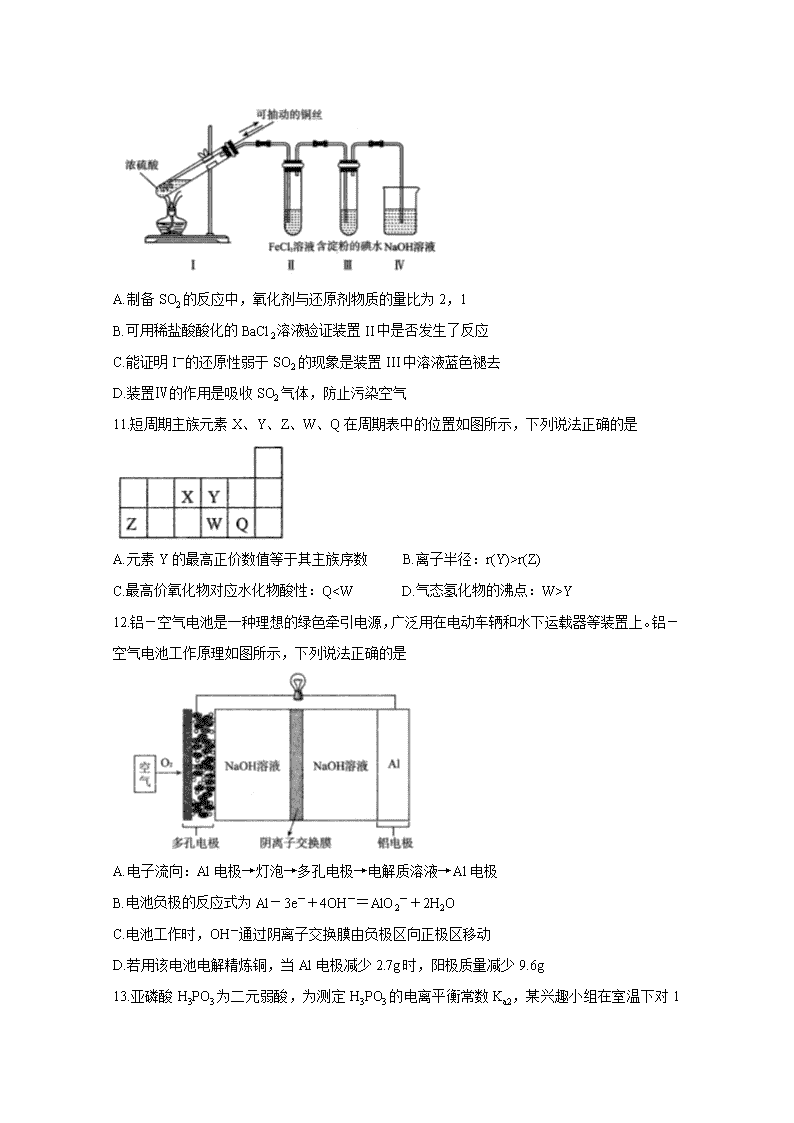
10.某研究性学习小组为制备并探究SO2的还原性,设计的装置如图所示,下列有关叙述不正确的是
A.制备SO2的反应中,氧化剂与还原剂物质的量比为2,1
B.可用稀盐酸酸化的BaCl2溶液验证装置II中是否发生了反应
C.能证明I-的还原性弱于SO2的现象是装置III中溶液蓝色褪去
D.装置Ⅳ的作用是吸收SO2气体,防止污染空气
11.短周期主族元素X、Y、Z、W、Q在周期表中的位置如图所示,下列说法正确的是
A.元素Y的最高正价数值等于其主族序数 B.离子半径:r(Y)>r(Z)
C.最高价氧化物对应水化物酸性:Q
Y
12.铝-空气电池是一种理想的绿色牵引电源,广泛用在电动车辆和水下运载器等装置上。铝-空气电池工作原理如图所示,下列说法正确的是
A.电子流向:Al电极→灯泡→多孔电极→电解质溶液→Al电极
B.电池负极的反应式为Al-3e-+4OH-=AlO2-+2H2O
C.电池工作时,OH-通过阴离子交换膜由负极区向正极区移动
D.若用该电池电解精炼铜,当Al电极减少2.7g时,阳极质量减少9.6g
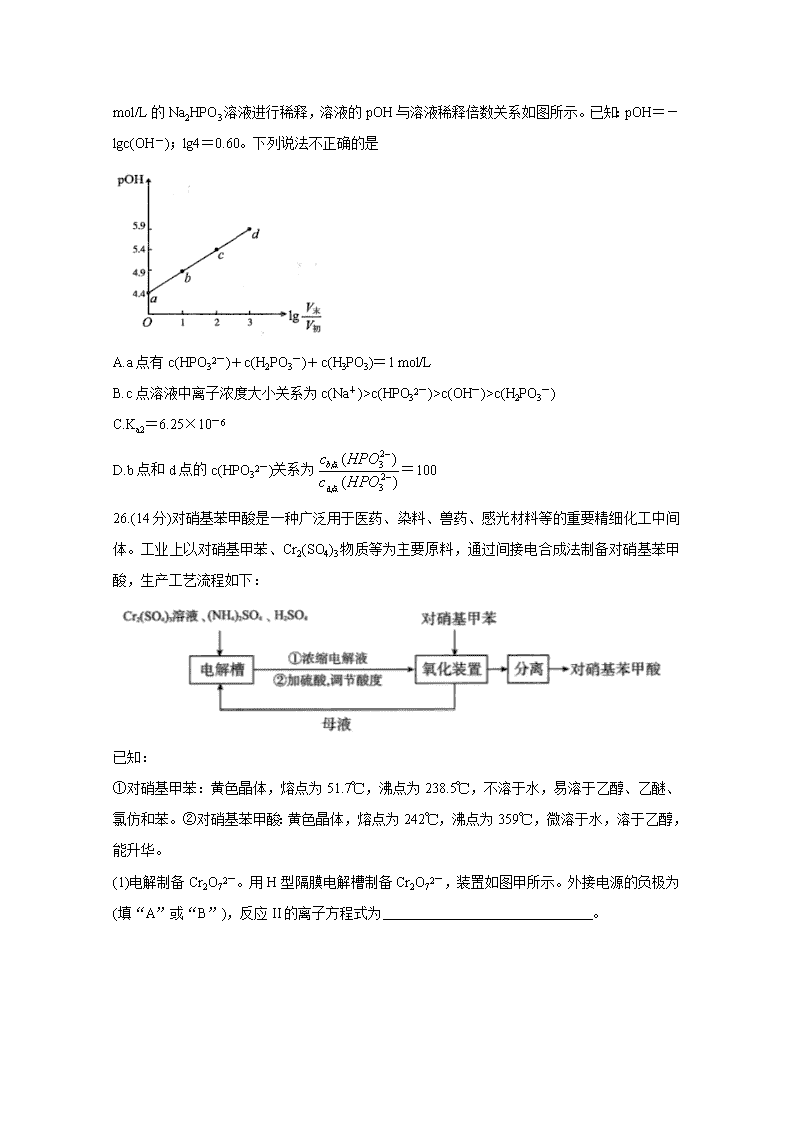
13.亚磷酸H3PO3为二元弱酸,为测定H3PO3的电离平衡常数Ka2,某兴趣小组在室温下对1
mol/L的Na2HPO3溶液进行稀释,溶液的pOH与溶液稀释倍数关系如图所示。已知:pOH=-lgc(OH-);lg4=0.60。下列说法不正确的是
A.a点有c(HPO32-)+c(H2PO3-)+c(H3PO3)=1 mol/L
B.c点溶液中离子浓度大小关系为c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)
C.Ka2=6.25×10-6
D.b点和d点的c(HPO32-)关系为=100
26.(14分)对硝基苯甲酸是一种广泛用于医药、染料、兽药、感光材料等的重要精细化工中间体。工业上以对硝基甲苯、Cr2(SO4)3物质等为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
已知:
①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
(1)电解制备Cr2O72-。用H型隔膜电解槽制备Cr2O72-,装置如图甲所示。外接电源的负极为 (填“A”或“B”),反应II的离子方程式为 。
(2)氧化制备对硝基苯甲酸。用图乙所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250mL三口烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴加热下恒温反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解,供循环使用。
步骤3:把步骤2中抽滤所得的固体溶于5%的热NaOH溶液中(约60℃),当温度降到50℃时,抽滤,向滤液中加入过量的2 mol/L硫酸溶液,析出黄色沉淀,再抽滤,并用冷水洗涤沉淀,然后在低于80℃的条件下烘干,即可得到粗产品。
①仪器X的名称是 ,冷却水应从 (填“a”或“b”)口进入。
②步骤2中,抽滤所得固体的主要成分是 。
③步骤3中,需要在温度降到50℃时进行抽滤的原因是 。
④根据对硝基苯甲酸的有关性质可知,精制(纯化)对硝基苯甲酸粗品还可以采用 法。
⑤该合成技术的优点是实现了 (填化学式)的重复利用,绿色环保。
(3)测定对硝基苯甲酸的纯度。称取1.670 g粗产品,配成100 mL对硝基苯甲酸溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则样品中对硝基苯甲酸的纯度为
27.(15分)锰及其化合物被广泛应用于工农业生产,与锰相关的化合物中有约80%都以硫酸锰为基础原料制得。如图所示模拟化工生产流程,以软锰矿为原料制备单质锰和高锰酸钾。
已知1:软锰矿的杂质主要是硅、铁、铝、钙、铅的氧化物。
已知2:室温下一些离子的难溶氢氧化物在不同浓度和pH下的沉淀图
I.两种途径的第一步均为制备硫酸锰。
①途径“一般用稀硫酸浸泡软锰矿和黄铁矿(FeS2),该步反应的化学方程式为 。
②途径I利用发电厂废气中的SO2还原软锰矿。若不考虑杂质参加反应,制备等量的MnSO4,两种途径中所添加的还原剂质量之比为 。
③为加快反应速率,可采用的措施有 。
A.升高温度 B.增加压强 C.适当增加酸的浓度 D.粉碎矿石 E.搅拌
11.若采用途径II制备硫酸锰,回答以下问题:
①溶液A中加入MnO2后发生的主要反应的离子方程式为 。
②一般选择加入CaCO3固体调整溶液的pH,若实现铁的分离,溶液的pH控制范围大约为 。
③滤渣B的主要成分是 。
④已知Ksp(PbSO4)=2.2×10-8、Ksp(PbS)=1×10-28,溶液D满足电解的条件是c(Pb2+)≤2×10-9 mol/L。请通过计算、用必要的化学语言分析选用含硫净化剂的必要性: 。
⑤已知金属锰的化学性质类似于金属镁,洗涤时应注意 。
28.(14分)氨是一种重要的含氮化合物,在自然界中很少单独存在。工业生产氨的方法是在高温、高压和有催化剂存在的条件下,氮气与氢气化合生产氨。请按要求回答下列问题:
(1)用甲烷与水蒸气制取氢气。已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,1 mol水蒸气转化为液态水时放出44.0 kJ的热量。试写出CH4(g)与H2O(g)反应生成H2(g)和CO(g)的热化学方程式: 。
(2)-氧化碳变换为CO2。将CO和H2O(g)按一定比例混合,在变换催化剂的作用下发生反应CO(g)+H2O(g)CO2(g)+H2(g)。
①温度对反应速率的影响如图所示,试说明图中曲线先增大后减小的可能原因: 。
②不同温度下变换反应的平衡常数如表:
由以上数据变化可知: (填“降低”或“升高”)温度有利于变换反应正向进行,使变换气中残余CO的含量降低。
(3)氨气的合成。在2L密闭容器中,投入1 mol N2和3 mol H2,在不同温度和压强、使用相同催化剂条件下反应合成NH3,测得平衡混合物中氨的体积分数如图所示。
①下列能说明该反应已达到平衡状态的是 (填序号)。
A.断开1个N≡N键的同时有6个N-H键形成 B.3v正(H2)=2v逆(NH3)
C.混合气体的平均相对分子质量不再改变 D.△H保持不变
②若分别用和vB(NH3)表示从反应开始至平衡状态A、B时的化学反应速率,则vA(NH3) (填“>”“<”或“=”)vB(NH3)。
③在250℃,1.0×104 kPa下,若反应进行到20 min时达到平衡状态,用H2的浓度变化表示反应速率vC(H2)= ,该温度下的平衡常数Kp= (Kp是用平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数;保留三位有效数字)。
(4)氨催化分解既可防治氨气污染,又能得到氢能源。在Co-Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到氨气转化率随温度变化曲线如图,温度高时NH3的转化率接近平衡转化率的原因是 。
35.[化学-物质结构与性质](15分)
电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题、观察图片,回答问题。
I.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。
(1)图1中化学键σ键与π键之比为 ;图2中碳原子的杂化方式为 。
(2)图3中,储电材料的分子式可以表示为 。
(3)碳元素与氮元素的电负性大小关系为 。氮元素与氧元素的第一电离能大小关系为 。
(4)碳的最高价含氧酸根的空间构型是 ;硝酸的酸性强于亚硝酸的原因是 。
II.传统锂电池的主要成分是LiCoO2,其晶胞结构如图所示;因结构中存在笼状空隙,
可以与Ni和Mn发生位置替换,形成储电性能更加优良的化合物。
(5)基态Co原子的价电子排布式为 ;化合物LiCoO2中O元素在晶胞中的位置,除了位于六棱柱的顶点外,其他具体位置是 。
(6)已知化合物中各原子半径依次为:Li=a,Ni=b,Mn=c,Co=d,O=e,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为 (用含有a、b、c、d、e、m、n的式子表示)。
36.[化学-有机化学基础](15分)
盐酸巴氯芬是一种用于改善骨骼肌痉挛的口服片剂。下面是它的一种合成路线(具体反应条件和部分试剂略):
已知:①RCOOHRCOCl
②H3C-CHOH3C-CH=CH-COOH
(1)A是一种芳香烃,则B的名称为 ,B→C的反应类型为 。
(2)H中所含官能团的名称为 。
(3)写出F→G反应的化学方程式: 。
(4)C的同分异构体中能与FeCl3溶液发生显色反应的有 种,其中核磁共振氢谱有3种峰且峰面积之比为2:2:1的结构简式为 。
(5)人们将连有四个不同基团的碳原子形象地称为手性碳原子。请你判断盐酸巴氯芬中有
个手性碳原子。
(6)由B开始制取E的合成路线有多种,请将下列合成路线中的相关内容补充完整,有机物写结构简式,无机物写分子式。