- 2021-08-24 发布 |
- 37.5 KB |
- 25页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新教材高中化学第二章元素与物质的分类第二节第2课时电解质在水溶液中的反应课件鲁科版必修1
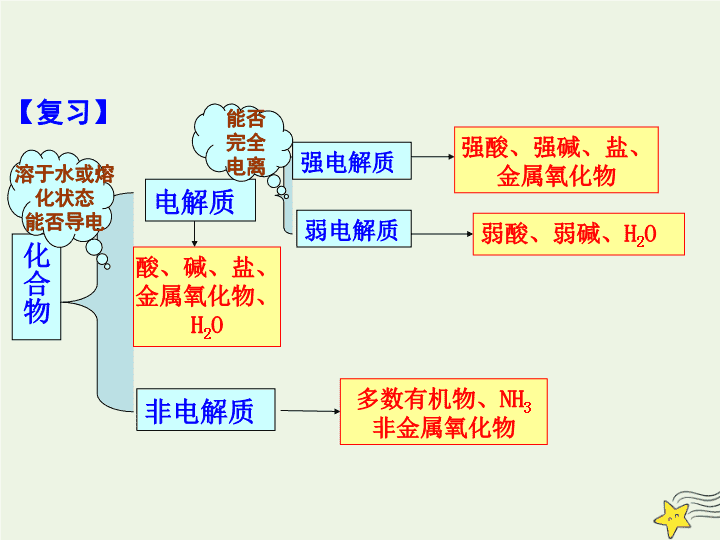
第 2 节 电解质 学习目标 1. 准确理解电解质在水溶液中反应的实质 2. 掌握酸、碱、盐之间离子反应发生的条件 3. 掌握离子方程式的书写方法,并能书写简单的离子方程式 4. 明确离子方程式的意义 第 2 课时 电解质在水溶液中的反应 【 复习 】 化合物 电解质 非电解质 强电解质 弱电解质 酸、碱、盐、 金属氧化物、H 2 O 强酸、强碱、盐、 金属氧化物 弱酸、弱碱、H 2 O 多数有机物、NH 3 非金属氧化物 溶于水或熔 化状态 能否导电 能否 完全 电离 【 自我诊断 】 有以下 10 种物质: ① 铜, ② 稀硫酸, ③ 氯化氢, ④ 氨气, ⑤ 氟化氢, ⑥ 二氧化碳, ⑦ 乙酸, ⑧ 氯化钠, ⑨ 碳酸钙, ⑩ 氯气。结合下表中提示的信息,把符合条件的物质的序号填入相应的位置。 (1) 属于电解质的是 ______________________ ; (2) 属于非电解质的 _____________________ ; (3) 属于强电解质的是 ____________________ ; (4) 属于弱电解质的是 ____________________ ; (5) 既不是电解质也不是非电解质的是 ______ ; ③⑤⑦⑧⑨ ④⑥ ③⑧⑨ ⑤⑦ ①②⑩ 思考: NaHSO 4 溶于水时能电离出 H + , NaHSO 4 属于酸吗? 离子反应 问题探究 一 将稀硫酸滴入含有酚酞的 Ba(OH) 2 溶液中 现象 1 现象 2 现象 3 电流表指针偏转角度由 __ 变 __ 又变 __ 溶液颜色由 __ 变 __ 有 _______ 生成 红 无 白色沉淀 观察思考: 向 0.01mol/LBa(OH) 2 溶液中滴加 0.2mol/LH 2 SO 4 溶液 大 大 小 实验现象 产生现象的原因 ② 溶液的红色逐渐变浅,直至消失; ① 不断产生白色沉淀; ③ 指针不断偏向零,再滴加时,又不断偏大。 ② 溶液中 OH - 离子浓度逐渐减小 ① 生成了 BaSO 4 白色沉淀; ③ 溶液中离子浓度先减小,有离子参加了反应,硫酸过量后离子浓度又增加。 提示: 反应方程式: + Ba(OH) 2 + H 2 SO 4 = BaSO 4 +2 H 2 O Ba 2+ + 2OH - 2H + SO 4 2- BaSO 4 ↓ ( 生成难溶物质 ) + 2H 2 O ( 生成难电离的物质 ) + 氢氧化钡与稀硫酸反应的实质是什么? 实质 : 稀硫酸与氢氧化钡溶液的反应,实质上是 H + 与 OH - 发生反应、 Ba 2 + 与 SO 4 2 - 发生反应 , 反应物中离子浓度减少,即离子间发生了反应。 离子反应: 在 溶液中 有离子参加的化学反应 叫做离子反应 。 离子反应的实质: 反应物中某些离子浓度的减小。 练习 1 下列反应不属于离子反应的是 A 实验室用氯酸钾制取氧气 。 B 实验室用大理石和稀盐酸制取二氧化碳。 C 实验室用锌粒和稀硫酸制取氢气。 D 工业上用石灰石制取生石灰。 练习 1 迁移应用 分析下列溶液的离子组成,判断混合后能否发生反应,能反应的分析反应的实质。 1 、 NaOH 溶液与盐酸混合 2 、 Na 2 CO 3 溶液和盐酸混合 3 、 KCl 溶液与 AgNO 3 溶液混合 4 、 NaOH 溶液与 K 2 SO 4 溶液混合 H + 与 OH - 结合生成难电离的水 CO 3 2- 与 H + 结合生成 H 2 O 和 CO 2 气体 Cl - 与 Ag + 结合生成 AgCl 沉淀; 不反应 酸、碱、盐在溶液中发生复分解反应的条件?溶液中离子间不能大量共存的条件? 1 、生成难电离的物质: 2 、生成易挥发的物质(气体) : 3 、生成难溶物质(沉淀): 水、弱酸 (CH 3 COOH HClO) 、弱碱 (NH 3 · H 2 O) 等 CO 2 等 BaSO 4 、 AgCl 、 CaCO 3 、 BaCO 3 、 Mg(OH) 2 、 Fe(OH) 3 、 Cu(OH) 2 、 Al(OH) 3 等 小结 练习 2 下列能发生离子反应的是 A KCl 溶液与 NaOH 溶液混合 B AgNO 3 溶液与 NaCl 溶液混合 C Na 2 CO 3 溶液与 Ca(OH) 2 溶液混合 D NaCl 溶液与 Ca(NO 3 ) 2 溶液混合 练习 2 离子方程式 问题探究 二 离子反应方程式: —— 用 实际参加反应的离子符号 表示离子反应的式子叫做离子方程式 离子方程式的书写: ① “ 写 ” ,写正确的化学方程式 ② “ 拆 ” ,把易溶于水且易电离的物质( 强酸、强碱、可溶性的盐 )写成离子形式,其他物质写化学式 ③ “ 删 ” ,删去两边没反应的离子 ④ “ 查 ” ,检查方程式两边各元素、原子个数和电荷数是否守恒,系数最简。 —— 基础 —— 关键 —— 途径 —— 保证 强酸强碱及盐的溶解性 强酸 强碱 HCl 、 H 2 SO 4 、 HNO 3 、 HClO 4 、 HBr 、 HI 盐溶解性 全部可溶 钾、钠、铵盐、硝酸盐 氯化物 除 AgCl 外绝大部分可溶 硫酸盐 除 BaSO 4 外( CaSO 4 、 Ag 2 SO 4 微溶) 绝大部分可溶 碳酸盐 除钾、钠、铵的碳酸盐外绝大部分不可溶 笔记 NaOH KOH Ca(OH) 2 Ba(OH) 2 Ag + +NO 3 - + H + +Cl - ==AgCl ↓ + H + +NO 3 - 离子方程式的书写步骤: 写、改、删、查 写: 改: 查: AgNO 3 溶液与 HCl 溶液反应 删: AgNO 3 + HCl ==AgCl ↓ + HNO 3 Ag + +NO 3 - + H + +Cl - ==AgCl ↓ + H + +NO 3 - Ag + +Cl - ==AgCl ↓ 离子方程式的书写步骤: 写、改、删、查 稀盐酸 与 氢氧化钡 溶液反应 a 、写:写出反应的化学方程式: b 、改:把 强酸、强碱、易溶于水的盐 改写为离子形式,其他物质用化学式表示 : Ba(OH) 2 +2HCl=BaCl 2 +2H 2 O Ba 2+ +2OH - +2H + +2Cl - =Ba 2+ +2Cl - +2H 2 O c 、删:删去等号两边未反应的离子 d 、查:检查离子方程式两边各元素的原子个数及电荷总数是否相等,得到离子方程式: OH - +H + =H 2 O H + +OH - =H 2 O Ba 2+ +SO 4 2- =BaSO 4 ↓ 1 、 NaOH 溶液与 H 2 SO 4 溶液的反应 2 、 KOH 溶液与盐酸的反应 3 、 BaCl 2 溶液和 Na 2 SO 4 溶液的反应 4 、 Ba(NO 3 ) 2 溶液中加 Na 2 SO 4 溶液的反应 6 、碳酸钙与盐酸溶液反应 CaCO 3 +2H + =Ca 2+ +H 2 O+CO 2 ↑ 5 、 碳酸钠与盐酸溶液反应 CO 3 2- +2H + =H 2 O+CO 2 ↑ 正确书写离子方程式应注意的问题:离子方程式正误的快速判断法 1. 尊重客观事实。不能主观臆造 2. 看清存在的形式,拆分必须得当 3. 遵循两个守恒。左右两边配平 离子方程式的意义 问题探究三 H + +OH - =H 2 O Ba 2+ +SO 4 2- =BaSO 4 ↓ 1 、 NaOH 溶液与 H 2 SO 4 溶液的反应 2 、 KOH 溶液与盐酸的反应 3 、 BaCl 2 溶液和 Na 2 SO 4 溶液的反应 4 、 Ba(NO 3 ) 2 溶液中加 Na 2 SO 4 溶液的反应 思考:离子方程式和化学方程式的联系和区别是什么? 1. 都可以用来表示化学反应 2. 化学方程式只能表示一个具体的化学反应 3. 离子方程式不但可以表示一个反应,而且可以表示一类反应,并揭示这类反应的实质 2 、检验某些离子的存在 取少量溶液于试管中,先加入几滴 AgNO 3 溶液,若产生白色沉淀,再滴加足量稀硝酸,沉淀不消失,证明含 Cl - 取少量溶液于试管中, 先加入足量的稀盐酸,无沉淀生成,再加入几滴 BaCl 2 溶液 ,若产生白色沉淀,证明含 SO 4 2- Cl - 的检验: SO 4 2- 的检验 : 1 、离子反应、离子反应方程式的概念 2 、离子反应发生的条件: 3 、离子反应方程式书写: 4 、离子方程式的意义 难溶、难电离、易挥发 强酸、强碱、可溶性盐 写、改、删、查 揭示反应的实质;表示一类化学反应 小结查看更多