- 2021-08-24 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新疆阿克苏市阿瓦提县第四中学2020届高三上学期月考化学试题
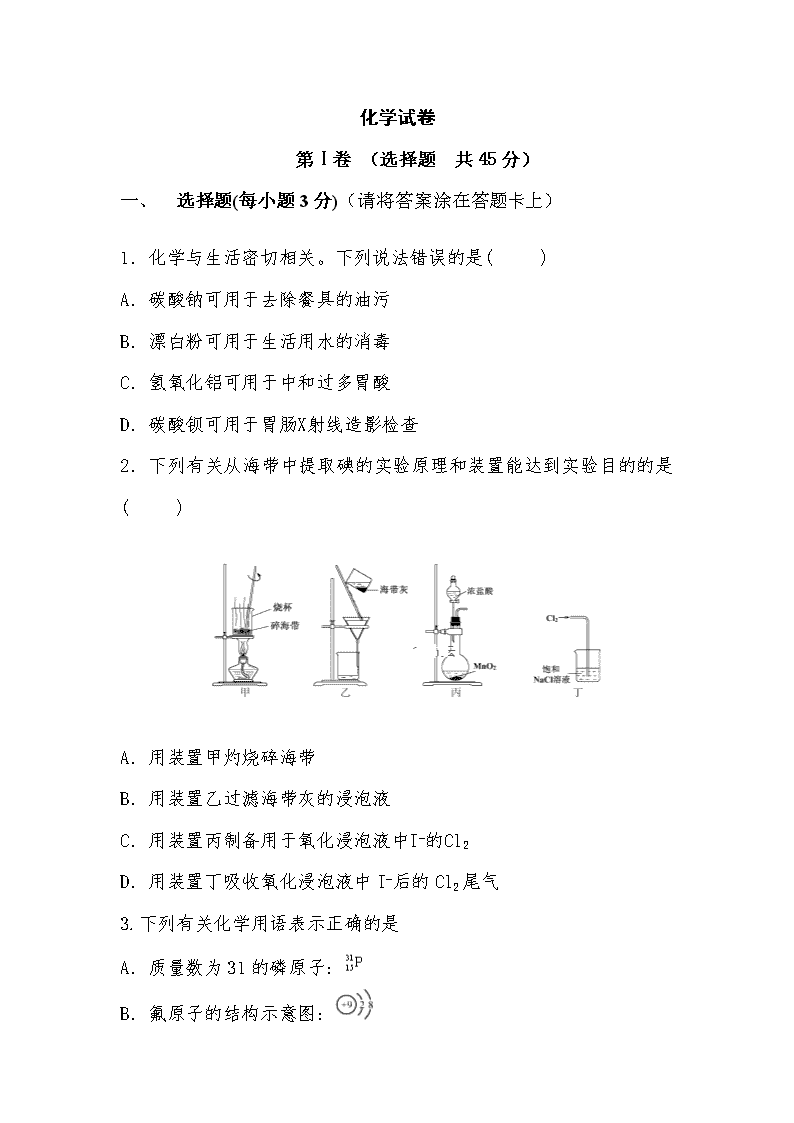
化学试卷 第Ⅰ卷 (选择题 共45分) 一、 选择题(每小题3分)(请将答案涂在答题卡上) 1.化学与生活密切相关。下列说法错误的是( ) A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查 2.下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( ) A.用装置甲灼烧碎海带 B.用装置乙过滤海带灰的浸泡液 C.用装置丙制备用于氧化浸泡液中I−的Cl2 D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气 3.下列有关化学用语表示正确的是 A.质量数为31的磷原子: B.氟原子的结构示意图: C.CaCl2的电子式: D.明矾的化学式:Al2(SO4)3 4.根据下列实验操作和现象所得出的结论正确的是( ) 选项 实验操作和现象 结论 A 向苯酚浊液中滴加Na2CO3溶液,浊液变清 苯酚的酸性强于H2CO3的酸性 B 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 I2在CCl4中的溶解度大于在水中的溶解度 C 向CuSO4溶液中加入铁粉,有红色固体析出 Fe2+的氧化性强于Cu2+的氧化性 D 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 Ksp(AgCl) >Ksp(AgI) 5. 下列有关实验操作的叙述错误的是( ) A.过滤操作中,漏斗的尖端应接触烧杯内壁 B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 6.《本草衍义》中对精制砒霜过程有如下叙述:“ 取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( ) A.蒸馏 B.升华 C.干馏 D.萃取 7.下列变化中,气体被还原的是( ) A.二氧化碳使Na2O2固体变白 B.氯气使KBr溶液变黄 C.乙烯使Br2的四氯化碳溶液褪色 D.氨气使AlCl3溶液产生白色沉淀 8.下列化工生产过程中,未涉及氧化还原反应的是 A.海带提碘 B.氯碱工业 C.氨碱法制碱 D.海水提溴 9. 室温下,下列各组离子在指定溶液中能大量共存的是( ) A.0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH− B.0.1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42− C.0.1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3− D.0.1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3− 10. 下列指定反应的离子方程式正确的是 ( ) A.钠与水反应:Na +2H2ONa++2OH– + H2↑ B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2OH2↑+Cl2↑+2OH– C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + BaSO4↓+H2O D.向碳酸氢铵溶液中加入足量石灰水:Ca2+++OH–CaCO3↓ +H2O 11. 在给定条件下,下列选项所示的物质间转化均能实现的是 ( ) A.FeFeCl2Fe(OH)2 B.SSO3H2SO4 C.CaCO3CaOCaSiO3 D.NH3NOHNO3 12. 锂和钾两种元素相比较,下列说法正确的是( ) A.锂的还原性比钾的弱 B.锂原子的半径比钾的大 C.锂的金属性比钾的强 D.锂单质的熔点比钾的低 13. 下列说法正确的是( ) A.用坩埚钳夹住一小块经砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来 B.Al、盐酸、NaOH溶液三者之间两两均能发生反应 C.铝与Fe2O3发生铝热反应后固体物质增重 D.常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 14. 阿伏伽德罗常数的值为NA ,下列说法正确的是( ) A.1 L 0.1mol·L-1 NH4Cl 溶液中,NH4+ 的数量为 0.1NA B.2.4g Mg 与 H2SO4 完全反应,转移的电子数为 0.1NA C.标准状况下,2.24 L N2 和 O2 的混合气体中分子数为 0.2NA D.0.1 mol H2 和 0.1 mol I2 于密闭容器中充分反应后,其分子总数为 0.2NA 15.下列能量转化过程与氧化还原反应无关的是( ) A.硅太阳能电池工作时,光能转化成电能 B.锂离子电池放电时,化学能转化成电能 C.电解质溶液导电时,电能转化成化学能 D.葡萄糖为人类生命活动提供能量时,化学能转化成热能 第Ⅱ卷 (非选择题 共55分) 二、非选择题(请将答案填在答题卡上) 16.(1)配平下列方程式( 8分 ) ① Na+ H2O = NaOH + H2↑ ② Na2O2 + CO2= NaCO3 +O2↑ ③ KMnO4 +HCl( 浓 ) = KCl + MnCl2 + H2O + Cl2↑ ④ Al + H2O + NaOH = Na AlO2 + H2↑ (2)用双线桥法表示电子转移的数目和方向( 8分 ) ① 2Na2O2 + 2H2O = 4NaOH + O2↑ ② 2FeCl2 + Cl2 = 2FeCl3 16.(8分)用无水Na2CO3固体配制250 mL 0.100 0 mol·L-1的溶液。请回答: (1)在配制过程中用到的仪器是______(填序号)。 A.烧杯 B. 托盘天平 C.玻璃棒 D.胶头滴管 E.容量瓶 (2) 需要无水Na2CO3的质量 克。 (3)定容时的操作:当液面接近容量瓶刻度线 CM时改用__________(胶头滴管、烧杯、试管)再将容量瓶塞盖好,反复上下颠倒,摇匀。 17.(6分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: (1)装置C的作用是 。 (2)在上述装置中通入过量的SO2,请设计实验验证A中SO2与Fe3+发生了氧化还原反应: 。 (3)通入气体后B装置中观察到的现象是 。 18.(10分)某无色澄清溶液中Cl-浓度为0.5 mol·L-1,还可能含有下表中的若干种离子。 阳离子 K+、Al3+、Mg2+、Ba2+、Fe3+ 阴离子 NO、CO、SiO、SO、OH- 现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。 序号 实验内容 实验结果 Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出标准状况下1.12 L气体 Ⅱ 固体质量为4.8 g 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 Ⅲ 向Ⅱ的滤液中滴加BaCl2溶液 无明显现象 请回答下列问题: (1)通过以上实验不能确定是否存在的离子有 。能确定一定不存在的离子是_____________________________________________________。 (2)实验Ⅰ中生成沉淀的离子方程式为_____________________________。 (3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子 (不一定要填满)。 (4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________________________________________________________________ ___________________________________________________________________。 19.Al-Mg合金是建造航空母舰的主体材料,航母升降机可由铝合金制造。(15分) ①铝元素在周期表中的位置为 。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为 。 ②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为 。 (2)航母舰体材料为合金钢。 ①舰体在海水中发生的电化学腐蚀主要为 。②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为 。查看更多