高中化学第1章化学反应与能量转化第3节电能转化为化学能__电解2电解原理的应用课件鲁科版选择性必修1
第
2
课时 电解原理的应用
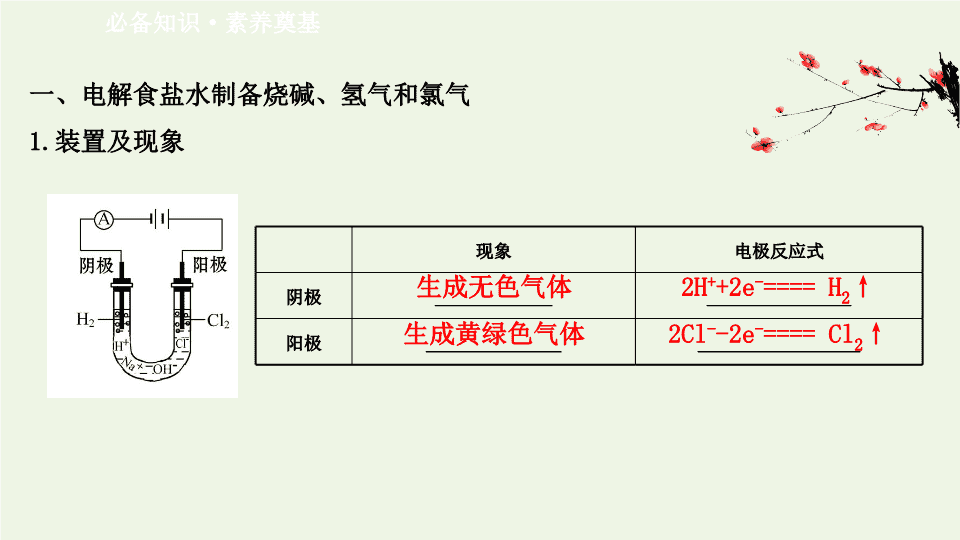
一、电解食盐水制备烧碱、氢气和氯气
1.
装置及现象
必备知识
·
素养奠基
现象
电极反应式
阴极
_____________
________________
阳极
_______________
__________________
生成无色气体
生成黄绿色气体
2H
+
+2e
-
==== H
2
↑
2Cl
-
-2e
-
==== Cl
2
↑
2.
电解总反应式
化学方程式
:________________________________;
离子方程式
:____________________________
。
3.
产物验证方法
(1)
用
__________________
检验阳极放出的氯气。
(2)
用
_________
检验产物
NaOH
。
通电
====
通电
====
2NaCl+2H
2
O 2NaOH+H
2
↑+Cl
2
↑
2Cl
-
+2H
2
O 2OH
-
+H
2
↑+Cl
2
↑
湿润的
KI-
淀粉试纸
酚酞试液
【
巧判断
】
(1)
向电解
NaCl
溶液的电解池中加入酚酞
,
阳极区变红。
(
)
提示
:
×
。
NaOH
为阴极区产物
,
因此变红的是阴极区。
(2)
氯碱工业可以得到金属钠、
Cl
2
和
H
2
。
(
)
提示
:
×
。氯碱工业电解的是饱和食盐水
,
在阴极区放电的是
H
+
,
而不是
Na
+
,
因而得不到金属钠。
(3)
电解饱和食盐水阴极产生的气体可使湿润的淀粉
KI
试纸变蓝。
(
)
提示
:
×
。阴极区产生的气体为
H
2
,
不能使湿润的淀粉
KI
试纸变蓝。
【
微思考
】
电解饱和食盐水时
,
如何判断阴、阳两极的产物
?
提示
:
由于阳极上阴离子的放电顺序为
Cl
-
>OH
-
,Cl
-
首先放电
,
故阳极产物为
Cl
2
。阴极上阳离子放电顺序为
H
+
>Na
+
,H
+
放电
,
故阴极产物为
H
2
。
二、铜的电解精炼
1.
装置
2.
电极反应
阳极
:______________(_____
反应
)(
主要
)
阴极
:______________(_____
反应
)
3.
阳极泥
铜的电解精炼过程中
,
粗铜中不如铜活泼的金属
(Ag
、
Au
、
Pt
等
)
与其他不溶性杂质混在一起沉积在电解池底部形成的物质。
Cu-2e
-
====Cu
2+
氧化
Cu
2+
+2e
-
====Cu
还原
【
微思考
】
粗铜电解精炼时
,
电解液的浓度是否不变
?
提示
:
由于在阳极上
,Fe
、
Zn
、
Ni
比
Cu
活泼
,
都能失电子而进入溶液
,
而在阴极上
,
溶液中氧化性较强的
Cu
2+
会优先于
H
+
、
Fe
2+
、
Zn
2+
、
Ni
2+
得电子
,
所以
CuSO
4
溶液浓度会略有降低。
【
巧判断
】
(1)
粗金属精炼时
,
粗金属作阳极
,
阳极泥是比被精炼金属不活泼的金属。
(
)
提示
:
√
。粗金属精炼时
,
比该金属活泼的金属变成金属阳离子进入溶液
,
不如该金属活泼的金属不发生反应
,
最终形成阳极泥。
(2)
电解法精炼粗铜时
,
电解质溶液中各离子浓度一定不变。
(
)
提示
:
×
。被提纯的金属阳离子在溶液中的浓度是减小的。
(3)
精炼铜后
,
电解质溶液中含
Zn
2+
、
Cu
2+
、
Ag
+
、
Fe
2+
等阳离子。
(
)
提示
:
×
。金属
Ag
的活泼性不如铜
,
因此不参加电极反应
,
而是进入阳极泥中。
(4)
精炼铜装置中
,
阴极得到
32 g
铜
,
阳极电子转移
1 mol
。
(
)
提示
:
√
。阴极得到
32 g Cu,
转移的电子为
1 mol,
则整个电路通过的电子物质的量均为
1 mol,
因此阳极转移
1 mol
电子。
三、电镀
1.
概念
应用
_____
原理
,
在金属表面镀上一薄层
_____
或
_____
的方法。
2.
目的
提高金属的
_______
能力、耐磨性或改善金属制品的外观。
3.
电镀池
电镀时
,
镀层金属作阳极
,
待镀金属制品作阴极
,
含镀层金属阳离子的溶液作电镀液。
电解
金属
合金
抗腐蚀
【
做一做
】
铁钉上镀铜如下所示
:
阴极
待镀的金属制品
:_____
阳极
镀层金属
:___
电镀液
含有镀层金属离子的盐溶液
:_________
装置图
电极
反应
阳极
:______________
阴极
:______________
铁钉
铜
CuSO
4
溶液
Cu-2e
-
====Cu
2+
Cu
2+
+2e
-
====Cu
【
情境
·
思考
】
白铁
,
我们日常生活中常用的一种金属材料
,
是一种镀锌铁。
在铁制品上镀一层一定厚度的锌层
,
应怎样设计电镀池
?
提示
:
根据电镀的要求
,
应将锌作阳极
,
镀件作阴极
,
溶液中含有锌离子。
关键能力
·
素养形成
知识点一 电解原理的应用
【
重点释疑
】
1.
电解饱和食盐水
氯碱工业
:
电解饱和食盐水的工业叫氯碱工业。
2.
铜的电解精炼与电镀铜对比
铜的电解精炼
电镀铜
电极
材料
阴极
精铜
镀件
阳极
粗铜
铜片
电极
反应式
阳极
Cu-2e
-
====Cu
2+
等
Cu-2e
-
====Cu
2+
阴极
Cu
2+
+2e
-
====Cu
Cu
2+
+2e
-
====Cu
离子导体
浓度的变化
c(Cu
2+
)
减少
,
比铜活泼的金属阳离子进入溶液
离子导体成分及浓度均不变
【
思考
·
讨论
】
(1)
在电镀铜时
,
电镀液中
CuSO
4
溶液的浓度为什么不变
?
提示
:
电镀铜时
,
阳极
:Cu-2e
-
====Cu
2+
,
阴极
:Cu
2+
+2e
-
====Cu,
所以理论上电镀液中
c(CuSO
4
)
保持不变。
(2)
怎样判断一个装置是原电池还是电解池
?
提示
:
有外加电源的一定为电解池
,
无外加电源的一般为原电池
;
多池组合时
,
一般含活泼金属的为原电池
,
其余都是原电池连接着的电解池。
(3)
粗铜中含有少量
Fe
、
Zn
、
Au
、
Ag
等杂质
,
通过粗铜精炼怎样除去这些杂质的呢
?
提示
:
粗铜精炼是将粗铜作阳极
,
粗铜中的
Fe
、
Zn
等比
Cu
活泼能失去电子生成
Fe
2+
、
Zn
2+
进入溶液中
,
因
Fe
2+
、
Zn
2+
的氧化性弱于
Cu
2+
不能在阴极析出
,
留在溶液中
;Au
、
Ag
等是不如
Cu
活泼的金属
,
在阳极不能失去电子
,
从而以固体的形式沉到阳极底部
,
形成阳极泥。
【
案例示范
】
【
典例
】
(2020·
莆田高二检测
)
金属镍有广泛的用途。粗镍中含有少量铁、锌、铜、铂等杂质
,
可用电解法制备高纯度的镍
,
下列叙述正确的是
(
已知
:
氧化性
Fe
2+
Na
+
,
阴极反应为
2H
+
+2e
-
====H
2
↑,Na
+
不放电
;
电解精炼铜时
,
粗铜作阳极
;
电镀时镀层金属作阳极
;
镁为活泼金属
,
工业上常用电解熔融
MgCl
2
的方法冶炼
Mg
。
2.(2020·
柳州高二检测
)
某同学设计如图所示装置
,
探究氯碱工业原理
,
下列说法正确的是
(
)
A.
石墨电极与直流电源负极相连
B.
用湿润淀粉
KI
试纸在铜电极附近检验气体
,
试纸变蓝色
C.
氢氧化钠在石墨电极附近产生
,Na
+
向石墨电极迁移
D.
铜电极的反应式为
2H
+
+2e
-
====H
2
↑
【
解析
】
选
D
。若
Cu
电极所连的是直流电源的正极
,
则
Cu
是阳极
,
电极反应式为
Cu-2e
-
====Cu
2+
,
不符合氯碱工业原理
,
故石墨电极与直流电源正极相连
,A
项错误
;
阴极
(Cu
极
)
反应为
2H
+
+2e
-
====H
2
↑,
阳极
(C
极
)
反应为
2Cl
-
-2e
-
====Cl
2
↑,
故用湿润淀粉
KI
试纸在石墨电极附近检验气体
,
试纸变蓝
,
发生反应
Cl
2
+2KI ====2KCl+I
2
,
故
B
项错误、
D
项正确
;Cu
电极附近
H
+
减少
,
生成
OH
-
,Na
+
向
Cu
电极迁移
,
故
C
项错误。
【
补偿训练
】
1.(2020·
衡水高二检测
)
下列描述中
,
不符合生产实际的是
(
)
A.
电解熔融的氧化铝制取金属铝
,
用铁作阳极
B.
电解法精炼粗铜
,
用纯铜作阴极
C.
电解饱和食盐水制烧碱
,
用涂镍碳钢网作阴极
D.
在镀件上电镀锌
,
用锌作阳极
【
解析
】
选
A
。电解熔融的氧化铝制取金属铝
,
用石墨作阳极
,
如果用铁作阳极
,
则铁失电子而被消耗
,
故
A
不对。
B
、
C
、
D
符合生产实际
,
正确。
2.(2020·
洛阳高二检测
)
关于电镀铜和电解精炼铜
,
下列说法中正确的是
(
)
A.
都用粗铜作阳极、纯铜作阴极
B.
电解液的成分都保持不变
C.
阳极反应都只有
Cu-2e
-
====Cu
2+
D.
阴极反应都只有
Cu
2+
+2e
-
====Cu
【
解析
】
选
D
。
A
项
,
电镀时镀件作阴极
;B
项
,
电解精炼铜时
,
电解液成分改变
;C
项
,
电解精炼铜时
,
杂质若有比铜活泼的金属
(
如锌
),
则还会发生
Zn-2e
-
====
Zn
2+
的反应。
知识点二 有关电解的计算
【
重点释疑
】
1.
计算的原则
(1)
阳极失去的电子数
=
阴极得到的电子数。
(2)
串联电路中通过各电解池的电子总数相等。
(3)
电源输出的电子总数和电解池中转移的电子总数相等。
2.
计算的方法
(1)
根据守恒法计算
:
用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算
,
其依据是电路中转移的电子数相等。
(2)
根据总反应式计算
:
先写出电极反应式
,
再写出总反应式
,
最后根据总反应式计算。
(3)
根据关系式计算
:
根据得失电子守恒关系
,
在已知量与未知量之间
,
建立计算所需的关系式。
3.
计算的步骤
(1)
正确书写电极反应式
(
要注意阳极材料
)
。
(2)
当溶液中有多种离子共存时
,
要确定放电离子的先后顺序。
(3)
最后根据得失电子守恒进行相关的计算。
【
思考
·
讨论
】
(1)
将两个分别装有
Na
2
SO
4
、
CuCl
2
溶液的电解池串联在一起
,
均用惰性电极进行电解
,
电解一段时间后
,
试分析电极产物
H
2
、
O
2
、
Cl
2
、
Cu
之间物质的量的关系。
提示
:
根据得失电子守恒及元素的化合价可得出
,
电极产物物质的量的关系式
:2H
2
~
O
2
~
2Cl
2
~
2Cu
~
4e
-
,
即
H
2
、
O
2
、
Cl
2
、
Cu
的物质的量之比为
2∶1∶2∶2
。
(2)
已知一个电子的电量是
1.602×10
-19
C,
用该电池电解饱和食盐水
,
当电路
中通过
1.929×10
5
C
的电量时
,
生成
NaOH
的质量是多少
?
提示
:
80 g
。一个电子的电量是
1.602×10
-19
C,
当电路中通过
1.929×10
5
C
的
电量时
,
电子的个数为
=1.204×10
24
,
电子的物质的量为
=2 mol,
根据转移电子和氢氧化钠的关系式
2NaOH
~
2e
-
得
,NaOH
的质量为
×2×40 g·mol
-1
=80 g
。
【
案例示范
】
【
典例
】
(2020·
日照高二检测
)
将含有
0.4 mol Cu(NO
3
)
2
和
0.4 mol KCl
的水
溶液
1 L,
用惰性电极电解一段时间后
,
在一电极上析出
19.2 g Cu;
此时
,
在另
一电极上放出气体的体积在标准状况下为
(
不考虑产生的气体在水中的溶解
)
(
)
A.3.36 L B.5.6 L C.6.72 L D.13.44 L
【
思维建模
】
解答有关电解计算思路如下
:
【
解析
】
选
B
。根据电解原理
,
阴、阳两极发生的电极反应为阴极
:Cu
2+
+2e
-
====Cu,
阳极
:2Cl
-
-2e
-
====Cl
2
↑
。由题意知
,
在阴极上析出
Cu:
=0.3 mol,
则转移电子
0.6 mol,
根据电子得失守恒分析
,
阳极上除
Cl
-
放电外
,
OH
-
也会放电产生
O
2
,
即
4OH
-
-4e
-
====2H
2
O+O
2
↑,
经计算可知得到
Cl
2
0.2 mol,
得到
O
2
0.05 mol,
故阳极放出气体的总体积为
(0.2 mol+0.05 mol)×
22.4 L·mol
-1
=5.6 L
。
【
迁移
·
应用
】
1.(2020·
贵阳高二检测
)
用惰性电极电解硫酸铜溶液。若阳极上产生气体的物质的量为
0.01 mol,
阴极无气体逸出
,
则阴极上析出铜的质量为
(
)
A.0.64 g B.1.28 g C.2.56 g D.5.12 g
【
解析
】
选
B
。用惰性电极电解硫酸铜溶液
,
在阳极产生的气体为氧气
,
由
4OH
-
-4e
-
====2H
2
O+O
2
↑
知
,
产生
0.01 mol
的氧气转移
0.04 mol
电子
,
则根据得失电子守恒可知
Cu
2+
+2e
-
====Cu,
可推出
,
应析出
0.02 mol
的铜
,
其质量为
1.28 g
。
2.(2020·
邢台高二检测
)
如图所示的
A
、
B
两个电解池中的电极均为铂
,
在
A
池中加入
0.05 mol·L
-1
的氯化铜溶液
,B
池中加入
0.1 mol·L
-1
的硝酸银溶液
,
进行电解。
a
、
b
、
c
、
d
四个电极上所析出物质的物质的量之比是
(
)
A.2∶2∶4∶1 B.1∶1∶2∶1
C.2∶1∶1∶1 D.2∶1∶2∶1
【
解析
】
选
A
。由电解规律可知
:a
、
c
为阴极
,b
、
d
为阳极。
a
极上析出铜
,b
极
上析出氯气
,c
极上析出银
,d
极上析出氧气。由电子守恒可得出
:2e
-
~
Cu
~
Cl
2
~
2Ag
~
O
2
,
所以
a
、
b
、
c
、
d
四个电极上所析出物质的物质的量之比为
2∶2∶4∶1
。
【
补偿训练
】
(2020·
雅安高二检测
)
用石墨作电极电解
+n
价
M
金属的硝酸盐溶液
,
当阴极上析出
m g
金属时
,
阳极上产生
560 mL(
标准状况
)
气体
,
此金属的相对原子质量为
(
)
A.10 mn
B.10 m
C.10 n
D.40 mn
【
解析
】
选
A
。阳极反应
:4OH
-
-4e
-
====O
2
↑+2H
2
O,
当生成
560 mL O
2
时转移
0.1 mol
电子
,
阴极为
M
n+
得电子
,
即
M
n+
+ne
-
====M,
根据反应中转移
0.1 mol
电子
和生成
m g
金属
,
则 解得
M
r
(M)=10 mn
。
【
课堂回眸
】
课堂检测
·
素养达标
1.(2020·
北京西城区高二检测
)
如图所示
,
用石墨电极电解饱和食盐水。下列说法不正确的是
(
)
A.
电极
a
是阳极
B.
通电使
NaCl
发生电离
C.Na
+
、
H
+
向
b
极移动
D.a
极产生黄绿色气体
【
解析
】
选
B
。与电源的正极相连的是阳极
,
和电源的负极相连的是阴极
,
所以
a
极是阳极
,b
极是阴极。阳离子向阴极移动
,
阴离子向阳极移动。
A.
由分析可知
,
电极
a
是阳极
,A
项正确
;B.NaCl
在水中就能发生电离
,
通电不是必要条件
,B
项错误
;C.
由分析可知
,Na
+
、
H
+
向
b
极移动
,C
项正确
;D.a
极反应式为
2Cl
-
-2e
-
====Cl
2
↑,
产生黄绿色气体
,D
项正确。
2.(
教材改编题
)
电镀在工业上有着广泛的应用
,
可以镀锌、镀铜、镀金等。利用如图所示装置可以将铜牌变为银牌
,
即在铜牌表面电镀一层银。下列有关说法正确的是
(
)
A.
通电后
,Ag
+
向阳极移动
B.
银片与电源负极相连
C.
该电解池的阴极反应可表示为
Ag
+
+e
-
====Ag
D.
当电镀一段时间后
,
将电源反接
,
铜牌可恢复如初
【
解析
】
选
C
。铜牌上镀银
,
银为阳极
,Ag
+
向阴极移动
,
阴极反应为
Ag
+
+e
-
==== Ag
。由于实验中镀层不可能非常均匀致密
,
所以将电源反接
,
阳极上
Cu
、
Ag
均能溶解
,
铜牌不可能恢复如初。
3.(2020·
延边高二检测
)
观察下列几个装置示意图
,
有关叙述正确的是
(
)
A.
装置①工业上可用于生产金属钠
,
电解过程中石墨电极产生金属
,
此法也可用于生产活泼金属镁、铝等
B.
装置②中随着电解的进行
,
左边电极会产生红色的铜
,
并且电流表示数不断变小
C.
装置③中的阳离子交换膜只允许阳离子、阴离子和小分子水通过
D.
装置④的待镀铁件应与电源正极相连
【
解析
】
选
B
。①中石墨电极上产生
Cl
2
,
故
A
错误
;②
中左侧电极发生
Cu
2+
+2e
-
====Cu,
右侧电极发生
2Cl
-
-2e
-
====Cl
2
↑,
电解质
CuCl
2
溶液的浓度减小
,
导电能力减弱
,
故
B
正确
;③
中阴离子不能通过阳离子交换膜
,
故
C
错误
;④
中待镀铁件应与电源负极相连
,
故
D
错误。
4.(2020·
淄博高二检测
)1 L 0.1 mol·L
-1
AgNO
3
溶液在以
Ag
作阳极
,Fe
作阴极的电解槽中电解
,
当阴极增重
2.16 g
时
,
下列判断
(
设电解按理论进行
,
溶液不蒸发
)
正确的是
(
)
A.
溶液的浓度变为
0.08 mol·L
-1
B.
阳极上产生
112 mL O
2
(
标准状况
)
C.
转移的电子数是
1.204×10
22
个
D.
反应中有
0.01 mol
的
Ag
被氧化
【
解析
】
选
C
。由题意知
,
阴极反应为
Ag
+
+e
-
====Ag,
阳极反应
:Ag-e
-
====Ag
+
,
由
阴极增重
2.16 g
知
,n(Ag)=n(e
-
)=n(Ag
+
)= =0.02 mol
。
A
项
,
此装置是
在铁上镀银
,AgNO
3
溶液浓度不变
,
错误
;B
项
,
由阳极反应知
,
阳极上没有
O
2
生成
,
错误
;C
项
,n(e
-
)=0.02 mol,N(e
-
)=n(e
-
)×N
A
=1.204×10
22
,
正确
;D
项
,
反应中被
氧化的银为
0.02 mol,
错误。
5.(2020·
石家庄高二检测
)
利用电解原理制备物质是常用的方法
,
某同学设计了一种电解法制取
Fe(OH)
2
的实验装置
(
如图所示
)
。通电后溶液中产生白色沉淀
,
且较长时间不变色。下列说法中正确的是 世纪金榜导学号
(
)
A.
电源中
b
为正极
,a
为负极
B.
电解池中的电解液可以是
NaOH
溶液
,
但不能是
NaCl
溶液
C.A
、
B
两端都必须使用铁作电极
D.B
电极发生的反应
:2H
2
O+2e
-
====H
2
↑+2OH
-
【
解析
】
选
D
。阳极产生
Fe
2+
,
阴极产生
H
2
,
由于产生的
H
2
可以排出溶解在溶液中的少量
O
2
,
故应
B
极产生
H
2
,
所以
A
极为阳极
,
其电极材料为
Fe,B
极为阴极
,
其材料无条件限制
,
即
a
为正极
,b
为负极
,
故
A
、
C
项错误。电解质溶液若为
NaOH
溶液
,
电解开始阶段由于溶解在溶液中的
O
2
尚未除去
,
会将生成的
Fe(OH)
2
氧化而变色
;
电解质溶液若为
NaCl
溶液
,
电解初期阳极产生的
Fe
2+
进入溶液
,
此时不会生成
Fe(OH)
2
,
而阴极产生的
H
2
可以排出溶液中溶解的少量氧气
,
随电解的进行
,
溶液碱性增强
,
将生成
Fe(OH)
2
,
故
B
项错误。
6.(
新思维
·
新考向
)
工业上处理含 的酸性工业废水常用以下方法
:
①
往工业废水里加入适量的
NaCl,
搅拌均匀
;②
用
Fe
作电极进行电解
,
经过一段
时间后有
Cr(OH)
3
和
Fe(OH)
3
沉淀产生
;③
过滤回收沉淀
,
废水达到排放标准。原
理示意图如图所示
:
试回答
:
(1)
分析电极
A
、
B
的名称
,
并写出电极反应式。
提示
:
从图可知
B
区产生
H
2
:2H
+
+2e
-
==== H
2
↑,
为阴极反应
,
故
B
电极为阴极
;
则
A
电极为阳极
,
发生的电极反应为
Fe-2e
-
==== Fe
2+
。
(2)
电解过程中
Cr(OH)
3
、
Fe(OH)
3
沉淀是怎样产生的
?
提示
:
产生的
Fe
2+
在向阴极移动的过程中与向阳极移动的 相遇
,
发生氧化
还原反应
:6Fe
2+
+ +14H
+
==== 6Fe
3+
,+2Cr
3+
+7H
2
O,
使 转化为
Cr
3+
,
同
时
Fe
2+
也转化为
Fe
3+
,
在以上电解的阴极反应及
Fe
2+
与 的氧化还原反应中
消耗了大量的
H
+
,
溶液的
pH
不断变大
,
碱性逐渐增强
,
因此
Fe
3+
、
Cr
3+
生成相应的
Fe(OH)
3
、
Cr(OH)
3
沉淀。
(3)
往工业废水里加入适量的
NaCl
的作用是什么
?
能否用稀硫酸
?
提示
:
增强溶液的导电性。不能用稀硫酸代替
,
因为铬元素最终以沉淀
Cr(OH)
3
的形式除去
,
若用稀硫酸则不利于沉淀的生成。
(4)
能否用
Cu
电极来代替
Fe
电极
?
简述理由。
提示
:
不能
;
因为阴极产生的
Cu
2+
不能将 还原为
Cr
3+
。
(5)
若不考虑气体的溶解
,
当收集到
H
2
13.44 L(
标准状况
)
时
,
计算处理的废水
中 的物质的量。
提示
:
0.1 mol
。生成
13.44 L H
2
,
转移电子
1.2 mol,
根据电子守恒生成
0.6 mol
Fe
2+
,
则根据
+6Fe
2+
+14H
+
====2Cr
3+
+6Fe
3+
+7H
2
O
可知
,
还原 的物质
的量为
0.1 mol
。
【
核心整合
】
1.
电解原理及其应用
知识关联
·
素养应用
2.
对于装置
(1)
若
A
、
B
都是惰性电极
,
电解质溶液
C
是饱和
NaCl
溶液
,
实验开始时
,
同时在
U
形管两边各滴入几滴酚酞溶液
,
则
a
是正极
,B
是阴极
;A
电极上的电极反应式为
_________________,B
电极上的电极反应式为
_______________
。总反应的离子
方程式为
_____________________________
。
(2)
如用电解法精炼粗铜
,
电解液
C
选用
_____
溶液
,A
电极的材料是
_____,
主要电
极反应式为
______________
。
B
电极的材料是精铜
,
电极反应式为
____________
___
。
通电
====
2Cl
-
-2e
-
====Cl
2
↑
2H
+
+2e
-
====H
2
↑
2Cl
-
+2H
2
O 2OH
-
+H
2
↑+Cl
2
↑
CuSO
4
粗铜
Cu-2e
-
====Cu
2+
Cu
2+
+2e
-
====
Cu
【
素养迁移
】
1.
柯尔贝电解法是制备烃的重要方法
,
其原理为
2RCOOK+2H
2
O→R—R+H
2
↑+ 2CO
2
↑+2KOH(R
代表烃基
),
请写出阴极和阳极的电极反应式。
提示
:
由柯尔贝反应式可推出阳极反应式为
2RCOO
-
-2e
-
====R—R+2CO
2
↑,
阴极反应式为
2H
+
+2e
-
====H
2
↑
。
2.
高铁酸盐在能源环保领域有广泛用途
,
用镍
(Ni)
、铁作电极电解浓
NaOH
溶液制备高铁酸盐
Na
2
FeO
4
的装置如图所示。
(1)
分析电源
a
、
b
的名称。
提示
:
a
为负极
,b
为正极。因为此装置用铁制取
Na
2
FeO
4
,
其中铁元素的化合价由
0
升高为
+6,
发生氧化反应
,
因此
Fe
电极为阳极
,
故电源
b
为正极。
(2)
写出铁、镍电极上的电极反应式和电解总反应方程式。
提示
:
铁电极为阳极
,
发生氧化反应
,
电极反应式为
Fe+8OH
-
-6e
-
==== +4H
2
O,
镍为阴极
,
发生还原反应
,
电极反应式为
2H
+
+2e
-
====H
2
↑,
电解的总反应方程式
为
Fe+2H
2
O+2OH
-
==== +3H
2
↑
。
3.
火法炼铜得到的粗铜中含多种杂质
(
如锌、金和银等
),
工业上常使用电解精炼法将粗铜提纯。
(1)
分析电解精炼过程中杂质锌、金、银的去向。
提示
:
电解过程中比铜活泼的金属以离子的形式进入溶液中
,
并留在溶液中
,
比铜活泼性差的金属在反应过程中不参与电极反应
,
从而进入阳极泥中。
(2)
电解结束后发现阴极的质量增重
2.56 g,
是否阳极的质量减少
2.56 g?
提示
:
不是。因为阳极上发生的反应有
Zn-2e
-
====Zn
2+
,Cu-2e
-
====Cu
2+
,
阴极上的反应只有
Cu
2+
+2e
-
====Cu,
且阳极上的金和银不参与电极反应
,
因此阳极的质量减少大于
2.56 g
。
4.
电解是利用外电路电源提供电能的一种强有力的氧化还原手段
,
可以使不能发生的氧化还原反应强制发生。因此电解原理有着广泛的应用
,
可以应用电解手段制备、净化、提纯某些物质。
(1)SO
2
是一种常见的大气污染物
,
能够引起酸雨等环境问题
,
工业上利用电化学方法将
SO
2
废气二次利用
,
制备保险粉
(Na
2
S
2
O
4
)
的装置如图所示。
①
分析电极
a
、
b
、
Ⅰ
、
Ⅱ
的名称
,
并写出电极
Ⅰ
、
Ⅱ
的电极反应式。
提示
:
根据图示可以得出电极
Ⅰ
上发生的是
SO
2
制备
Na
2
S
2
O
4
的过程
,
发生的是得
电子的还原反应
,
因此电极
Ⅰ
为阴极
,
电极反应式为
2SO
2
+2e
-
==== ;
电极
Ⅱ
上发生的是
SO
2
生成硫酸的反应
,
为失电子的氧化反应
,
故电极
Ⅱ
为阳极
,
电极反
应式为
2H
2
O+SO
2
-2e
-
====4H
+
+
。所以外接电源的
a
为负极
,b
为正极。
②
通电一段时间后溶液中
H
+
转移
0.1 mol,
计算此装置处理的废气
SO
2
的体积
(
标
准状况下
)
。
提示
:
溶液中
H
+
转移
0.1 mol,
根据电子守恒可知电路中通过的电子的物质的量
为
0.1 mol
。由阴极电极反应式为
2SO
2
+2e
-
==== ,
阳极电极反应式为
2H
2
O+SO
2
-2e
-
====4H
+
+ ,
则阴阳两极共处理标准状况下
SO
2
废气
(0.1+
0.05) mol×22.4 L·mol
-1
=3.36 L
。
(2)CO
2
气体是引起温室效应和气候变暖的主要物质。
①
Journal of Energy Chemistry
报道我国科学家设计
CO
2
熔盐捕获与转化装置如图。
判断
a
、
d
电极的名称
,
并写出电极反应式。
提示
:
根据图示可以得出
d
电极上发生 转化为
C
的反应
,
根据化合价可以判
断发生的是得电子的还原反应
,
因此电极
d
为阴极
,
电极反应式为
+4e
-
====
C+3O
2-
;
则电极
a
为阳极
,
根据图示可以判断电极反应式为
2 -4e
-
====
4CO
2
+O
2
。
②
溶于海水的
CO
2
主要以
4
种无机碳形式存在
,
其中 占
95%,
利用图示装置从
海水中提取
CO
2
,
有利于减少环境温室气体含量。
分析
b
室中的海水
pH
变化的原因。
提示
:
a
室为电解池的阳极室
,
发生的电极反应为
2H
2
O-4e
-
====O
2
↑+4H
+
,
产生的
H
+
通过阳离子交换膜进入
b
室
,
与主要含碳粒子
( )
发生反应
+H
+
====H
2
O +CO
2
↑,
的浓度减小
,
从而导致
pH
减小。
(3)
重铬酸钾
(K
2
Cr
2
O
7
)
是一种强氧化剂
,
可用于检测酒驾中酒精的含量
,
电化学制备
K
2
Cr
2
O
7
的装置如图所示
,
其中
a
、
b
均为石墨电极。
①
结合化学用语分析制备重铬酸钾
(K
2
Cr
2
O
7
)
的化学原理。
提示
:
根据图示和电解原理可知
b
极上发生的电极反应为
2H
2
O-4e
-
====4H
+
+O
2
↑,
产生的
H
+
在
b
极区附近与 发生反应
2 +2H
+
==== +H
2
O
。
②
若将
K
+
交换膜换为阴离子交换膜
,
会造成什么影响
?
提示
:
将
K
+
交换膜换为阴离子交换膜
,
将会使阴极室的
OH
-
进入阳极室
,
从而降低阳极室的酸性
,
导致重铬酸钾
(K
2
Cr
2
O
7
)
的产率降低
,
同时会引入杂质
KOH
。
(4)
三氧化二镍
(Ni
2
O
3
)
可用于制造高能电池元件。电解法制备过程如下
:
用
NaOH
溶液将
NiCl
2
溶液的
pH
调至
7.5,
加入适量硫酸钠固体后进行电解。电解过程中产生的
Cl
2
在弱碱性条件下生成
ClO
-
,
把二价镍
(
可简单写成
Ni
2+
)
氧化为
Ni
3+
,
再将
Ni
3+
经一系列反应后转化为
Ni
2
O
3
。电解装置如图所示。
分析加入适量硫酸钠固体的作用。
提示
:
硫酸钠是一种强电解质
,
向其中加入硫酸钠
,
能使溶液中的离子浓度增大
,
从而增强溶液的导电能力。
(5)
三室式电渗析法处理含
NH
4
NO
3
废水的原理如图所示
,
在直流电场的作用下
,
两膜中间的 和 可通过离子交换膜
,
而两端隔室中离子被阻挡不能进
入中间隔室。工作一段时间后
,
在两极区均得到副产品
NH
4
NO
3
。
①
判断
c
膜和
d
膜分别是阴离子交换膜还是阳离子交换膜
?
提示
:
结合题图装置可知
,
工作一段时间后
,
在两极区均得到副产品
NH
4
NO
3
,
则
Ⅱ
室中的阳离子 、
H
+
向
Ⅰ
室移动与
Ⅰ
室中的稀硝酸反应生成了硝酸铵
,
则
c
膜
为阳离子交换膜
,Ⅰ
室中石墨为电解池阴极
,a
为电源负极
,
阴极电极反应式为
2H
2
O+2e
-
====H
2
↑+2OH
-
;Ⅱ
室中的阴离子 、
OH
-
向
Ⅲ
室移动与
Ⅲ
室中的稀
氨水反应生成硝酸铵
,
则
d
膜为阴离子交换膜。
②
在相同条件下
Ⅰ
室和
Ⅲ
室产生的气体体积比是多少
?
提示
:
Ⅰ
室为电解池的阴极室
,
电极反应为
2H
2
O+2e
-
====H
2
↑+2OH
-
;Ⅲ
室为阳极室
,
电极反应为
2H
2
O-4e
-
====O
2
↑+4H
+
,
根据电子守恒可判断
,
相同条件下两室气体的体积比为
2∶1
。
(6)
氢能源是最具应用前景的能源之一
,
高纯氢的制备是目前的研究热点。
某科研小组利用太阳能光伏电池电解水制高纯氢
,
工作示意图如下。通过控制开关
K
连接
K
1
或
K
2
,
可交替得到
H
2
和
O
2
。
①
分析制取
H
2
和
O
2
时开关
K
的连接方式
,
并写出电极反应式。
提示
:
电解水生成氢气和氧气
,
氧气在阳极生成
,
氢气在阴极生成
,
因此根据图示
,
制取
H
2
开关
K
应连接
K
1
,
电极反应式为
2H
2
O+2e
-
====H
2
↑+2OH
-
;
制取
O
2
开关
K
应连接
K
2
,
电极反应式为
2H
2
O-4e
-
====O
2
↑+4H
+
。
②
简要说明此装置中电极
3
的作用。
提示
:
电极
3
可分别连接
K
1
或
K
2
,
制氢气时电极
3
为阳极发生
Ni(OH)
2
-e
-
+OH
-
==== NiOOH+H
2
O,
消耗电极
1
产生的
OH
-
;
制氧气时电极
3
为阴极发生
NiOOH+H
2
O+e
-
====
Ni(OH)
2
+OH
-
,
补充电极
2
消耗的
OH
-
,
实现
NiOOH Ni(OH)
2
的转化
,
且可循环使
用。