- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习苏教版常见晶体模型与晶胞计算学案
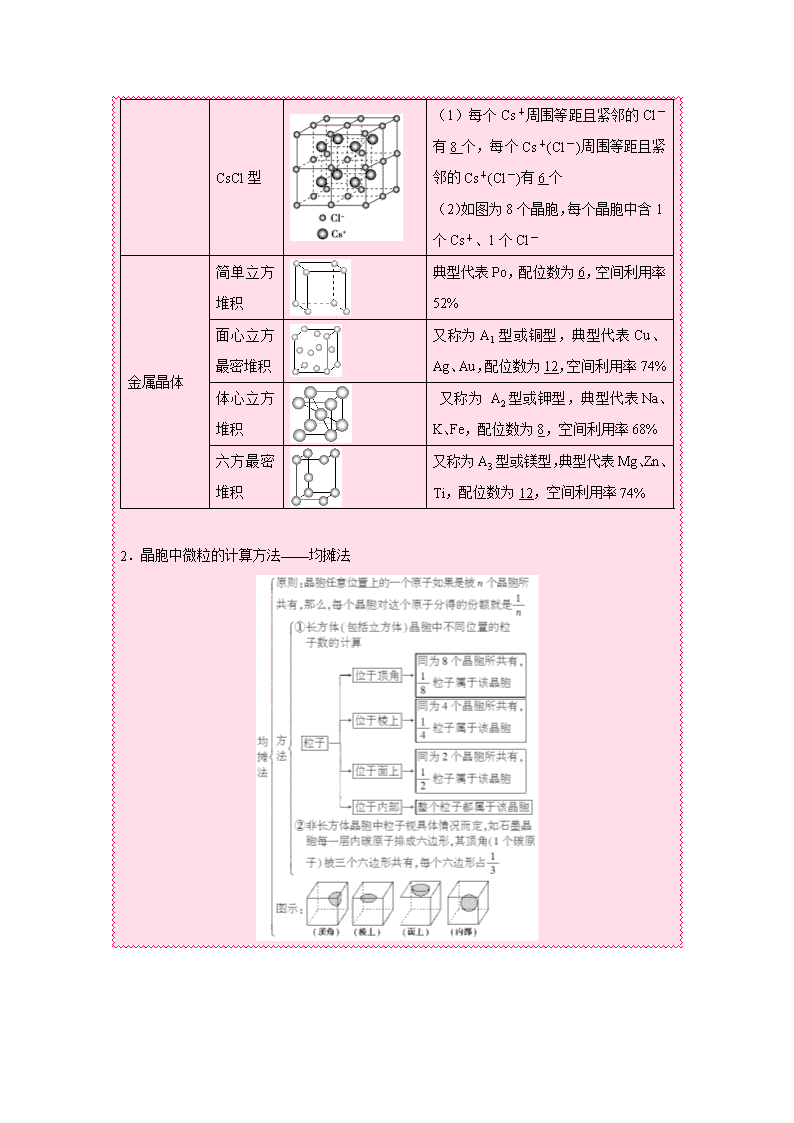
1.典型晶体模型 晶体 晶体结构 晶体详解 原子晶体 金刚石 (1)每个碳与相邻 4个碳以共价键结合,形成正四面体结构 (2)键角均为109°28′ (3)最小碳环由6个C组成且六原子不在同一平面内 (4)每个C参与4条C—C键的形成,C原子数与C—C键数之比为1∶2 SiO2 (1)每个Si与4个O以共价键结合,形成正四面体结构 (2)每个正四面体占有1个Si,4个“O”,n(Si)∶n(O)=1∶2 (3)最小环上有12个原子,即6个O,6个Si 分子晶体 干冰 (1)8个CO2分子构成立方体且在6个面心又各占据1个CO2分子 (2)每个CO2分子周围等距且紧邻的CO2分子有12个 离子晶体 NaCl型 (1)每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)有6个,每个Na+周围等距且紧邻的Na+有12个 (2)每个晶胞中含4个Na+和4个Cl- CsCl型 (1)每个Cs+周围等距且紧邻的Cl-有8个,每个Cs+(Cl-)周围等距且紧邻的Cs+(Cl-)有6个 (2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl- 金属晶体 简单立方堆积 典型代表Po,配位数为6,空间利用率52% 面心立方最密堆积 又称为A1型或铜型,典型代表Cu、Ag、Au,配位数为12,空间利用率74% 体心立方堆积 又称为 A2型或钾型,典型代表Na、K、Fe,配位数为8,空间利用率68% 六方最密堆积 又称为A3型或镁型,典型代表Mg、Zn、Ti,配位数为12,空间利用率74% 2.晶胞中微粒的计算方法——均摊法 【重难点指数】★★★ 【重难点考向一】常见晶胞类型和结构特点 【典型例题1】 (1)【2015·高考全国卷Ⅰ,37(5)】碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示: 石墨烯晶体 金刚石晶体 ①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。 ②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。 (2)【2014·高考全国卷Ⅰ节选】Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。 【答案】(1)①3 2 ②12 4 (2)16 【重难点考向二】有关晶胞的计算 【典型例题1】【2015·高考全国卷Ⅱ,37(5)】O和Na能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________;晶胞中O原子的配位数为________;列式计算晶体F的密度(g·cm-3)__________________________________。 【答案】Na2O 8 =2.27 g·cm-3 【解析】O2-半径大于Na+半径,由F的晶胞结构可知,大球代表O2-,小球代表Na+,每个晶胞中含有O2-个数为8×1/8+6×1/2=4,含有Na+个数为8,故O2-、Na+离子个数之比为4∶8=1∶2,从而推知F的化学式为Na2O。由晶胞结构可知,每个O原子周围有8个Na原子,故O原子的配位数为8。晶胞参数a=0.566 nm=0.566×10-7 cm,则晶胞的体积为(0.566×10-7 cm)3,从而可知晶体F的密度为=2.27 g·cm-3。 【名师点睛】 (2)晶体微粒与M、ρ之间的关系 若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g (M为微粒的相对“分子”质量);又1个晶胞的质量为ρ a3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρ a3NA g,因此有xM=ρ a3NA。 1.下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:○-X,●-Y,⊕-Z) ( ) 【答案】C 【解析】A、B图中X、Y原(离)子的数目比均为1:1,A、B错误;C图中X的数目:8×=1,Y的数目:6×=3,Z位于体心,数目为1,化学式XY3Z正确;D图中X的数目:8×=1,Y的数目:12×=3,Z位于体心,数目为1,化学式为XY3Z ,错误,答案选C。 2.某物质的晶体中含Ti、O、Ca三种元素,其晶胞排列方式如图所示,晶体中Ti、O、Ca的中原子个数之比为 ( ) A.1:3:1 B.2:3:1 C.2:2:1 D.1:3:3 【答案】A 3.已知CsCl晶体的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为 ( ) A. B. C. D. 【答案】A 【解析】该立方体中含1个氯离子,Cs+个数=8×=1,根据ρV=知,M=,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量是ρa3NA,故选A. 4.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是 ( ) A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 C.晶胞中原子的配位数分别为:①6,②8,③8,④12 D.空间利用率的大小关系为:①<②<③<④ 【答案】B 5.氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。 (1)Zn2+基态核外电子排布式为 (2)与CNO-互为等电子体的分子、离子化学式分别为 、 (各写一种) (3)ZnO是两性氧化物,能跟强碱溶液反应生成Zn(OH)4]2-。不考虑空间构型,Zn(OH)4]2-的结构可用示意图表示为 ,某种ZnO晶体的晶胞如图1所示,O2-的配位数为 图1 ZnO晶胞 图2 GaN晶胞 (4)图2是氮化镓的晶胞模型。其中镓原子的杂化方式为 杂化,N、Ga原子之间存在配位键,该配位键中提供电子对的原子是 。氮化镓为立方晶胞,晶胞边长为a pm,若氮化镓的密度为ρg·cm-3,则氮化镓晶胞边长的表达式a= pm(设NA表示阿伏加德罗常数的值)。 【答案】(1)1s22s22p63s23p63d10(或Ar]3d10); (2)CO2(或N2O、CS2、BeCl2等,合理均可),N; (3)或,8; (4)sp3杂化,N,×1010。 【解析】(1)锌属于第四周期第IIB族元素,核外电子排布式为:1s22s22p63s23p63d104s2,因此Zn2+的基态核外电子排布式为:1s22s22p63s23p63d10(或Ar]3d10);(2)等电子体:原子总数相等,价电子总数相等的微粒互称为等电子体,CNO-中含有3个原子,价电子总数为16,CO2(或N2O、CS2、BeCl2等,合理均可), N;(3)锌提供空轨道,OH-中的O提供孤电子对,形成配位键,结构示意图是: 或 ,离子晶体配位数,是周围最近的异性离子的个数,即O2-最近的AN2+有8个,(4)根据晶胞,镓有4个共价键,因此镓的杂化类型为sp3,形成配位键,金属提供空轨道,非金属提供孤电子对,因此提供电子对的原子是N;根据晶胞的结构,Ga的个数为8×1/8+1=2,晶胞的质量为2×84/NAg,设晶胞的边长为apm,晶胞的体积为(a×10-10)3,根据密度的定义,即a=×1010。 查看更多