- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版铝及其化合物教案
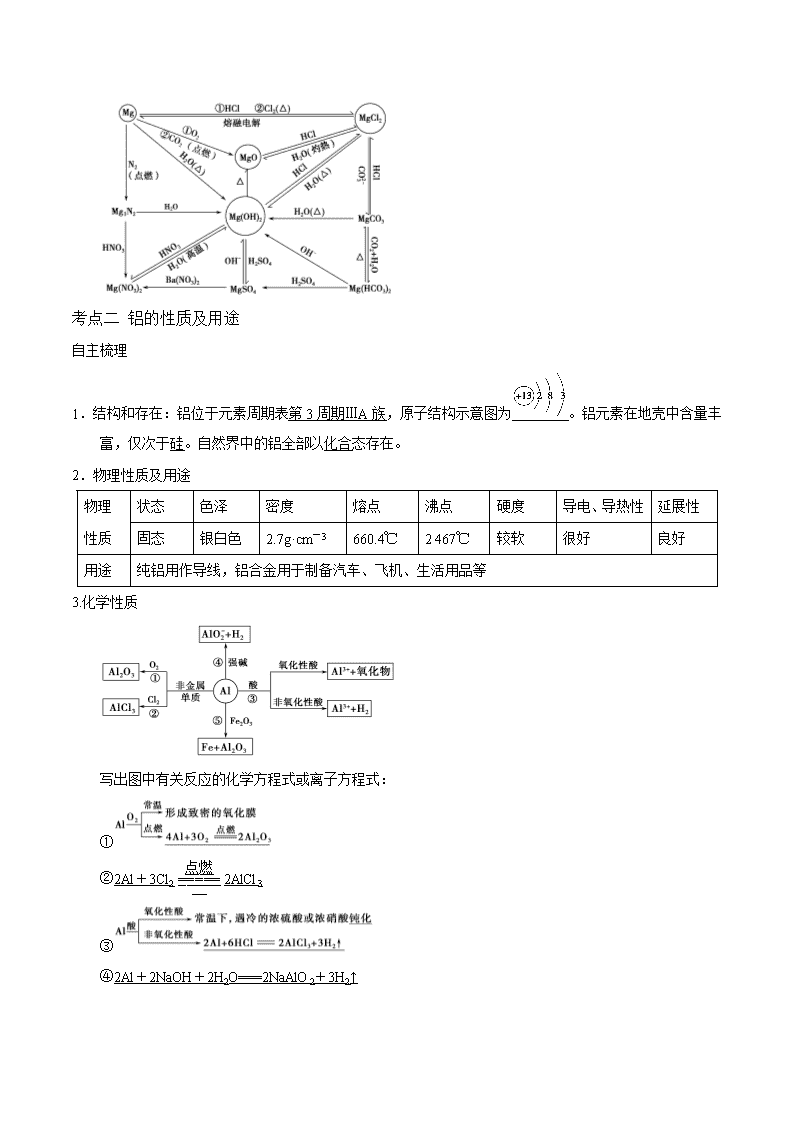
第三单元 金属及其化合物 第二课时 铝及其化合物 复习目标: 1.掌握铝、镁的主要性质及其应用。 2.掌握铝的重要化合物[Al2O3、Al(OH)3、Al3+、AlO、KAl(SO4)2·12H2O]的主要性质及其应用。 3.了解镁、铝及其主要化合物的制备方法。 考点一 镁及其重要化合物的主要性质及应用 自主梳理 1.镁的性质 (1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、导热和延展性。 (2)化学性质: ①与非金属反应 ②与CO2反应:2Mg+CO22MgO+C ③与H2O反应:Mg+2H2OMg(OH)2+H2↑ ④与H+反应:Mg+2H+===Mg2++H2↑。 2.海水提镁 →Mg2++2OH-===Mg(OH)2↓ ↓ →Mg(OH)2+2HCl===MgCl2+2H2O ↓ →MgCl2(熔融)Mg+Cl2↑ 3.用途:生产合金,冶金工业上用作还原剂和脱氧剂。 4.镁的重要化合物 物质 主要性质 氧化镁 碱性氧化物 MgO+2H+===Mg2++H2O 氢氧化镁 中强碱 Mg(OH)2+2H+===Mg2++2H2O 难溶于水 Mg2++2OH-===Mg(OH)2↓ 溶解度小 于碳酸镁 MgCO3+H2OMg(OH)2+CO2↑ 【深度思考】 工业电解熔融MgCl2得到的镁如何冷却?并说明原因。 【答案】因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。 例1、某同学通过系列实验探讨Mg及其化合物的性质,操作正确且能达到目的的是( ) A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg的活泼性 B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 【答案】B 【解析】本题考查镁及其化合物的性质、常见的基本实验操作。稀释浓硫酸时,应将浓硫酸沿着器壁或玻璃棒慢慢加入水中,并及时搅拌,A是错误的;过滤时需要用玻璃棒引流,因此C不正确;蒸发溶液时应该用蒸发皿而不是表面皿,由于MgCl2水解,所以加热时必需在HCl的气氛中加热才能得到MgCl2固体,所以D不正确。 【发散类比1】下列关于镁铝的说法正确的是( ) A.镁铝制品在空气中能稳定存在是因为铝不活泼 B.浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应 C.镁铝均与NaOH溶液反应 D.铝与Fe2O3发生铝热反应是利用了Al的还原性比Fe强 【答案】D 【思维建模】 镁及其化合物的转化关系图 考点二 铝的性质及用途 自主梳理 1.结构和存在:铝位于元素周期表第3周期ⅢA族,原子结构示意图为。铝元素在地壳中含量丰富,仅次于硅。自然界中的铝全部以化合态存在。 2.物理性质及用途 物理 性质 状态 色泽 密度 熔点 沸点 硬度 导电、导热性 延展性 固态 银白色 2.7g·cm-3 660.4℃ 2 467℃ 较软 很好 良好 用途 纯铝用作导线,铝合金用于制备汽车、飞机、生活用品等 3.化学性质 写出图中有关反应的化学方程式或离子方程式: ① ②2Al+3Cl22AlCl3 ③ ④2Al+2NaOH+2H2O===2NaAlO2+3H2↑ ⑤2Al+Fe2O3Al2O3+2Fe(铝热反应) 4.制备:2Al2O3(熔融)4Al+3O2↑ 【深度思考】 判断正误,正确的划“√”,错误的划“×” (1)铝粉与氧化镁共热可制取金属镁( ) (2)足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气( ) (3)工业上用电解熔融Al2O3的方法冶炼铝( ) (4)在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化( ) (5)铝在自然界中有游离态和化合态两种形式( ) 答案 (1)× (2)× (3)√ (4)× (5)× 例2、铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题: (1)等质量的两份铝分别与足量的HCl、NaOH溶液反应,所得H2的体积之比是________。 (2)足量的两份铝分别投入到等体积、等物质的量浓度的HCl、NaOH溶液中,产生H2的体积之比是________。 (3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。 (4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则甲烧杯中剩余的反应物是________。 【答案】(1)1∶1 (2)1∶3 (3)3∶1 (4)Al 【解析】(1)根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑得Al与H2的关系式均为2Al~3H2,故只要参加反应的Al的量相等,所得H2的量必相等。(2)因为在反应中Al过量,产生的H2由HCl和NaOH的量决定。根据化学反应中的关系式:6HCl~3H2、2NaOH~3H2,故当HCl、NaOH物质的量相等时,二者产生H2的体积比为1∶3。(3)因为铝足量且产生H2相等,根据关系式n(HCl)∶n(NaOH)=3∶1,又因为两溶液体积相等,故物质的量浓度c(HCl)∶c(NaOH)=n(HCl)∶n(NaOH)=3∶1。(4)其反应原理分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的HCl和NaOH的物质的量一样多时,产生H2的体积比是1∶3,而题设条件体积比为1∶2,说明此题投入的铝粉对盐酸来说是过量的。 【发散类比2】将一定量的镁铝合金样品分成两等份,一份加入足量NaOH 溶液中,充分反应后,收集到标准状况下气体6.72 L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2 L。则原合金样品中镁的质量为( ) A.4.8 g B.6 g C.9.6 g D.12 g 【答案】A 【思维建模】 铝与酸、碱反应生成H2的量的关系 1.铝与酸、碱反应的化学方程式分别为2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑。从化学方程式可以看出Al与酸、碱反应时生成H2的实质都是AlAl3+,2H+H2,所以无论与酸还是与碱反应,Al与H2的关系都是2Al~3H2。 2.等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积比=1∶1。 3.足量的铝分别与等物质的量的HCl和氢氧化钠反应,产生氢气的体积比=1∶3。 4.一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,产生氢气的体积比<<,则必定是a.铝与盐酸反应时,铝过量而盐酸不足;b.铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。 考点三 铝的重要化合物的主要性质及应用 自主梳理 1.氧化铝 (1)物理性质:白色固体,难溶于水,有很高的熔点。 (2)化学性质 2.氢氧化铝 (1)物理性质:白色胶状不溶于水的固体,有较强的吸附性。 (2)化学性质 ① ②Al(OH)3的电离 写出图中有关反应的化学方程式或离子方程式: Ⅰ.Al(OH)3+3H+===Al3++3H2O; Ⅱ.Al(OH)3+OH-===AlO+2H2O; Ⅲ.2Al(OH)3Al2O3+3H2O。 (3)制备 ①向铝盐中加入氨水,离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH。 ②NaAlO2溶液中通入足量CO2,离子方程式为AlO+CO2+2H2O===Al(OH)3↓+HCO。 ③NaAlO2溶液与AlCl3溶液混合:离子方程式为:3AlO+Al3++6H2O===4Al(OH)3↓。 3.常见的铝盐 (1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。 (2)明矾的化学式为KAl(SO4)2·12H2O,它是无色晶体,可溶于水,水溶液pH<7(填“<”、“>”或“=”)。明矾可以净水。其净水的原理是Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中悬浮杂质形成沉淀而净水。 【深度思考】 中学学习阶段接触到许多既能与酸反应又能与碱反应的物质,你还知道有哪些? 【答案】①Al;②Al2O3;③Al(OH)3;④弱酸的铵盐,如:NH4HCO3、CH3COONH4、(NH4)2S等;⑤弱酸的酸式盐,如:NaHCO3、KHS、NaHSO3;⑥氨基酸。 例3、某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO、SO、HCO、OH-、NO十种离子中的若干种,下列推断正确的是( ) A.当溶液中有Al3+生成时,溶液中可能存在:SO、NO、H+、Mg2+ B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO;可能存在Mg2+ C.当溶液中有AlO生成时,溶液中一定存在:OH-、Ba2+、NO D.当溶液中有AlO生成时,溶液中可能存在:OH-、Ba2+、NO、SO 【答案】B 【解析】据题意,一定不含有Cu2+、HCO。当溶液中有Al3+生成时,原溶液中含有H+,不含有NO(产生的气体为NO)、SO、OH-,据电中性原理知其中必定含有SO,于是不能存在Ba2+、Ag+,可能含有Mg2+,A项错误,B项正确;当溶液中有AlO生成时,原溶液含有OH-,肯定没有H+、Ag+、Mg2+,据电中性原理知其中必定含有Ba2+,于是不可能含有SO、SO,可能含有NO,C、D项错误。 【发散类比3】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )。 A.有Mg2+,没有Al3+ B.有Al3+,没有Mg2+ C.有Mg2+和Al3+ D.有大量的H+、Mg2+和Al3+ 【答案】C 【思维建模】 1.Al3+、Al(OH)3、AlO之间的转化关系: 2.“铝三角”转化的应用 (1)判断离子共存问题:Al3+与OH-及AlO、CO、S2-等弱酸根阴离子;AlO与H+、HCO以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。 (2)鉴别(利用滴加顺序不同,现象不同)。 ①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。 ②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。查看更多