- 2021-08-24 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【新高考】2021高考化学一轮考评特训:仿真模拟冲刺标准练(三)
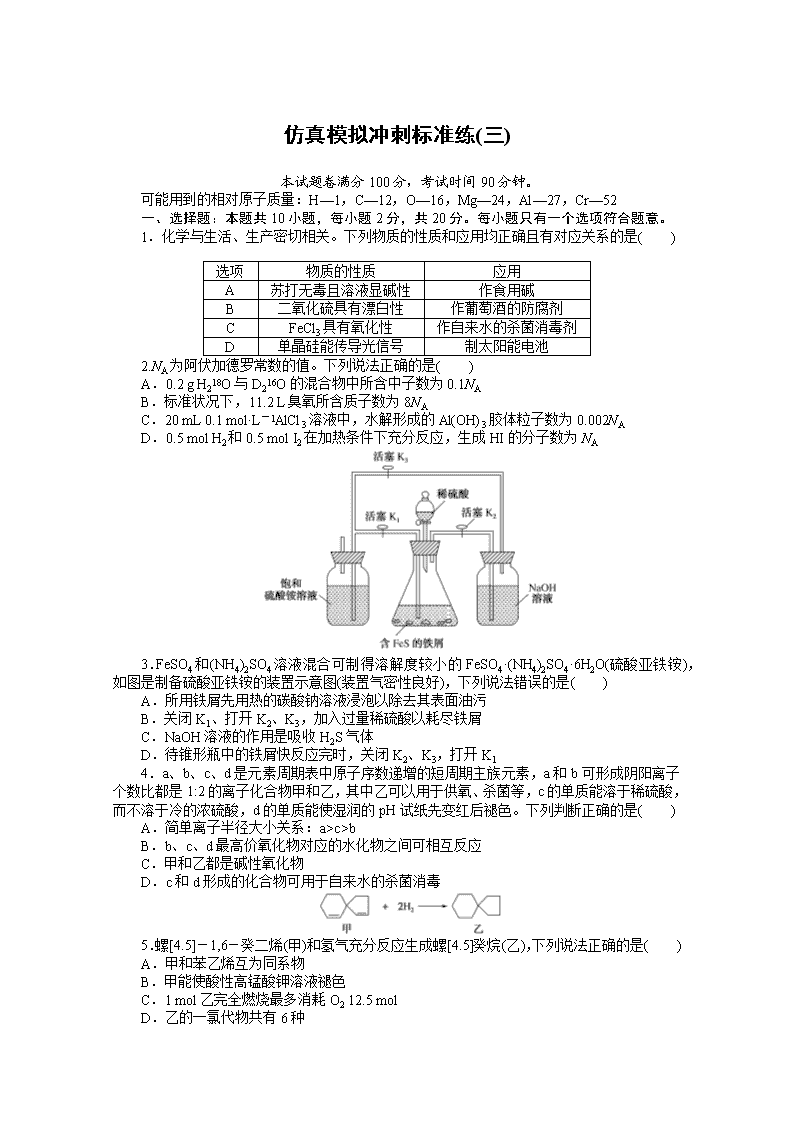
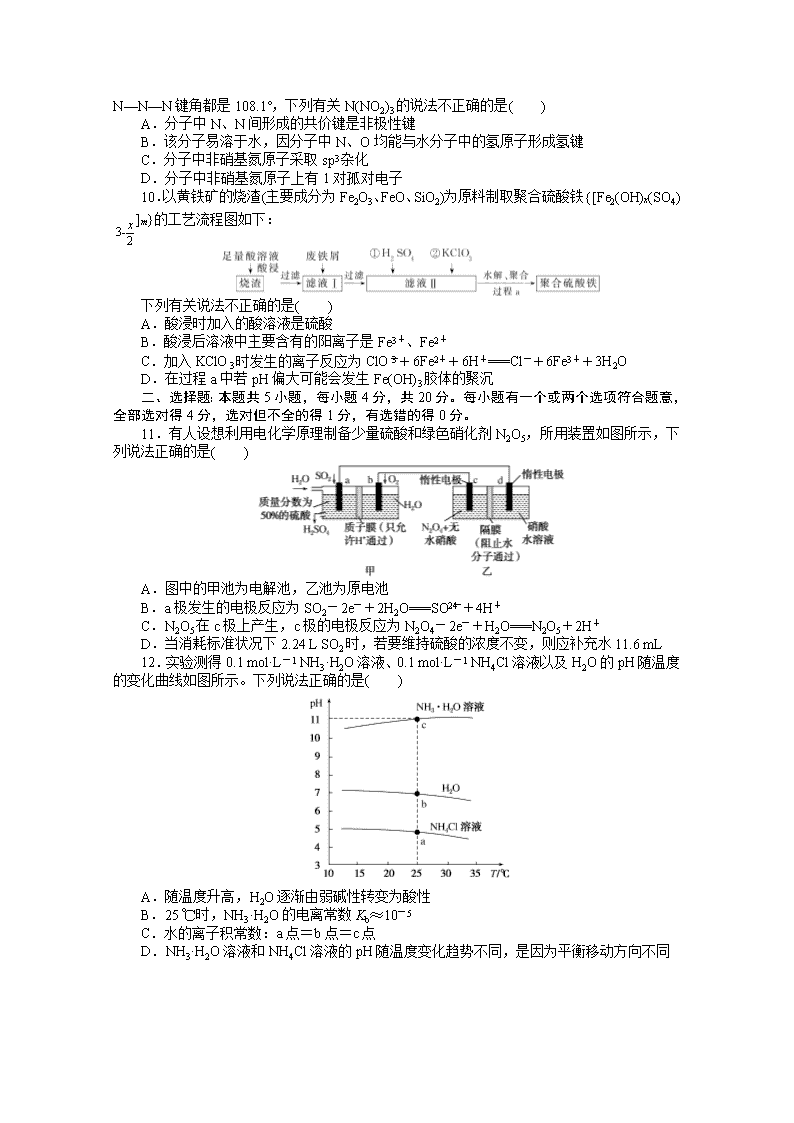
www.ks5u.com 仿真模拟冲刺标准练(三) 本试题卷满分100分,考试时间90分钟。 可能用到的相对原子质量:H—1,C—12,O—16,Mg—24,Al—27,Cr—52 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1.化学与生活、生产密切相关。下列物质的性质和应用均正确且有对应关系的是( ) 选项 物质的性质 应用 A 苏打无毒且溶液显碱性 作食用碱 B 二氧化硫具有漂白性 作葡萄酒的防腐剂 C FeCl3具有氧化性 作自来水的杀菌消毒剂 D 单晶硅能传导光信号 制太阳能电池 2.NA为阿伏加德罗常数的值。下列说法正确的是( ) A.0.2 g H218O与D216O的混合物中所含中子数为0.1NA B.标准状况下,11.2 L臭氧所含质子数为8NA C.20 mL 0.1 mol·L-1AlCl3溶液中,水解形成的Al(OH)3胶体粒子数为0.002NA D.0.5 mol H2和0.5 mol I2在加热条件下充分反应,生成HI的分子数为NA 3.FeSO4和(NH4)2SO4溶液混合可制得溶解度较小的FeSO4·(NH4)2SO4·6H2O(硫酸亚铁铵),如图是制备硫酸亚铁铵的装置示意图(装置气密性良好),下列说法错误的是( ) A.所用铁屑先用热的碳酸钠溶液浸泡以除去其表面油污 B.关闭K1、打开K2、K3,加入过量稀硫酸以耗尽铁屑 C.NaOH溶液的作用是吸收H2S气体 D.待锥形瓶中的铁屑快反应完时,关闭K2、K3,打开K1 4.a、b、c、d是元素周期表中原子序数递增的短周期主族元素,a和b可形成阴阳离子个数比都是1:2的离子化合物甲和乙,其中乙可以用于供氧、杀菌等,c的单质能溶于稀硫酸,而不溶于冷的浓硫酸,d的单质能使湿润的pH试纸先变红后褪色。下列判断正确的是( ) A.简单离子半径大小关系:a>c>b B.b、c、d最高价氧化物对应的水化物之间可相互反应 C.甲和乙都是碱性氧化物 D.c和d形成的化合物可用于自来水的杀菌消毒 5.螺[4.5]-1,6-癸二烯(甲)和氢气充分反应生成螺[4.5]癸烷(乙),下列说法正确的是( ) A.甲和苯乙烯互为同系物 B.甲能使酸性高锰酸钾溶液褪色 C.1 mol乙完全燃烧最多消耗O2 12.5 mol D.乙的一氯代物共有6种 6.装置(Ⅰ)为铁镍可充电电池:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2;装置(Ⅱ)为电解池的装置示意图。当闭合开关K时,Fe电极附近溶液先变红。下列说法错误的是( ) A.打开K,用导线连接Fe和石墨,装置(Ⅱ)的总反应为2Fe+O2+2H2O===2Fe(OH)2 B.闭合K时,OH-通过阴离子交换膜移向电极A C.闭合K时,若Fe和石墨互换,装置(Ⅰ)中有0.1 mol OH-通过阴离子交换膜,则装置(Ⅱ)中Fe电极质量减轻5.6 g D.给装置(Ⅰ)充电时,电极A的电极反应式为Fe(OH)2+2e-===Fe+2OH- 7.常温下,向溶有0.1 mol Cl2的氯水中滴加2 mol·L-1的NaOH溶液,得到溶液的pH随所加NaOH溶液体积的变化图像如下。下列说法正确的是( ) A.若a点对应溶液pH=4,且c(Cl-)=mc(ClO-),则Ka(HClO)= B.向a点对应溶液中通入SO2,溶液的酸性和漂白能力均增强 C.若x=100,b点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+) D.若y=200,c点对应溶液中:c(Na+)=4c(ClO-)+4c(Cl-) 8.常温下,用AgNO3溶液分别滴定等物质的量浓度的KCl、K2CrO4溶液,所得的沉淀溶解平衡图像如下(Ag2CrO4是砖红色沉淀,Xm-表示对应的阴离子)。下列叙述不正确的是( ) A.该温度下AgCl的溶度积等于10-9.75 B.该温度下Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数为107.55 C.可用AgNO3溶液和K2CrO4溶液测定废水中Cl-浓度 D.n点对应的Ag2CrO4溶液中可能有砖红色沉淀出现 9.科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( ) A.分子中N、N间形成的共价键是非极性键 B.该分子易溶于水,因分子中N、O均能与水分子中的氢原子形成氢键 C.分子中非硝基氮原子采取sp3杂化 D.分子中非硝基氮原子上有1对孤对电子 10.以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制取聚合硫酸铁{[Fe2(OH)x(SO4)]m}的工艺流程图如下: 下列有关说法不正确的是( ) A.酸浸时加入的酸溶液是硫酸 B.酸浸后溶液中主要含有的阳离子是Fe3+、Fe2+ C.加入KClO3时发生的离子反应为ClO+6Fe2++6H+===Cl-+6Fe3++3H2O D.在过程a中若pH偏大可能会发生Fe(OH)3胶体的聚沉 二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。 11.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是( ) A.图中的甲池为电解池,乙池为原电池 B.a极发生的电极反应为SO2-2e-+2H2O===SO+4H+ C.N2O5在c极上产生,c极的电极反应为N2O4-2e-+H2O===N2O5+2H+ D.当消耗标准状况下2.24 L SO2时,若要维持硫酸的浓度不变,则应补充水11.6 mL 12.实验测得0.1 mol·L-1 NH3·H2O溶液、0.1 mol·L-1 NH4Cl溶液以及H2O的pH随温度的变化曲线如图所示。下列说法正确的是( ) A.随温度升高,H2O逐渐由弱碱性转变为酸性 B.25 ℃时,NH3·H2O的电离常数Kb≈10-5 C.水的离子积常数:a点=b点=c点 D.NH3·H2O溶液和NH4Cl溶液的pH随温度变化趋势不同,是因为平衡移动方向不同 13.室温下,向20 mL含0.10 mol·L-1 Cr2+和0.10 mol·L-1 Fe2+的混合溶液中滴加0.10 mol·L-1 NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示。若溶液中金属阳离子浓度小于10-5 mol·L-1视为完全沉淀,则下列说法错误的是[已知Cr(OH)2的Ksp为2×10-16,Fe(OH)2的Ksp为8×10-16]( ) A.曲线A表示c(Fe2+) B.当V(NaOH)=30 mL时,Fe2+开始沉淀 C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀 D.V(NaOH)>30 mL时,溶液中c(Fe2+)/c(Cr2+)=4.0 14.十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l)C10H12(l)+3H2(g) ΔH1,②C10H12(l)C10H8(l)+2H2(g) ΔH2。一定温度下,在1 L恒容密闭容器中进行C10H18(1.000 mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随反应时间的变化曲线如图1所示,上述反应的“能量—反应过程”图像如图2所示。 下列有关说法正确的是( ) A.反应至7 h时,C10H18的转化率为2.1% B.反应至7 h时,反应体系中氢气的物质的量为0.849 mol C.反应①的活化能高于反应②的活化能 D.ΔH1>ΔH2>0 15.钠离子电池成本低、安全性好,有望在未来取代锂离子电池,某新型可充电钠离子电池放电的工作原理如图所示。下列分析错误的是( ) A.出于环保考虑,应尽量避免使用重金属(如Pb)作为钠的合金化元素 B.放电时,Na+由右室移向左室 C.放电时,正极反应为:Na0.44MnO2+0.56e-+0.56Na+===NaMnO2 D.充电时,阴极质量变化4.6 g时,外电路中通过0.1 mol e- 三、非选择题:本题共5小题,共60分。 16.(14分)间溴苯甲醛常用作医药中间体,实验室以苯甲醛为原料,在无水AlCl3催化下加热制备间溴苯甲醛。 Ⅰ.催化剂的制备 如图1是实验室制取少量无水AlCl3的相关实验装置。已知无水氯化铝易升华,极易潮解。 (1)若气体A是Cl2,且由KMnO4和浓盐酸反应制取,该反应的离子方程式为 ________________________________________________________________________。 (2)若固体B是AlCl3·6H2O,则气体A是________,通入气体A的目的是________________________________________________________________________ ________________________________________________________________________。 (3)若气体A为Cl2,乙中的药品是碱石灰,则碱石灰的作用是____________________________。 图1 图2 Ⅱ.间溴苯甲醛的制备 实验所用装置如图2(夹持及加热装置已省略): 已知相关物质的沸点如下表所示: 物质 沸点/℃ 液溴 58.8 苯甲醛 179 1,2-二氯乙烷 83.5 间溴苯甲醛 229 实验步骤如下: 步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛在三颈烧瓶中充分混合后,升温至60 ℃,缓慢滴加经浓硫酸干燥过的液溴,维持温度不变,反应一段时间后,冷却。 步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。 步骤3:往洗涤后的有机相中加入适量无水MgSO4固体,放置一段时间后,进行下一操作。 步骤4:减压蒸馏有机相,收集相应馏分。 (1)仪器a的名称为________,本实验需要控制反应温度为60 ℃,为了更好地控制反应温度,宜采用的加热方式是________。 (2)步骤2分液时有机相处于________(填“上层”或“下层”),NaHCO3可以除去有机相中的Br2,反应中1 mol Br2参与反应,转移1 mol电子且产生无色气体,反应的离子方程式为________________________________________________________________________。 (3)步骤3中将加入无水MgSO4固体的有机相放置一段时间后,进行的下一操作是________________________________________________________________________。 17.(10分)“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液。某研究小组用该含碘废液制备NaI固体,实验流程如下: 已知:反应②为2I-+2Cu2++SO+H2O===2CuI↓+SO+2H+ 回答下列问题: (1)产生含碘废液的离子方程式为________________。 (2)反应①中I2与Na2SO3溶液反应的离子方程式为____________________。 (3)反应③中CuI发生了________(填“氧化”或“还原”)反应。 (4)含铁化合物B中含两种元素,铁元素与另一种元素物质的量之比为38,则含铁化合物B的化学式为______________。 (5)反应⑤中有黑色固体和无色气体生成,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为________________。 18.(12分)CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。回答下列问题: (1)CO2催化加氢合成二甲醚的过程中主要发生下列反应: 反应Ⅰ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1 反应Ⅱ:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1 其中,反应Ⅱ分①、②两步完成,请写出反应①的热化学方程式。 ①________________________________________________________________________ ②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1 (2)L(L1、L2)、X分别代表压强或温度,图1表示L一定时,反应Ⅱ中二甲醚的平衡产率随X变化的图像,其中X代表的物理量是________。判断L1、L2的大小,并简述理由:________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。 (3)恒压时,在CO2和H2起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性=×100%)随温度的变化如图2。 ①t ℃时,起始投入a mol CO2、b mol H2,达到平衡时反应Ⅱ消耗的H2的物质的量为________mol。(列出算式即可) ②温度高于300 ℃时,CO2平衡转化率随温度升高而增大的原因是________________________________________________________________________ ________________________________________________________________________。 19.(12分)元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应为2XCl+2CO+2H2O===X2Cl2·2CO·2H2O。回答下列问题: (1)X基态原子的电子排布式为________________。 (2)C、H、O三种原子的电负性由大到小的顺序为________。 (3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示: ①与CO互为等电子体的分子是________。 ②该配合物中氯原子的杂化方式为________。 ③在X2Cl2·2CO·2H2O中,每个X原子能与其他原子形成3个配位键,在图1中用“→”标出相应的配位键。 (4)阿伏加德罗常数的测定有多种方法,X-射线衍射法就是其中的一种。通过对XCl晶体的X-射线衍射图像的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl-的个数为________,若X原子的半径为a pm,晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值NA=________(列计算式表达)。 20.(12分)合成某物质J的路线如下: 已知:① ② 回答下列问题: (1)B分子中含有的官能团名称是________。 (2)J的结构中有________种不同化学环境的氢原子。 (3)反应④的化学方程式是________________________________________________________________________。 (4)C的结构简式是________。 (5)反应①~⑧中属于取代反应的是________。 (6)写出F和H在一定条件下聚合生成高分子化合物的化学方程式________________________________________________________________________ ________________________________________________________________________。 (7)资料显示:反应⑧有一定的限度,在D与I发生反应时加入有机碱三乙胺能提高目标产物的产率,其原因是________________________________________________________________________。 仿真模拟冲刺标准练(三) 1.A 选项A,Na2CO3在水中水解使溶液显碱性且无毒,可用作食用碱,正确;选项B,二氧化硫作葡萄酒的防腐剂是利用其能杀菌和抗氧化的性质,错误;选项C,FeCl3能发生水解,生成氢氧化铁胶体,可作为自来水的净水剂,但不能用于自来水的杀菌消毒,错误;选项D,单晶硅属于半导体材料,不能传导光信号,错误。 2.A H218O与D216O的摩尔质量均为20 g·mol-1,1 mol H218O和1 mol D216O所含中子均为10 mol,0.2 g(即0.01 mol)该混合物所含中子数为0.01×10×NA=0.1NA,A项正确;1个O3含有24个质子,标准状况下11.2 L O3为0.5 mol,所含中子数为0.5×24×NA=12NA,B项错误;由于Al3+水解为可逆反应,且Al(OH)3胶体粒子是许多Al(OH)3微粒的聚合体,故20 mL 0.1 mol·L-1AlCl3溶液中水解形成Al(OH)3胶体的粒子数小于0.002NA,C项错误;H2+I22HI为可逆反应,0.5 mol H2和0.5 mol I2在加热条件下反应不能进行完全,生成HI的分子数小于NA,D项错误。 3.B 铁屑表面上通常含有油污(主要成分为油脂),将铁屑在热的纯碱溶液中浸泡可以有效除去油污,利用了碳酸钠的水解原理及油脂的水解原理,A正确;该实验中先使稀硫酸和铁屑反应,利用产生的H2将装置中的O2排尽,产生的H2S气体用烧碱溶液吸收,但此过程中不能耗尽铁屑,否则后续实验中将无法利用压强差将生成的FeSO4压到饱和硫酸铵溶液中,并且铁屑可防止Fe3+的生成,B错误,C正确;在实验中,待锥形瓶中铁屑快反应完时,关闭K2、K3,打开K1,铁屑和稀硫酸还持续反应,产生的H2将产生的FeSO4溶液压到饱和硫酸铵溶液中,二者混合产生溶解度较小的FeSO4·(NH4)2SO4·6H2O,D正确。 4.B 简单离子半径大小关系:r(O2-)>r(Na+)>r(Al3+),A错误;Na、Al、Cl最高价氧化物对应的水化物分别是NaOH、Al(OH)3、HClO4,它们可相互反应,B正确;Na2O是碱性氧化物,Na2O2不是碱性氧化物,故C错误;c和d形成的化合物为AlCl3,Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体具有吸附性,可吸附水中悬浮杂质,但不能用于自来水的杀菌消毒,D错误。 5.B 甲分子中含有两个碳碳双键,分子式为C10H14,苯乙烯的结构简式为,含有一个碳碳双键,分子式为C8H8,甲和苯乙烯结构不相似,不属于同系物,A错误;甲分子中含有两个碳碳双键,故能使酸性KMnO4溶液褪色,B正确;乙的分子式为C10H18,故1 mol乙完全燃烧的耗氧量为14.5 mol,C错误;乙分子中含有5种氢原子,故乙的一氯代物有5种,D错误。 6.C 打开K,用导线连接Fe和石墨,装置(Ⅱ)为原电池,发生Fe的吸氧腐蚀,总反应为2Fe+O2+2H2O===2Fe(OH)2,故A正确;闭合K时,Fe电极附近溶液先变红, 说明此电极附近产生OH-,电极反应式为2H2O+2e-===2OH-+H2↑,因此Fe电极为阴极,电极A为装置(Ⅰ)放电时的负极,电极反应式为Fe-2e-+2OH-===Fe(OH)2,电极B为装置(Ⅰ)放电时的正极,电极反应式为NiO2+2e-+2H2O===Ni(OH)2+2OH-,OH-通过阴离子交换膜移向电极A,故B正确;闭合K时,若Fe和石墨互换,此时Fe电极为阳极,电极反应为Fe-2e-===Fe2+,装置(Ⅰ)中有0.1 mol OH-通过阴离子交换膜,则Fe电极质量减轻2.8 g,故C错误;给装置(Ⅰ)充电时,电极A应接电源负极,其电极反应式为Fe(OH)2+2e-===Fe+2OH-,故D正确。 7.C 若a点对应溶液pH=4,则c(H+)=1.0×10-4 mol·L-1,对应溶液为氯水,由Cl2+H2OHCl+HClO,则c(Cl-)=c(HClO)+c(ClO-),又c(Cl-)=m·c(ClO-),c(HClO)=(m-1)c(ClO-),Ka(HClO)==,A项错误;向a点对应溶液中通入SO2发生反应Cl2+SO2+2H2O===H2SO4+2HCl,Cl2+H2OHCl+HClO平衡向左移动,溶液漂白能力减弱,B项错误;若x=100,加入的n(NaOH)=0.2 mol,发生反应Cl2+2NaOH===NaCl+NaClO+H2O,ClO-水解,使溶液呈碱性,故b点溶液中离子浓度大小关系:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),C项正确;若y=200,加入的n(NaOH)=0.4 mol,则c点溶液中的溶质为0.2 mol NaOH、0.1 mol NaCl、0.1 mol NaClO,由物料守恒知,c(Na+)=2c(Cl-)+2c(ClO-)+2c(HClO),D项错误。 8.D Ksp(AgCl)=c(Ag+)·c(Cl-),-lg Ksp(AgCl)=[-lg c(Ag+)]+[-lg c(Cl-)],Ksp(Ag2CrO4)=c2(Ag+)·c(CrO),-lg Ksp(Ag2CrO4)=2×[-lg c(Ag+)]+[-lg c(CrO)],选取AgCl溶解平衡曲线上的点(4,5.75)进行计算,解得Ksp(AgCl)=10-9.75,同理,选取Ag2CrO4溶解平衡曲线上的点(4,3.975)进行计算,解得Ksp(Ag2CrO4)=10-11.95,A正确;该温度下Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数K===107.55,故B正确;Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数(K=107.55)很大,且Ag2CrO4是砖红色沉淀,故可以用K2CrO4溶液作指示剂,用AgNO3标准溶液滴定废水中的Cl-(终点时有砖红色沉淀生成),故C正确;n点对应的Ag2CrO4溶液中Qc(Ag2CrO4)查看更多