- 2021-08-24 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
课标版2021高考化学一轮复习专题十二原子结构与化学键元素周期律与元素周期表课件
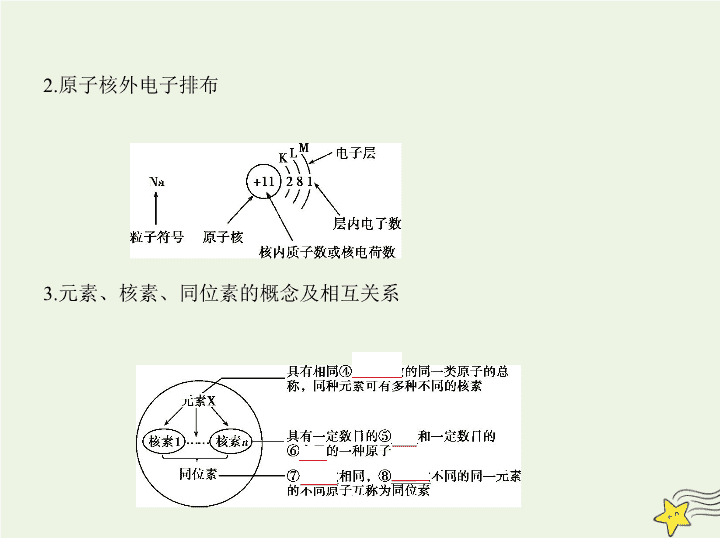
考点一 原子结构与化学键 考点清单 考点基础 1.原子的构成及各微粒之间的数量关系 (1)原子的构成 原子 X) (A Z ( ): ( - ): ( ): Z A Z Z 质子 个 决定① 元素的 种类原子核 中子 个 决定② 同位素的 种类 核外电子 个 最外层电子数决定③ 元素的化学 性质 (2)各微粒间的数量关系 X表示质量数为A、质子数为Z的一个原子。 a.核电荷数=核内质子数=原子核外电子数; b.质量数(A)=质子数(Z)+中子数(N); c.离子所带电荷数=|质子数-核外电子总数|。 A Z 2.原子核外电子排布 3.元素、核素、同位素的概念及相互关系 4.化学键与分子间作用力 说明 (1)离子化合物中一定含有离子键,离子键只能存在于离子化合物 中。 (2)共价键可存在于离子化合物、共价化合物和单质中。 (3)熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导 电的化合物是共价化合物,如HCl。 考点二 元素周期律及其应用 考点基础 项目 同周期(左→右) 同主族(上→下) 原子 结构 核电荷数 逐渐增大 逐渐增大 电子层数 相同 逐渐增多 原子半径 逐渐减小(稀有气体元 素除外) 逐渐增大 离子半径 阳离子逐渐减小,阴离 子逐渐减小,r(阴离子)> r(阳离子) 逐渐增大 性质 化合价 最高正化合价由+1→+ 7(O、F除外),最低负化 合价=-(8-主族序数)(H 除外) 最高正化合价=主族序 数(O、F除外) 元素的金属性和非金 属性 金属性逐渐减弱 非金属性逐渐增强 (稀有气体元素除外) 金属性逐渐增强 非金属性逐渐减弱 离子的氧化性、还原 性 阳离子氧化性逐渐增 强 阴离子还原性逐渐减 弱 阳离子氧化性逐渐减 弱 阴离子还原性逐渐增 强 气态氢化物稳定性 逐渐增强 逐渐减弱 最高价氧化物对应的 水化物的酸碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强 酸性逐渐减弱 考点三 元素周期表及其应用 考点基础 1.元素周期表的结构 : 2 : 8 : 8 (7 : 18 ) : 18 : 32 : 32 : , 7 : , 7(18 : 8 9 10) 0 第一周期 ① 种 元素 短周期 第二周期 ② 种 元素 第三周期 ③ 种 元素周期 个 第四周期 ④ 种 元素 横行 第五周期 ⑤ 种 元素长周期 第六周期 ⑥ 种 元素 第七周期 ⑦ 种 元素 主族 由长周期和短周期元素共同构成 共⑧ 个 主族族 副族 完全由长周期元素构成 共⑨ 个 副族个 第Ⅷ族 第⑩ 、、 三 个纵行纵行 : 18 族 第� 纵 行 2.元素原子最外层电子数与族的关系 (1)最外层电子数为1~2的元素:ⅠA族、ⅡA族、副族、0族(He)。 (2)最外层电子数在3~7之间的元素一定是主族元素。 (3)最外层电子数为8的元素:0族(He除外)。 3.元素周期表的构成规律 (1)同构规律 稀有气体原子与同周期非金属元素的阴离子、下周期金属元素的阳离子, 具有相同的电子层结构。 (2)同主族序数差规律 a.ⅠA族元素随电子层数的增加,原子序数依次相差2、8、8、18、18、32; b.ⅡA族元素随电子层数的增加,原子序数依次相差8、8、18、18、3 2;0族元素依次差8、8、18、18、32、32; c.ⅢA~ⅦA族元素随电子层数的增加,原子序数依次相差8、18、18、32、 32。 (3)对角线关系 对角线元素(右图中的A与D)存在着相似性,如Li与Mg、Be与Al等,但只适 用于第二、三周期。这是由A、D的原子半径相近引起的。 方法1 元素金属性、非金属性强弱的比较 1.比较元素金属性强弱的方法 (1)金属与水(或非氧化性酸)的反应越容易,其对应元素的金属性越强。 (2)最高价氧化物对应水化物的碱性越强,则对应金属元素的金属性越强。 (3)在金属活动性顺序中,金属的位置越靠前,其金属性越强。 (4)同一周期,金属元素越靠前,其金属性越强;同一主族,金属元素越靠下,其 金属性越强。 (5)金属与盐溶液的置换反应,若A元素的单质能置换出B元素的单质,则A 元素的金属性强于B元素。 方法技巧 (6)一般金属阳离子的氧化性越强,则对应金属元素的金属性越弱。(注:氧 化性Fe3+>Cu2+>Fe2+,金属性Fe>Cu) (7)电化学原理:不同金属形成原电池时,通常作负极的金属的金属性 强;通常在电解池中的阴极上先析出的金属的金属性弱。 2.比较元素非金属性强弱的方法 (1)非金属单质与H2越易化合,则其对应元素的非金属性越强。 (2)形成的氢化物越稳定,则其对应元素的非金属性越强。 (3)最高价氧化物对应水化物的酸性越强,其对应元素的非金属性越强。 (4)同一周期(稀有气体元素除外),非金属元素越靠右,其非金属性越强;同 一主族,非金属元素越靠上,其非金属性越强。 (5)非金属之间的置换反应,若A元素的单质能置换出B元素的单质,则A元 素的非金属性强于B元素。 方法2 微粒半径大小的比较 1.微粒半径大小的比较规律 原子半径 ①同一周期,随着原子序数递增,原子半径逐渐减 小(稀有气体元素除外)。如: r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl) ②同一主族,随着电子层数递增,原子半径逐渐增 大。如: r(Li)查看更多