- 2021-07-05 发布 |
- 37.5 KB |
- 24页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高考化学一轮复习专题十原子结构与化学键元素周期律与元素周期表课件
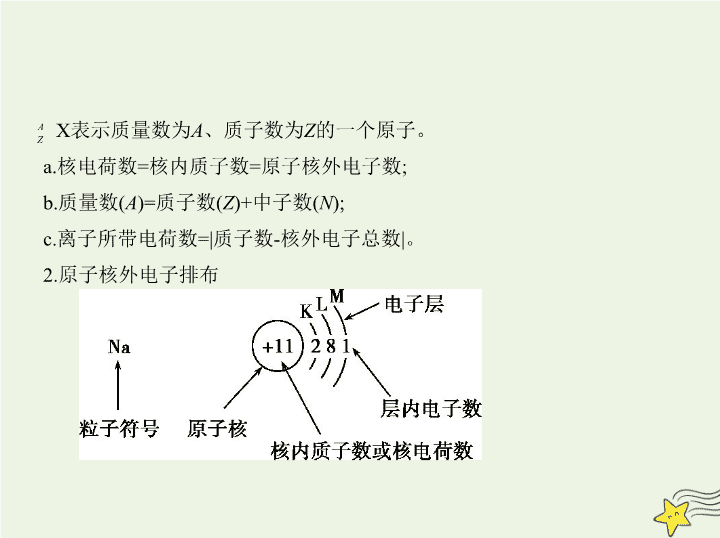
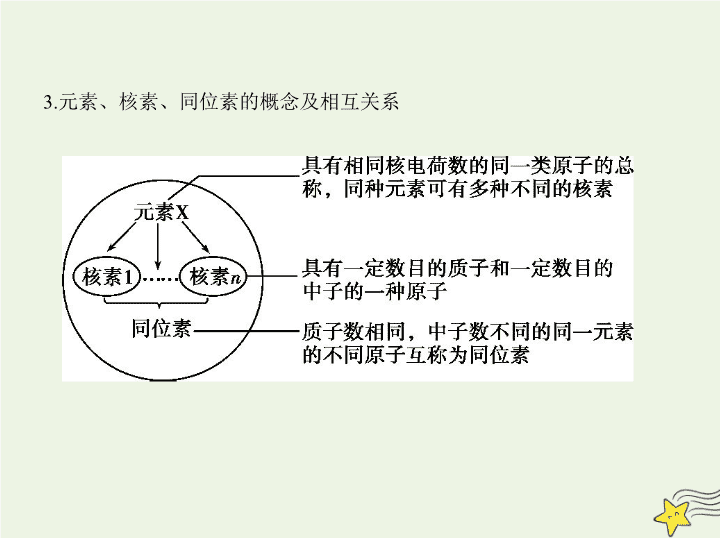
考点一 原子结构与化学键 考点清单 基础知识 1.原子的构成及各微粒之间的数量关系 (1)原子的构成 原子 X) X表示质量数为 A 、质子数为 Z 的一个原子。 a.核电荷数=核内质子数=原子核外电子数; b.质量数( A )=质子数( Z )+中子数( N ); c.离子所带电荷数=|质子数-核外电子总数|。 2.原子核外电子排布 3.元素、核素、同位素的概念及相互关系 4.离子键、共价键的比较 离子键 共价键 非极性键 极性键 概念 阴、阳离子通过静电 作用所形成的化学键 原子间通过共用电子对(电子云重叠)而形成的化 学键 成键粒子 阴、阳离子 原子 成键实质 阴、阳离子的静电作用 共用电子对不偏向任何一方 共用电子对偏向一方 原子 形成条件 活泼金属元素与活泼 非金属元素经电子得 失,形成离子键 同种元素原子之间成 键 不同种元素原子之间 成键 形成的物质 离子化合物 非金属单质;某些共价 化合物或离子化合物 共价化合物或离子化 合物 5.化学键与物质类别的关系 特别提示 ①离子化合物中一定含有离子键,离子键只能存在于离子化合 物中。 ②共价键可存在于离子化合物、共价化合物和单质中。 ③熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导 电的化合物是共价化合物,如HCl。 6.化学键的表示方法——电子式 (1)概念:在元素符号周围用“·”或“ × ”来代表原子的最外层电子(价电 子)的式子。 考点二 元素周期表与元素周期律 基础知识 一、元素周期表 1.元素周期表的结构 2.元素原子最外层电子数与族的关系 (1)最外层电子数为1~2的元素:ⅠA族、ⅡA族、副族、0族(He)。 (2)最外层电子数在3~7之间的元素一定是主族元素。 (3)最外层电子数为8的元素:0族(He除外)。 3.元素周期表的构成规律 (1)同构规律 稀有气体原子与同周期非金属元素的阴离子、下周期金属元素的阳离子, 具有相同的电子层结构。 (2)同主族序数差规律 a.ⅠA族元素随电子层数的增加,原子序数依次相差2、8、8、18、18、32; b.ⅡA族元素随电子层数的增加,原子序数依次相差8、8、18、18、32;0族 元素依次差8、8、18、18、32、32; c.ⅢA~ⅦA族元素随电子层数的增加,原子序数依次相差8、18、18、32、 32。 (3)对角线关系 对角线元素(图中的A与D)存在着相似性,如Li与Mg、Be与Al等,但只适用 于第二、三周期。这是由A、D的原子半径相近引起的。 项目 同周期(左→右) 同主族(上→下) 原子 结构 核电荷数 逐渐增大 逐渐增大 电子层数 相同 逐渐增多 原子半径 逐渐减小(稀有气体元 素除外) 逐渐增大 离子半径 阳离子逐渐减小,阴离 子逐渐减小, r (阴离子)> r (阳离子) 逐渐增大 二、元素周期律 性质 化合价 最高正化合价由+1→+7(O、F除外),最低负化合价=-(8-主族序数) 最高正化合价=主族序 数(O、F除外) 元素的金属性和非金 属性 金属性逐渐减弱非金属性逐渐增强(稀有气体元素除外) 金属性逐渐增强 非金属性逐渐减弱 离子的氧化性、还原 性 阳离子氧化性逐渐增强阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱阴离子还原性逐渐增强 气态氢化物稳定性 逐渐增强 逐渐减弱 最高价氧化物对应的 水化物的酸碱性 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强 酸性逐渐减弱 第一电离能 呈增大趋势(ⅡA、 ⅤA族元素除外) 逐渐减小 电负性 逐渐增大 逐渐减小 项目 同周期(左→右) 同主族(上→下) 一、元素金属性、非金属性强弱的比较 1.比较元素金属性强弱的方法 (1)金属与水(或非氧化性酸)的反应越容易,其对应元素的金属性越强。 (2)最高价氧化物对应水化物的碱性越强,则对应金属元素的金属性越强。 (3)在金属活动性顺序中,金属元素的位置越靠前,其金属性越强。 (4)同一周期,金属元素越靠前,其金属性越强;同一主族,金属元素越靠下,其 金属性越强。 知能拓展 (5) 金属与盐溶液的置换反应 , 若 A 元素的单质能置换出 B 元素的单质 , 则 A 元素的金属性强于 B 元素。 (6) 一般金属阳离子的氧化性越强 , 则对应金属元素的金属性越弱。 ( 注 : 氧 化性Fe 3+ >Cu 2+ >Fe 2+ ,金属性Fe>Cu) (7)电化学原理:不同金属形成原电池时,通常作负极的金属的金属性强;通 常在电解池阴极上先析出的金属的金属性弱。 2.比较元素非金属性强弱的方法 (1)非金属单质与H 2 越易化合,则其对应元素的非金属性越强。 (2)形成的简单氢化物越稳定,则其对应元素的非金属性越强。 (3)最高价氧化物对应水化物的酸性越强,其对应元素的非金属性越强。 (4)同一周期(稀有气体元素除外),非金属元素越靠右,其非金属性越强;同 一主族,非金属元素越靠上,其非金属性越强。 (5)非金属之间的置换反应,若A元素的单质能置换出B元素的单质,则A元 素的非金属性强于B元素。 二、微粒半径大小的比较 1.微粒半径大小的比较规律 原子 半径 ①同一周期,随着原子序数递增,原子半径逐渐减 小(稀有气体元素除外)。如: r (Na)> r (Mg)> r (Al)> r (Si)> r (P)> r (S)> r (Cl) ②同一主族,随着电子层数递增,原子半径逐渐增 大。如: r (Li)< r (Na)< r (K)< r (Rb)< r (Cs) ③不同周期和主族,选参照进行比较。如Rb和Ca 比较,因 r (K)> r (Ca), r (Rb)> r (K),所以 r (Rb)> r (Ca) 离子 半径 ①同种元素的粒子半径:阴离子大于原子,原子大 于阳离子,低价阳离子大于高价阳离子。如: r (Cl - )> r (Cl), r (Fe)> r (Fe 2+ )> r (Fe 3+ ) ②电子层结构相同的离子,核电荷数越大,半径越 小。如: r (O 2- )> r (F - )> r (Na + )> r (Mg 2+ )> r (Al 3+ ) ③带相同电荷的离子,电子层数越多,半径越大。 如: r (Li + )< r (Na + )< r (K + )< r (Rb + )< r (Cs + ), r (O 2- )< r (S 2- ) < r (Se 2- )< r (Te 2- ) ④核电荷数、电子层数均不同的离子可选一种 离子作为参照进行比较。如比较 r (K + )与 r (Mg 2+ ) 可选 r (Na + )为参照: r (K + )> r (Na + )> r (Mg 2+ ) 2.“三看”法快速判断简单粒子半径大小 一看电子层数:最外层电子数相同时,电子层数越多,半径越大。 二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小。 三看核外电子数:当核电荷数相同时,核外电子数越多,半径越大。 例 (2019江西上饶六校一联,12)X、Y、Z、W、R是5种短周期元素,原子 序数依次增大,X是周期表中原子半径最小的元素,Y原子最外层电子数是 次外层电子数的3倍, Z、W、R处于同一周期,R与Y处于同一族,Z、W原 子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确 的是 ( ) A.Y、Z、W离子具有相同的电子层结构,半径依次增大 B.元素Z、W、R的最高价氧化物对应水化物两两之间可以反应 C.元素X与元素Y可以形成两种共价化合物,且这两种化合物只有一种类 型的共价键 D.元素Y、R分别与元素X形成的简单化合物的热稳定性:X m Y查看更多