- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习铁及其化合物学案
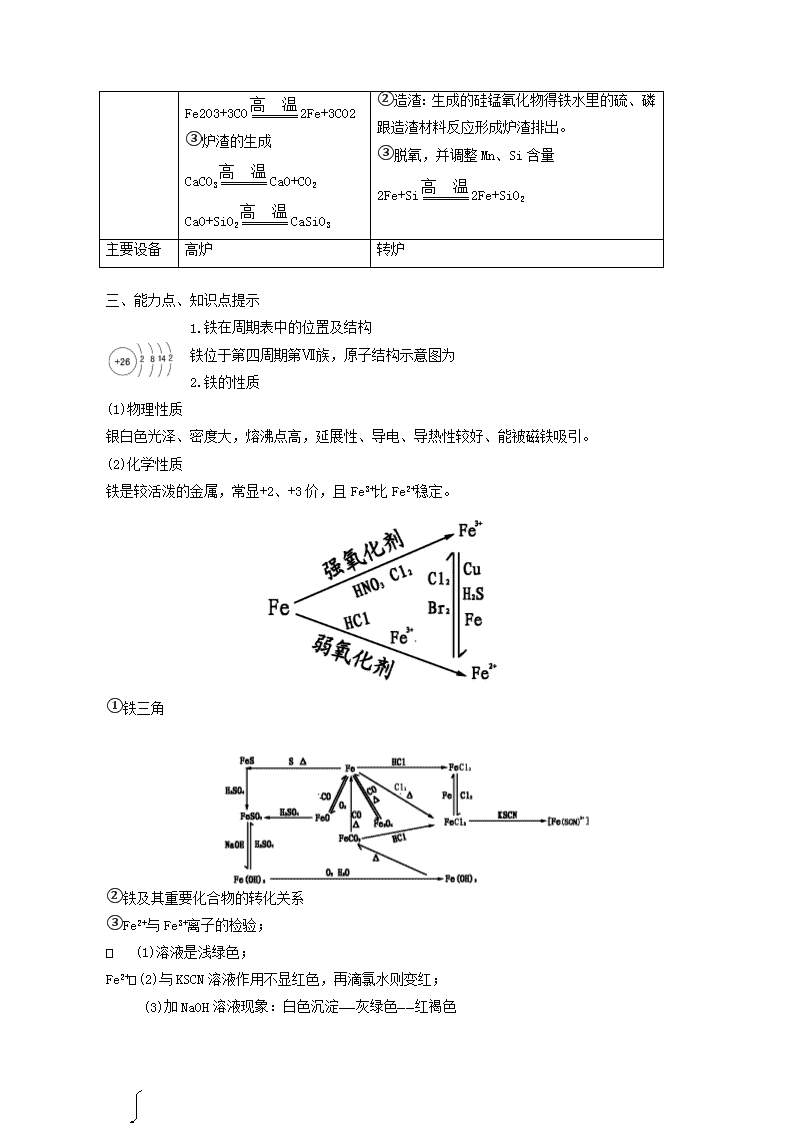
铁及其化合物 知识结构 1.铁的重要氧化物的比较 铁的氧化物 FeO Fe2O3 Fe3O4 色态 / 铁红 磁性氧化铁 铁的价态 黑色粉末 红棕色粉末 黑色晶体 水溶性 +2 +3 +2、+3 铁的氧化物与盐酸反应 不溶 不溶 不溶 铁的氧化物与Co反应 FeO+2HCl=FeCl +H2O Fe2O3+6HCl=2FeCl3+3H2O Fe3O4+8HCl=FeCl2+2FeCl3+4H2O 铁的氧化物与Co反应 FexOy+yCOxFe+yCO2 2.生铁与钢的比较 铁的合金 生铁 钢 含碳量 2%~4。3% 0.03~2% 其它杂质 含硅、锰、硫、磷较多 含硅、锰少量,硫和磷几乎没有 机械性能 硬而脆、无韧性 硬而韧、有弹性 机械加工 可铸不可锻 可铸、可锻、可延压 3.炼铁和炼钢的比较 炼铁 炼钢 原料 铁矿石、焦炭、石灰石、空气 生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂 化学原理 在高温下用还原剂从铁矿石里还原出来 在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去 主 要 反 应 ①还原剂的生成 C+O2CO2+Q CO2+C2CO-Q ②铁的还原 ①氧化:2Fe+O22FeO FeO氧化铁水里的Si、Mn、C等。如C+FeO Fe+CO Fe2O3+3CO2Fe+3CO2 ③炉渣的生成 CaCO3CaO+CO2 CaO+SiO2CaSiO3 ②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。 ③脱氧,并调整Mn、Si含量 2Fe+Si2Fe+SiO2 主要设备 高炉 转炉 三、能力点、知识点提示 1.铁在周期表中的位置及结构 铁位于第四周期第Ⅶ族,原子结构示意图为 2.铁的性质 (1)物理性质 银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。 (2)化学性质 铁是较活泼的金属,常显+2、+3价,且Fe3+比Fe2+稳定。 ①铁三角 ②铁及其重要化合物的转化关系 ③Fe2+与Fe3+离子的检验; (1)溶液是浅绿色; Fe2+(2)与KSCN溶液作用不显红色,再滴氯水则变红; (3)加NaOH溶液现象:白色沉淀——灰绿色——红褐色 (1)与无色KSCN溶液作用显红色; Fe3+(2)溶液显黄色或棕黄色; (3)加入NaOH溶液,产生红褐色沉淀。 3.铁的合金 一般地说,含碳量在2%~4.3%的铁的合金叫做生铁。生铁里除含碳外,还含有硅、锰以及少 量的硫、磷等,它可铸不可煅。根据碳的存在形式可分为炼钢生铁、铸造生铁和球墨铸铁等几种。 一般地说,含碳量在0.03%~2%的铁的合金叫做钢。钢坚硬有韧性、弹性,可以锻打、压延,也可以铸造。 钢的分类方法很多,如果按化学成分分类、钢可以分为碳素钢和合金钢两大类。碳素钢就是普通的钢,合金钢也叫特种钢,是在碳素钢是适当地加入一种或几种,如锰、铬、镍、钨、铜等合金元素而制成的。合金元素使合金钢具有各种不同的特殊性能。 4.炼铁 (1)反应原理:利用氧化——还原反应,在高温下,用还原剂(主要是Co)把铁从铁矿石里还原出来。 (2)原料、铁矿石、焦炭、石灰石和空气 (3)设备:高炉 (4)生产过程 ①还原剂的生成 C+O2CO2+热 CO2+C 2CO ②铁矿石还原成铁 Fe2O3+3CO 2Fe+3CO2↑ ③除脉石、炉渣的形成 CaCO3CaO+CO2↑ SiO2+CaOCaSiO3 5.炼钢 (1)设备:氧气顶吹转炉 (2)主要原料:炼钢生铁、生石灰、氧气。 (3)反应原理:利用氧化还原反应,在高温下,用氧化剂把生铁中过多的碳和其它杂质氧化为气体或炉渣除去。 (4)炼钢时的主要反应: ①氧化剂的生成,热能的来源 2Fe+O22FeO+Q ②降低碳的含量 C+FeOCO+Fe-Q ③除去S、P等杂质 ④加硅铁、锰铁、铝除剩余FeO——脱氧 2FeO+Si2Fe+SiO2查看更多