- 2021-08-23 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
重庆市万州新田中学2019-2020学年高二上学期期中考试化学试卷
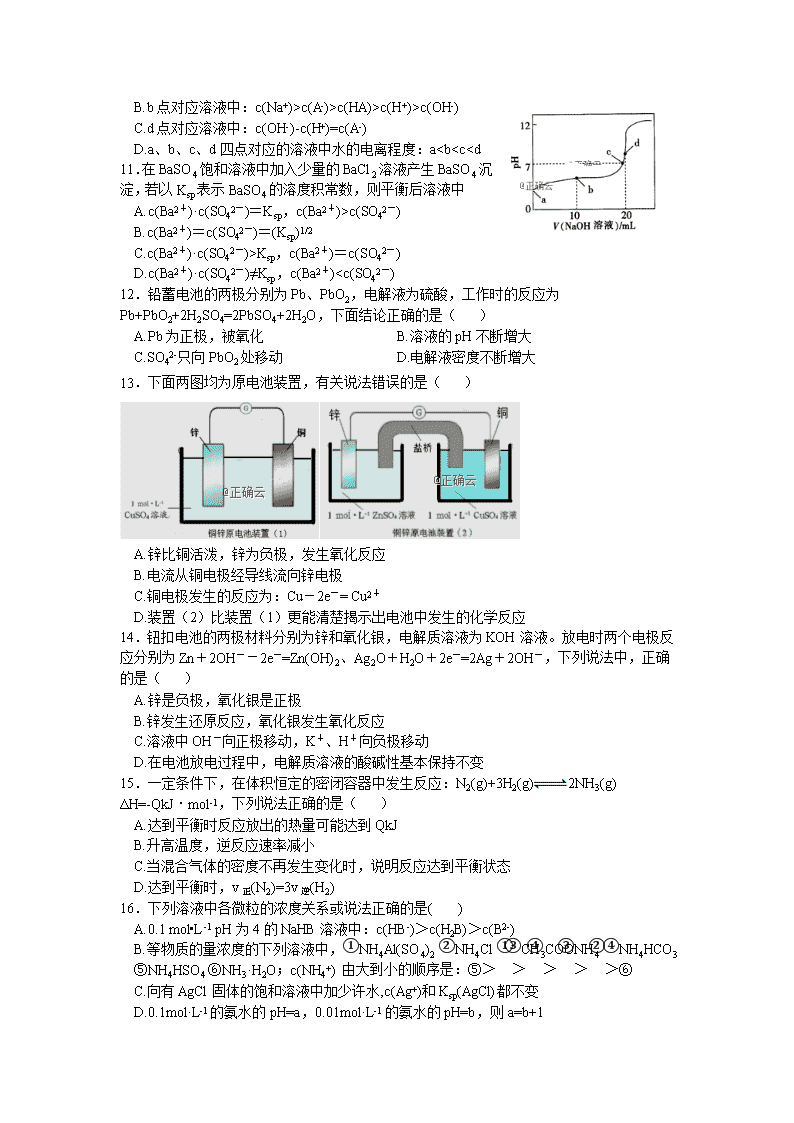
第I卷(选择题) 一、单选题 (48分)相对原子质量 H-1 Cu-64 Fe-56 O-16 S-32 1.最近《科学》杂志评出十大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中正确的是( ) A.水的离子积仅适用于纯水 B.水的电离需要通电 C.升高温度一定使水的离子积增大 D.加入电解质一定会破坏水的电离平衡 2.下列各组物质按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是 A.氯水,水煤气,硫酸,醋酸,干冰 B.冰醋酸,盐酸,硫酸钡,次氯酸,乙醇 C.纯碱,明矾,水玻璃,氢硫酸,三氧化硫 D.胆矾,漂白粉,氯化钾,氢氟酸,氯气 3.下列物质因水解使溶液呈碱性的是( ) A. NaOH B. NH4Cl C. Na2CO3 D. Na2O 4.下列应用与盐类的水解无关的是( ) A.热的纯碱溶液可去除油污 B.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 C.TiCl4溶于大量水加热制备TiO2 D.NaCl可用作防腐剂和调味剂 5.某浓度的氨水中存在下列平衡:NH3•H2O⇌NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是( ) ①适当升高温度 ②加入NH4Cl固体 ③通入NH3 ④加入少量盐酸 A.①② B.②③ C.③④ D.②④ 6.在相同温度下,100 mL 0.01 mol/L的醋酸溶液与10 mL 0.1 mol/L的醋酸溶液相比较,下列数值前者大于后者的是 A.H+的物质的量浓度 B.醋酸电离的程度 C.中和时所需NaOH的量 D.CH3COOH的物质的量 7.25 ℃时,0.01 mol/L的HCl溶液中水电离出的H+的浓度是( ) A.1×10-10 mol/L B.1×10-2 mol/L C.1×10-7 mol/L D.1×10-12 mol/L 8.常温下,下列各组离子在指定溶液中能大量共存的是( ) A.无色透明的溶液中: Fe3+、Mg2+、SCN −、Cl − B.=1×10-12的溶液中:K+、Na+、CO32−、NO3− C.的溶液中: K+、NH4+、MnO4−、SO42- D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO32- 9.下列离子方程式书写正确的是 A.Na2S的水解:S2-+ 2H2OH2S + 2OH− B.NaHCO3在水溶液中的电离:HCO3−+ H2O H2 CO3+ OH− C.NH4Cl的水解:NH4+ + H2O NH3·H2O + OH− D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3− = Al(OH)3↓+3CO2↑ 10.常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( ) A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡 B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-) C.d点对应溶液中:c(OH-)-c(H+)=c(A-) D.a、b、c、d四点对应的溶液中水的电离程度:a查看更多
相关文章
- 当前文档收益归属上传用户