- 2021-08-23 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
氮的循环(1) 教案
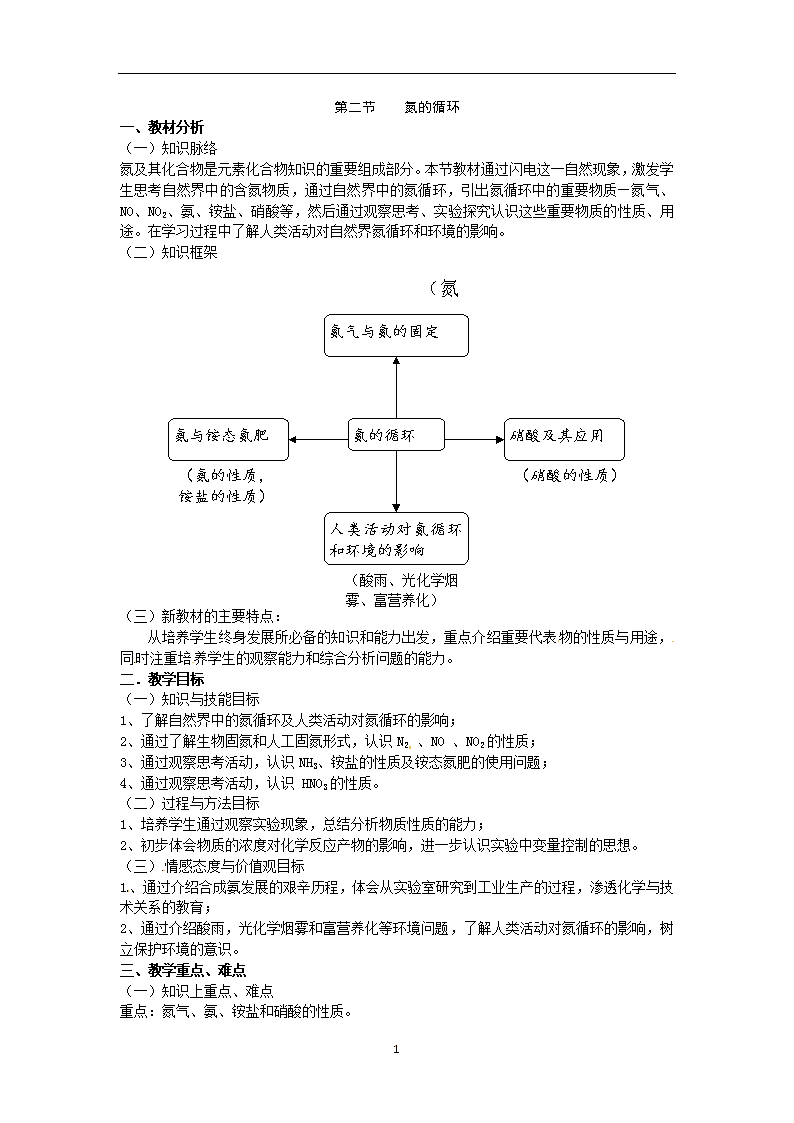
第二节 氮的循环 一、教材分析 (一)知识脉络 氮及其化合物是元素化合物知识的重要组成部分。本节教材通过闪电这一自然现象,激发学生思考自然界中的含氮物质,通过自然界中的氮循环,引出氮循环中的重要物质—氮气、NO、NO2、氨、铵盐、硝酸等,然后通过观察思考、实验探究认识这些重要物质的性质、用途。在学习过程中了解人类活动对自然界氮循环和环境的影响。 (二)知识框架 (氮气的性质,氮的固定) 氮气与氮的固定 硝酸及其应用 氨与铵态氮肥 氮的循环 (硝酸的性质) (氨的性质, 铵盐的性质) 人类活动对氮循环和环境的影响 (酸雨、光化学烟雾、富营养化) (三)新教材的主要特点: 从培养学生终身发展所必备的知识和能力出发,重点介绍重要代表物的性质与用途,同时注重培养学生的观察能力和综合分析问题的能力。 二.教学目标 (一)知识与技能目标 1、了解自然界中的氮循环及人类活动对氮循环的影响; 2、通过了解生物固氮和人工固氮形式,认识N2 、NO 、NO2的性质; 3、通过观察思考活动,认识NH3、铵盐的性质及铵态氮肥的使用问题; 4、通过观察思考活动,认识 HNO3的性质。 (二)过程与方法目标 1、培养学生通过观察实验现象,总结分析物质性质的能力; 2、初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的思想。 (三)情感态度与价值观目标 1、通过介绍合成氨发展的艰辛历程,体会从实验室研究到工业生产的过程,渗透化学与技术关系的教育; 2、通过介绍酸雨,光化学烟雾和富营养化等环境问题,了解人类活动对氮循环的影响,树立保护环境的意识。 三、教学重点、难点 (一)知识上重点、难点 重点:氮气、氨、铵盐和硝酸的性质。 3 难点:硝酸的氧化性。 (二)方法上重点、难点 培养学生通过观察实验现象总结分析物质性质的能力,并使学生初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的重要性。 四、教学准备 (一)学生准备 1、预习第二节-氮的循环 2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。重点说明氮循环中涉及到哪些含氮元素的物质,它们是如何转化的? (二)教师准备 1、教学媒体、课件; 2、补充实验。 五、教学方法 实验引导,学生观察、归纳。 六、课时安排 三课时 七、教学过程 第1课时 【复习】 1、碳酸钠、碳酸氢钠的化学性质; 2、C、CO、CO2;碳酸盐、碳酸氢盐的相互转化。 【提问】上次课后给大家布置了一项任务:查找氮循环的资料,小组合作画出氮循环图示,写出短文。重点说明氮循环中涉及到哪些含氮元素的物质,它们是如何转化的?下面,请各小组准备交流。 【小组交流】选取二个小组作为代表在课堂上交流,其他小组的成果课后以科技小报的形式展示或收录到成长档案袋中。 【点评评价】教师点评并做好表现性评价 【过渡】在氮循环中涉及到了较多重要的含氮元素的物质及其变化,下面我们一起来探讨这些物质的性质及转化。 【板书】1、氮气与氮的固定。 【讲述】 氮气是由氮原子构成的双原子分子,两个氮原子间共用三对电子,使每个原子都达到稳定结构。要破坏这种牢固的结合,需要很高的能量。故常温下,氮气的化学性质不活泼,很难与其它的物质发生反应。但在一定的条件下,氮气能与氧气、氢气等物质发生反应。 【演示实验】 在一个空矿泉水塑料瓶距瓶底10cm处,对称地钻两个小孔, 然后放在感应圈上,将感应圈的两根极针通过小孔插入瓶中,使 两根极针成一条直线,且针尖之间相距0.5cm(如图),接通电源, 观察实验现象。待矿泉水瓶中产生红棕色气体后,加入蒸馏水, 振荡,用蓝色石蕊试纸检验产生的溶液。 【结论】 在放电或高温的条件下,空气中的氮气能与氧气发生反应,生成一氧化氮,一氧化氮在空气中很不稳定,易被氧化成二氧化氮,二氧化氮与水反应生成硝酸。 【板书】 N2+O2 2NO (有毒、无色、难溶于水) 3 2NO+O2=2NO2 (有毒、红棕色、与水反应) 3NO2+H2O=2HNO3+NO <讨论>1、现给你一试管二氧化氮,其它药品和仪器自选,根据上述反应,请你设计实验,要求尽可能多的使二氧化氮被水吸收。 2、你的设计对工业上生产硝酸有什么启示?(从原料的充分利用,减少污染物的排放等方面考虑。) 【过渡】植物只能利用化合态的氮,除了闪电等自然方法外,能否用人工的方法把空气中的氮气转化为植物可吸收的含氮化合物呢?通过大量实验研究,科学家们发现在一定条件下,氮气和氢气可以直接化合生成氨。 【板书】 N2+3H2 2NH3 (可逆反应) 【讲述】像这样同时向正反两个方向进行的反应称为可逆反应。在可逆反应的化学方程式中用“ ”代替“=”。 人们把像这样使空气中游离态的氮转化为化合态的氮的方法叫做氮的固定。综上所述: 【板书】 氮的固定 【指导阅读】 阅读P74 -氨的合成。 【点评】目的让学生体会从实验室研究到工业生产的过程,感受化学与技术的关系。 【课堂小结】 学生自己概括·整合。 【课堂练习】 1、 氮的固定有三种途径:生物固氮、自然固氮和工业固氮。指出下列固氮方式各属于哪种类型。 (1) 闪电时氮气转化为一氧化氮。 (2) 豆科作物根瘤菌将氮气转化为化合态氮。 (3) 在高温、高压和催化剂作用下,氮气和氢气反应合成氨。 2、 雷鸣闪电是日常生活中司空见惯的现象。在闪电发生的过程中,空气中的氮气和氧气直接化合。假设某次雷电放出的能量为1.5107KJ。已知1molO2与1molN2化合时要吸收181KJ的能量,闪电时有1/1000的能量用于这一反应。 (1)此次闪电所产生的一氧化氮的物质的量是多少? (2)此次雷电的生成物相当于给土壤施加了多少千克的尿素[CO(NH2)2]化肥? 3查看更多