- 2021-08-23 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考考前45天大冲刺卷理综化学部分二(全国1卷)
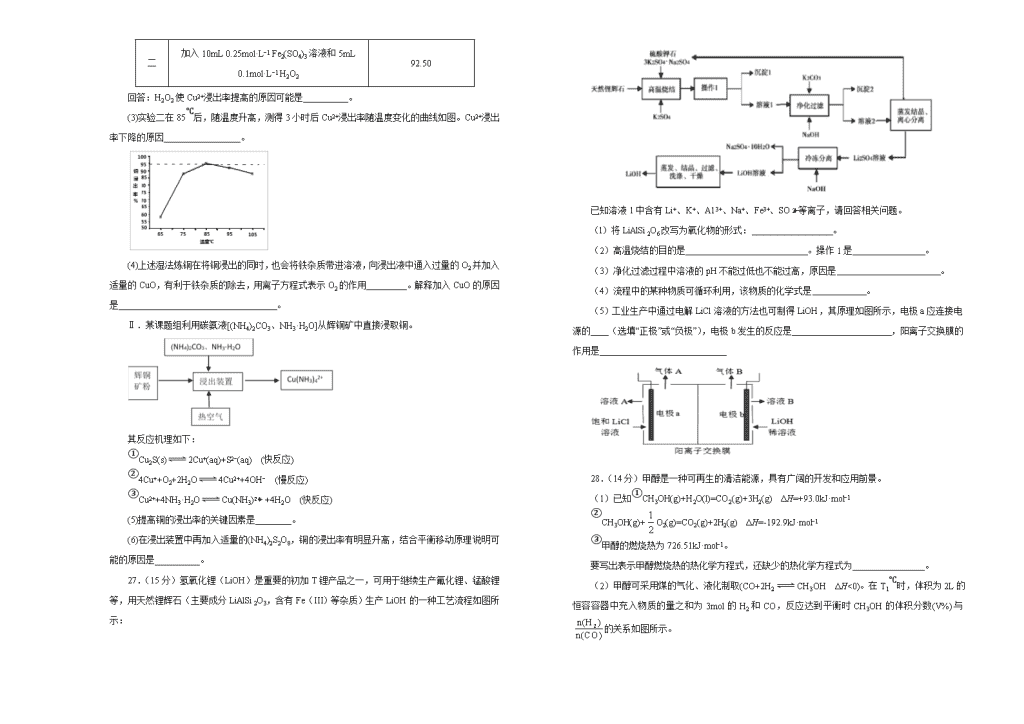
2020年高考考前45天大冲刺卷 理综化学部分(二) 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.考试结束后,请将本试题卷和答题卡一并上交。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 一、选择题(每题6分,共42分。) 7.春季复工、复学后,做好防护是控防新型冠状病毒传播的有效措施。下列说法正确的是 A.为减少直接吸入飞沫形成的气溶胶感染病毒的几率,就餐时人人间距至少应为1米 B.生产医用口罩的主要原料是聚丙烯(PP),分子式为(CH3CH=CH2)n C.95%的乙醇溶液、84消毒液可直接用作环境消毒剂 D.40%的甲醛溶液可做公共餐具消毒剂 8.下列有关化合物的说法正确的是 A.所有原子共平面 B.其能使酸性高锰酸钾溶液褪色 C.是苯的同系物 D.一氯代物有6种 9.下列实验操作能达到实验目的的是 选项 实验目的 实验操作 A 检验蛋白质 向待测液中滴入浓硝酸溶液,观察颜色变化 B 检验NH 向待测液中滴入氢氧化钠溶液,观察气泡 C 检验碳碳双键 向待测液中滴入酸性高锰酸钾溶液,观察颜色变化 D 检验K+ 用洁净的铂丝蘸取待测液,灼烧,直接观察火焰颜色 11.短周期元素X、Y、Z、W原子序数依次增大,Y与W同族。X、Y、Z三种原子最外层电子数的关系为X+Z=Y。电解Z与W形成的化合物的水溶液,产生W元素的气体单质,此气体同冷烧碱溶液作用,可得到化合物ZWX的溶液。下列说法正确的是 A.W的氢化物稳定性强于Y的氢化物 B.Z与其他三种元素分别形成的化合物中只含有离子键 C.Z与Y形成的化合物的水溶液呈碱性 D.对应的简单离子半径大小为W>Z>X>Y 12.用NaOH溶液吸收烟气中的SO2,将所得的吸收液用三室膜电解技术处理,原理如下图所示。下列说法错误的是 A.电极a为电解池阴极 B.阳极上有反应HSO-2e−+H2O=SO+3H+发生 C.当电路中通过1mol电子的电量时,理论上将产生0.5mol H2 D.处理后可得到较浓的H2SO4和NaHSO3产品 13.298K时,在0.10mol/L H2A溶液中滴入0.10mol/L NaOH溶液,滴定曲线如图所示。下列说法正确的是 A.该滴定过程应该选择石蕊作为指示剂 B.X点溶液中:c(H2A)+c(H+)=c(A2−)+2c(OH−) C.Y点溶液中:3c(Na+)=2c(A2−)+2c(HA−)+2c(H2A) D.0.01mol/L Na2A溶液的pH约为10.85 二、非选择题(共43分) 26.(14分)辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。 Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+: (1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。 (2)控制温度为85℃、浸取剂的pH=1,取相同质量的辉铜矿粉末分别进行如下实验: 实验 试剂及操作 3小时后Cu2+浸出率(%) 一 加入10mL 0.25mol·L−1 Fe2(SO4)3溶液和5mL水 81.90 二 加入10mL 0.25mol·L−1 Fe2(SO4)3溶液和5mL 0.1mol·L−1 H2O2 92.50 回答:H2O2使Cu2+浸出率提高的原因可能是__________。 (3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。 (4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是 。 Ⅱ.某课题组利用碳氨液[(NH4)2CO3、NH3·H2O]从辉铜矿中直接浸取铜。 其反应机理如下: ①Cu2S(s)2Cu+(aq)+S2−(aq) (快反应) ②4Cu++O2+2H2O4Cu2++4OH− (慢反应) ③Cu2++4NH3·H2OCu(NH3)+4H2O (快反应) (5)提高铜的浸出率的关键因素是________。 (6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。 27.(15分)氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAlSi2O3,含有Fe(III)等杂质)生产LiOH的一种工艺流程如图所示: 已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO等离子,请回答相关问题。 (l)将LiAlSi2O6改写为氧化物的形式: 。 (2)高温烧结的目的是 。操作1是 。 (3)净化过滤过程中溶液的pH不能过低也不能过高,原因是 。 (4)流程中的某种物质可循环利用,该物质的化学式是 。 (5)工业生产中通过电解LiCl溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ,阳离子交换膜的作用是 28.(14分)甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。 (1)已知①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol−1 ②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol−1 ③甲醇的燃烧热为726.51kJ·mol−1。 要写出表示甲醇燃烧热的热化学方程式,还缺少的热化学方程式为________________。 (2)甲醇可采用煤的气化、液化制取(CO+2H2CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与的关系如图所示。 ①当起始=2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1mol·L−1·min−1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达*到平衡时CO的体积分数可能是____(填标号) A.< B.= C.~ D.= E.> ②当=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点(选填“D”、“E”或“F”)。 (3)制甲醇的CO和H2可用天然气来制取:CO2(g)+CH4(g)2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol·L−1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH____(选填“大于”“小于”或“等于”)0。压强p1_____(选填“大于”或“小于”)p2。当压强为p2时,在y点:v(正)____(选填“大于”“小于”或“等于”)v(逆)。若p2=6Mpa,则T℃时该反应的平衡常数Kp=___MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 (4) 研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g) [反应Ⅰ] ①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最高的反应所用的催化剂是____(填“A”、“B”或“C”)。 ②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应CO2(g)+H2(g)CO(g)+ H2O(g)[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据: T(K) CO2实际转化率(%) 甲醇选择性(%) 543 12.3 42.3 553 15.3 39.1 注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。 表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_________。 三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。) 35. 【化学——选修3:物质结构与性质】(15分) 镍及其化合物是重要的合金材料和催化剂。请回答下列问题: (1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。 (2)镍能形成多种配合物如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2−、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有__________ A.CO与CN−互为等电子体,其中CO分子内σ键和π键个数之比为1∶2 B.NH3的空间构型为平面三角形 C.Ni2+在形成配合物时,其配位数只能为4 D.Ni(CO)4和[Ni(CN)4]2−中,镍元素均是sp3杂化 (3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“•••”分别表示出配位键和氢键。 (4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表: NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。 (5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“”)和四面体空隙(“”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。 ①LaNix合金中x的值为_____; ②晶胞中和“”同类的八面体空隙有___个,和“”同类的四面体空隙有___个。 36. 【化学---选修5:有机化学基础】(15分) 氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以A为原料合成该药物的路线如图: (1)A的化学名称是 ,C中的官能团除了氯原子,其他官能团名称为 。 (2)A分子中最少有 原子共面。 (3)C生成D的反应类型为 。 (4)A与新制Cu(OH)2反应的化学方程式为 。 (5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有 种。 ①除苯环之外无其他环状结构 ②能发生银镜反应 ③苯环上有只有两个取代基 其中核磁共振氢谱中有4个吸收峰,且峰值比为2∶2∶2∶1的结构简式为 。 (6)已知:,写出以苯甲醇为有机原料制备化合物的合成路线(无机试剂任选) 。 2020年高考考前45天大冲刺卷 参考答案 7. 【答案】A 8. 【答案】B 9. 【答案】A 10. 【答案】B 11. 【答案】C 12. 【答案】D 13. 【答案】D 26. 【答案】(1)Cu2S+4Fe3+=2Cu2++S↓+4Fe2+ (2) H2O2把生成Fe2+又氧化为Fe3+,Fe3+的浓度增大,反应速率加快 (3) 温度升高,H2O2发生了分解 (4) 4Fe2++O2+4H+=4Fe3++2H2O 由于浸取剂的pH=1,加入适量的CuO,不引入其它杂质离子,消耗H+有利于控制溶液pH,使Fe3+形成Fe(OH)3沉淀 (5) 提高慢反应的速率,即提高Cu+的氧化速率 (6) S2O的氧化性比O2强,使慢反应的速率加快,促使Cu2S沉淀溶解平衡正向移动,同时(NH4)2S2O8电离产生NH,NH与慢反应产生的OH−结合,c(OH−)的浓度降低,有利于慢反应及Cu2S沉淀溶解平衡正向移动 27. 【答案】(1)Li2O·Al2O3·4SiO2 (2) 将锂辉石转化为可溶性硫酸盐,与杂质分离 溶解、过滤 (3) pH过低Al3+和Fe3+不能完全除去,pH过高会使生成的Al(OH)3部分溶解 (4) 3K2SO4·Na2SO4 (5) 正极 2H2O+2e−=H2↑+2OH− 可以防止OH−进入左室与Cl2反应,还可以让更多的Li+进入右室得到高浓度的LiOH 28. 【答案】(1)CH3OH(g)=CH3OH(l) ΔH=−38.19kJ/mol (2)50% C D (3) 大于 小于 大于 16 (4) C 升高温度,反应Ⅰ、Ⅱ的反应速率均加快,但反应Ⅱ的反应速率变化更大 35. 【答案】(1)3d84s2 5 (2) A (3) (4) 6 离子所带电荷数越高,离子半径越小,则晶格能越大,熔点越高 (5) 5 3 6 36. 【答案】(1)邻氯苯甲醛(2-氯苯甲醛) 氨基、羧基 (2)12 (3) 取代反应(或酯化反应) (4) +2Cu(OH)2+NaOHCu2O↓+3H2O+ (5) 6 、 (6) 。查看更多