- 2021-08-23 发布 |
- 37.5 KB |
- 77页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习物质结构与性质课件(77张)(全国通用)
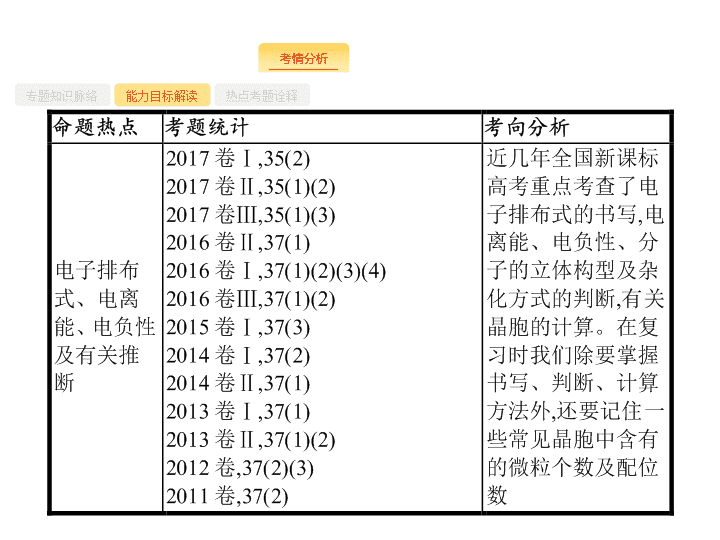
第 2 讲 物质结构与性质 ( 选修 ) - 2 - 专题知识脉络 能力目标解读 热点考题诠释 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 - 5 - 专题知识脉络 能力目标解读 热点考题诠释 - 6 - 专题知识脉络 能力目标解读 热点考题诠释 1 .(2017 全国 Ⅰ ) 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题 : (1) 元素 K 的焰色反应呈紫红色 , 其中紫色对应的辐射波长为 nm( 填标号 ) 。 A.404.4 B.553.5 C.589.2 D.670.8 E.766.5 (2) 基态 K 原子中 , 核外电子占据最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为 。 K 和 Cr 属于同一周期 , 且核外最外层电子构型相同 , 但金属 K 的熔点、沸点等都比金属 Cr 低 , 原因是 。 - 7 - 专题知识脉络 能力目标解读 热点考题诠释 (4)KIO 3 晶体是一种性能良好的非线性光学材料 , 具有钙钛矿型的立方结构 , 边长为 a =0.446 nm, 晶胞中 K 、 I 、 O 分别处于顶角、体心、面心位置 , 如图所示。 K 与 O 间的最短距离为 nm, 与 K 紧邻的 O 个数为 。 (5) 在 KIO 3 晶胞结构的另一种表示中 ,I 处于各顶角位置 , 则 K 处于 位置 ,O 处于 位置。 - 8 - 专题知识脉络 能力目标解读 热点考题诠释 答案 (1)A (2)N 球形 K 原子半径较大且价电子数较少 , 金属键较弱 (3)V 形 sp 3 (4)0.315 12 (5) 体心 棱心 解题要领 (1) 紫色光波长范围是 400~430 nm, 故选 A 。 (2)K 原子的核外电子排布式为 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 , 故核外电子占据的最高能层是第 4 层 , 符号是 N, 占据该能层电子的能级为 4s, 电子云轮廓图为球形。 K 的价层电子排布为 4s 1 ,Cr 的价层电子排布为 3d 5 4s 1 ,K 的价层电子数较少 ;K 的原子半径较 Cr 的大 , 故 K 的金属键较 Cr 的弱 , 熔、沸点较 Cr 的低。 - 9 - 专题知识脉络 能力目标解读 热点考题诠释 (5) 若 I 处于各顶角位置 , 则晶胞结构图为 故 K 在体心 ,O 在棱心。 - 10 - 专题知识脉络 能力目标解读 热点考题诠释 2 .(2016 全国 Ⅰ ) 锗 (Ge) 是典型的半导体元素 , 在电子、材料等领域应用广泛。回答下列问题 : (1) 基态 Ge 原子的核外电子排布式为 [Ar] , 有 个未成对电子。 (2)Ge 与 C 是同族元素 ,C 原子之间可以形成双键、叁键 , 但 Ge 原子之间难以形成双键或叁键。从原子结构角度分析 , 原因是 。 (3) 比较下列锗卤化物的熔点和沸点 , 分析其变化规律及原因 。 - 11 - 专题知识脉络 能力目标解读 热点考题诠释 (4) 光催化还原 CO 2 制备 CH 4 反应中 , 带状纳米 Zn 2 GeO 4 是该反应的良好催化剂。 Zn 、 Ge 、 O 电负性由大至小的顺序是 。 (5)Ge 单晶具有金刚石型结构 , 其中 Ge 原子的杂化方式为 , 微粒之间存在的作用力是 。 (6) 晶胞有两个基本要素 : 则 D 原子的坐标参数为 。 - 12 - 专题知识脉络 能力目标解读 热点考题诠释 ② 晶胞参数 , 描述晶胞的大小和形状。已知 Ge 单晶的晶胞参数 a =565.76 pm, 其密度为 g·cm -3 ( 列出计算式即可 ) 。 - 13 - 专题知识脉络 能力目标解读 热点考题诠释 解题要领 (1)Ge 是第四周期 Ⅳ A 族元素 , 是 32 号元素 , 电子排布式为 [Ar]3d 10 4s 2 4p 2 ,2 个 4p 电子分别位于 2 个不同轨道上 , 故有 2 个未成对电子。 (2)Ge 的原子半径比 C 大 , 原子间形成 σ 单键较长 ,p - p 轨道肩并肩重叠程度很小或几乎不能重叠 , 难以形成 “ 肩并肩 ” 重叠方式的 π 键。 (3) 锗卤化物均为分子晶体 , 对于组成和结构相似的分子晶体 , 相对分子质量越大 , 分子间作用力越大 , 熔沸点越高。 (4) 元素的非金属性越强 , 吸引电子能力就越强 , 则电负性越强 , 电负性由大到小的顺序为 O>Ge>Zn 。 (5) 金刚石中 C 为 sp 3 杂化 ,C 与 C 之间为非极性共价键 ,Ge 单晶与金刚石结构相似 , 杂化方式与存在的作用力也与金刚石一样。 - 14 - 专题知识脉络 能力目标解读 热点考题诠释 - 15 - 热点一 热点二 热点三 热点四 原子结构 有关原子结构的思维路径 - 16 - 热点一 热点二 热点三 热点四 问题探究 1 . 核外电子排布的表示方法有哪些 ? (1) 电子排布式 如 Cr:1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 (2) 简化电子排布式 如 Cu:[Ar]3d 10 4s 1 (3) 价电子排布式 如 Fe:3d 6 4s 2 (4) 电子排布图 ( 或轨道表示式 ) - 17 - 热点一 热点二 热点三 热点四 2 . 元素的第一电离能和电负性有怎样的递变规律 ? 分别有什么应用 ? (1) 递变规律 : 在元素周期表中 , 元素的第一电离能从左到右呈增大趋势 ( 注意第 Ⅱ A 族、第 ⅤA 族元素的第一电离能大于同周期相邻元素 ), 从上到下逐渐减小 ; 元素的电负性从左到右逐渐增大 , 从上到下逐渐减小。 (2) 应用 : 元素的第一电离能可用于 : ① 判断元素金属性的强弱 : 电离能越小 , 金属越容易失去电子 , 金属性越强 ; 反之越弱。 ② 判断元素的化合价 ( I 1 、 I 2 …… 表示各级电离能 ): 如果某元素的 I n+ 1 ≫ I n , 则该元素的常见化合价为 + n 。如钠元素 I 2 ≫ I 1 , 所以钠元素的化合价为 +1 价。 元素的电负性可用于 : ① 判断金属性与非金属性的强弱 ; ② 判断元素在化合物中的化合价 ( 正或负 ); ③ 判断化学键的类型。 - 18 - 热点一 热点二 热点三 热点四 例 1 铁和铜都是日常生活中常见的金属 , 有着广泛的用途。请回答下列问题 : (1) 铁在元素周期表中的位置为 。 (2)K 3 [Fe(CN) 6 ] 溶液可用于检验 ( 填离子符号 ), 该离子的核外电子排布 式 为 ;C 、 N 、 O 三元素的第一电离能由大到小的顺序为 ( 用元素符号表示 ) 。 (3) 基态铜原子的价层电子排布式为 。 (4) 已知某元素 M 与铜能形成化合物 , 且 M 和铜的电负性分别为 3.0 和 1.9, 则 M 与铜形成的化合物属于 ( 填 “ 离子 ” 或 “ 共价 ”) 化合物。 - 19 - 热点一 热点二 热点三 热点四 分析推理 (1) 由原子序数怎样确定元素在周期表中的位置 ? 原子序数 <18 时 , 直接根据原子结构示意图确定元素所在的周期和族 ; 原子序数 >18 时 , 一般常用 “0 族定位法 ”, 其关键在于 : ① 熟记各周期 0 族元素的原子序数 :2 、 10 、 18 、 36 、 54 、 86 等 ; ② 掌握周期表中每纵行对应的族序数。如 26 Fe,26-18=8, 则 Fe 在第四周期第 Ⅷ 族 ( 第 8 纵行对应第 Ⅷ 族 ) 。 - 20 - 热点一 热点二 热点三 热点四 (2) 由原子序数怎样书写电子排布式 ? 原子序数 <18 时 , 直接根据构造原理书写 , 如 16 S,1s 2 2s 2 2p 6 3s 2 3p 4 。原子序数 >18 时 , 如第四周期元素 , 用原子序数 -18 就是其外围电子数 , 然后将外围电子数依次填入能级即可。如 28 Ni,28-18=10, 则 Ni 的电子排布式为 [Ar]3d 8 4s 2 。注意 : ① 能级交错 ( 先排 4s, 再排 3d); ② 24 Cr 及 29 Cu 的外围电子排布特殊 ( 能量相同的原子轨道在全满、半满和全空状态时 , 体系的能量最低 ), 分别为 3d 5 4s 1 、 3d 10 4s 1 。 ③ 电子填充时先排 4s 再排 3d; 书写时先写 3d 再写 4s; 失电子时 , 先失 4s 再失 3d 。 - 21 - 热点一 热点二 热点三 热点四 (3) 判断元素的第一电离能、电负性应注意哪些事项 ? 均根据其在元素周期表中的递变规律判断。第一电离能递变规律 : 同周期从左至右呈增大趋势 , 但当原子轨道呈全满、半满、全空状态时 , 第一电离能反常 , 即第 Ⅱ A 族、第 Ⅴ A 族元素的第一电离能分别大于同周期相邻元素 ; 同主族从上至下逐渐减小。电负性递变规律 : 从左到右逐渐增大 , 从上到下逐渐减小。 (4) 怎样根据电负性判断化学键类型 ? 通常是根据电负性的差值来判断化学键的类型 , 进而判断化合物的类型 , 一般电负性差值较大的元素原子间形成的化学键主要是离子键 , 差值小的则主要形成共价键。如 Cu 、 Cl 两元素的电负性分别为 1.9 和 3.0, 则两元素原子间形成共价键 ( 一般差值大于 1.7 时形成离子键 ), 化合物类型为共价化合物。注意利用电负性的差值判断化学键类型只是一般规律 , 不是绝对的。 - 22 - 热点一 热点二 热点三 热点四 答案 (1) 第四周期第 Ⅷ 族 (2)Fe 2+ [Ar]3d 6 或 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 N>O>C (3)3d 10 4s 1 (4) 共价 评分细则警示 (2) 写成 N O C 或 I (N)> I (O)> I (C) 均给分。 - 23 - 热点一 热点二 热点三 热点四 对点训练 1 元素 A 的基态原子占据哑铃形原子轨道的电子总数为 2, 元素 B 与 A 同周期 , 其基态原子占据 s 轨道的电子数与 p 轨道相同 ;C 是 A 的同族相邻元素 ;D 是 B 的同族相邻元素。则 : (1)D 原子核外 L 层电子的排布式为 ;C 的核外电子排布式为 ;B 的基态原子未成对电子数为 个。 (2) 已知 A 与 D 形成的化合物中 A 、 D 之间的共用电子对偏向 D, 则 A 、 B 、 C 、 D 元素的电负性由大到小的顺序为 ;A 、 B 、 C 第一电离能由大到小的顺序为 。 - 24 - 热点一 热点二 热点三 热点四 答案 (1)2s 2 2p 6 1s 2 2s 2 2p 6 3s 2 3p 2 2 (2)O>S>C>Si O>C>Si 解析 哑铃形是 p 轨道且电子总数为 2,A 原子的电子排布式为 1s 2 2s 2 2p 2 , 为碳元素 ;B 原子的电子排布式为 1s 2 2s 2 2p 4 , 为氧元素 ;C 、 D 分别为 Si 、 S; 由 C 、 S 之间的共用电子对偏向 S 可知 S 的电负性大于 C 。 - 25 - 热点一 热点二 热点三 热点四 两大理论与分子的立体构型 有关推测或解释分子立体构型的思维路径 - 26 - 热点一 热点二 热点三 热点四 问题探究 1 . 如何用价层电子对互斥理论推测分子的立体构型 ? (1) 判断分子中中心原子上的价层电子对数 : 其中 : a 为中心原子的价电子数 ( 阳离子要减去电荷数、阴离子要加上电荷数 ), x 是与中心原子结合的原子数 , b 为与中心原子结合的原子最多能接受的电子数。如 , 中心原子为 S, σ 键电子对数为 4, 孤电子对数 =(6+2-4×2) ÷ 2=0, 则价层电子对数为 4+0=4 。 - 27 - 热点一 热点二 热点三 热点四 (2) 价层电子对互斥理论与分子构型 : - 28 - 热点一 热点二 热点三 热点四 2 . 如何用杂化轨道理论解释分子的立体构型 ? - 29 - 热点一 热点二 热点三 热点四 3 . 如何判断中心原子的杂化类型 ? (1) 根据杂化轨道数判断 : 杂化轨道数 = 中心原子的孤电子对数 + 中心原子的 σ 键个数 - 30 - 热点一 热点二 热点三 热点四 (2) 根据分子的立体构型判断 : (3) 根据中心原子的成键类型判断 : 如果中心原子形成一个三键 , 则为 sp 杂化 ; 如果形成一个双键 , 则为 sp 2 杂化 ; 如果全部是单键 , 则为 sp 3 杂化。 - 31 - 热点一 热点二 热点三 热点四 - 32 - 热点一 热点二 热点三 热点四 (3)NH 3 极易溶于水 , 其立体构型为 , 试判断 NH 3 溶于水后 , 形成 NH 3 ·H 2 O 的合理结构 : ( 填字母代号 ), 推理依据是 。 - 33 - 热点一 热点二 热点三 热点四 分析推理 (1) 怎样比较键角大小 ? 当中心原子杂化类型相同时 , 与成键电子对间的排斥相比 , 孤对电子对成键电子对有更大的排斥作用 , 因此有孤对电子会使键角变小 , 孤对电子越多 , 键角越小。 - 34 - 热点一 热点二 热点三 热点四 (2) 怎样判断分子的极性 ? 根据键的极性和分子立体构型共同判断 :a. 完全由非极性键结合而成的分子是非极性分子 (O 3 除外 );b. 由极性键结合而成的完全对称性分子为非极性分子 , 非对称性分子是极性分子。 根据经验规律判断 : 对于 AB n 型分子 , 若中心原子 A 的化合价的绝对值等于该元素原子的最外层电子数 , 则为非极性分子 , 否则为极性分子。 - 35 - 热点一 热点二 热点三 热点四 答案 (1) ②③⑤ ①④ 非极性 (2) ① sp 和 sp 2 三角锥形 大于 ② sp 3 杂化 极性 (3) 三角锥形 b NH 3 ·H 2 O 电离生成铵根离子和氢氧根离子 评分细则警示 ( 2) ① “ 大于 ” 写成 “>” 不得分。 - 36 - 热点一 热点二 热点三 热点四 对点训练 2 第二周期中碳、氮、氧是构成生命物质的三种主要元素 , 在生产生活中也有着重要的应用。 (1) 第二周期中 , 第一电离能处于 B 与 N 之间的元素有 种。 (2)BF 3 与一定量水形成 (H 2 O) 2 ·BF 3 晶体 Q,Q 在一定条件下可转化为 R: ① BF 3 属于 分子 ( 填 “ 极性 ” 或 “ 非极性 ”); ② R 中阳离子的立体构型为 , 阴离子的中心原子轨道采用 杂化 ; - 37 - 热点一 热点二 热点三 热点四 ③ H 3 O + 中 H—O—H 键角比 H 2 O 中 H—O—H 键角大 , 原因是 。 (3) 乙烯酮 ( ) 是一种重要的有机中间体 , 乙烯酮分子中碳原子杂化轨道类型有 。 答案 (1)3 (2) ① 非极性 ② 三角锥形 sp 3 ③ H 2 O 分子中氧原子有两对孤电子对 ,H 3 O + 中氧原子只有一对孤电子对 , 排斥力较小 (3)sp 2 和 sp - 38 - 热点一 热点二 热点三 热点四 解析 (1) 根据电离能的变化规律 ,2p 能级半充满的氮原子和 2s 能级全充满 2p 能级全空的铍原子第一电离能要比同周期相邻原子高 , 故第一电离能介于 B 、 N 之间的第二周期元素有 Be 、 C 、 O 三种元素。 (2) ① BF 3 分子立体构型为平面正三角形 , 是由极性键结合而成的完全对称性分子 , 属于非极性分子 ; ② H 3 O + 中氧原子杂化轨道类型为 sp 3 , 但氧原子上有一对孤对电子 , 所以立体构型为三角锥形 , 阴离子中 B 原子的价层电子对数为 4, 杂化轨道类型为 sp 3 ; ③ H 2 O 和 H 3 O + 中中心原子 O 的杂化类型均为 sp 3 , 但氧原子的孤电子对数不同 ,H 2 O 中有两对孤电子对 ,H 3 O + 中只有一对 , 排斥力较小。 (3) 第一个 C 形成一个双键 , 杂化类型为 sp 2 , 第二个 C 形成两个双键 ( 相当于一个三键 ), 杂化类型为 sp 。 - 39 - 热点一 热点二 热点三 热点四 粒子间作用与分子的性质 有关分子性质的思维路径 - 40 - 热点一 热点二 热点三 热点四 问题探究 1 . 共价键、范德华力、氢键对物质性质有哪些影响 ? - 41 - 热点一 热点二 热点三 热点四 - 42 - 热点一 热点二 热点三 热点四 2 . 分子具有哪些性质 , 有怎样的规律 ? (1) 溶解性 : 依据 “ 相似相溶 ” 的规律 , 非极性溶质一般能溶于非极性溶剂 , 极性溶质一般能溶于极性溶剂。若存在氢键 , 则溶剂和溶质之间的氢键作用力越大 , 溶解性越好。 “ 相似相溶 ” 还适用于分子结构的相似性 , 如乙醇和水互溶 (C 2 H 5 OH 和 H 2 O 中的羟基相近 ), 而戊醇在水中的溶解度明显减小。 (2) 手性 : 具有完全相同的组成和原子排列的一对分子 , 如同左手与右手一样 , 镜面对称 , 却在三维空间里不能重叠 , 互称手性异构体 , 具有手性异构体的分子叫手性分子。 (3) 无机含氧酸分子的酸性 : 无机含氧酸可写成 (HO) m RO n , 如果成酸元素 R 相同 , 则非羟基氧原子数 n 越大 , 酸性越强 , 如 HClO查看更多