2021版江苏新高考选考化学(苏教版)一轮复习课后达标检测:专题7 1 第一单元 化学反应速率
一、单项选择题
1.下列说法正确的是( )
①参加反应的物质的性质是影响化学反应速率的主要因素 ②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
A.①② B.②③
C.③④ D.①④
解析:选A。影响化学反应速率的主要因素是参加反应的物质的性质,①正确,③错误;影响化学反应速率的外因包括浓度、温度、催化剂、压强和其他一些条件(如光等),②正确;加压对没有气体参加的反应的速率无影响,④错误。
2.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
解析:选C。反应速率之比等于化学方程式的化学计量数之比,A项,v(W)=v(Z);B项,3v(X)=2v(Z);D项,2v(W)=3v(X)。
3.反应2SO2+O22SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
A.0.1 s B.2.5 s
C.5 s D.10 s
解析:选C。因为SO3的浓度增加了0.4 mol·L-1,所以O2的浓度必定减少了0.2 mol·L-1,因为在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,所以反应经过的时间为=5 s。
4.已知某化学实验的结果如下表:
实验
序号
反应物
在相同温度下测得的反应速率v/(mol·L-1·min-1)
大小相同
的金属片
酸溶液
1
镁
1 mol·L-1盐酸
v1
2
铁
1 mol·L-1盐酸
v2
3
铁
0.1 mol·L-1盐酸
v3
下列结论正确的是( )
A.v1>v2>v3 B.v3>v2>v1
C.v1>v3>v2 D.v2>v3>v1
解析:选A。影响化学反应速率的主要因素是反应物自身的性质,由于镁的活动性比铁强,所以与相同浓度的盐酸反应时,镁放出氢气的速率快,故v1>v2;反应物浓度也影响反应速率,在一定范围内,反应速率与反应物浓度成正比,故v2>v3。
5.一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)2NH3(g),反应过程如图。下列说法正确的是( )
A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间的变化关系
C.0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D.10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
解析:选B。t1时没有达到平衡状态,正、逆反应速率不相等,A项错误;根据图像,X的物质的量增加,属于生成物,因此X为NH3的物质的量随时间的变化关系的曲线,B项正确;0~8 min,v(NH3)==0.007 5 mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,v(H2)==0.011 25 mol·L-1·min-1,C项错误;10~12 min,v(NH3)==0.005 mol·L-1·min-1,v(N2)==0.002 5 mol·L-1·min-1,D项错误。
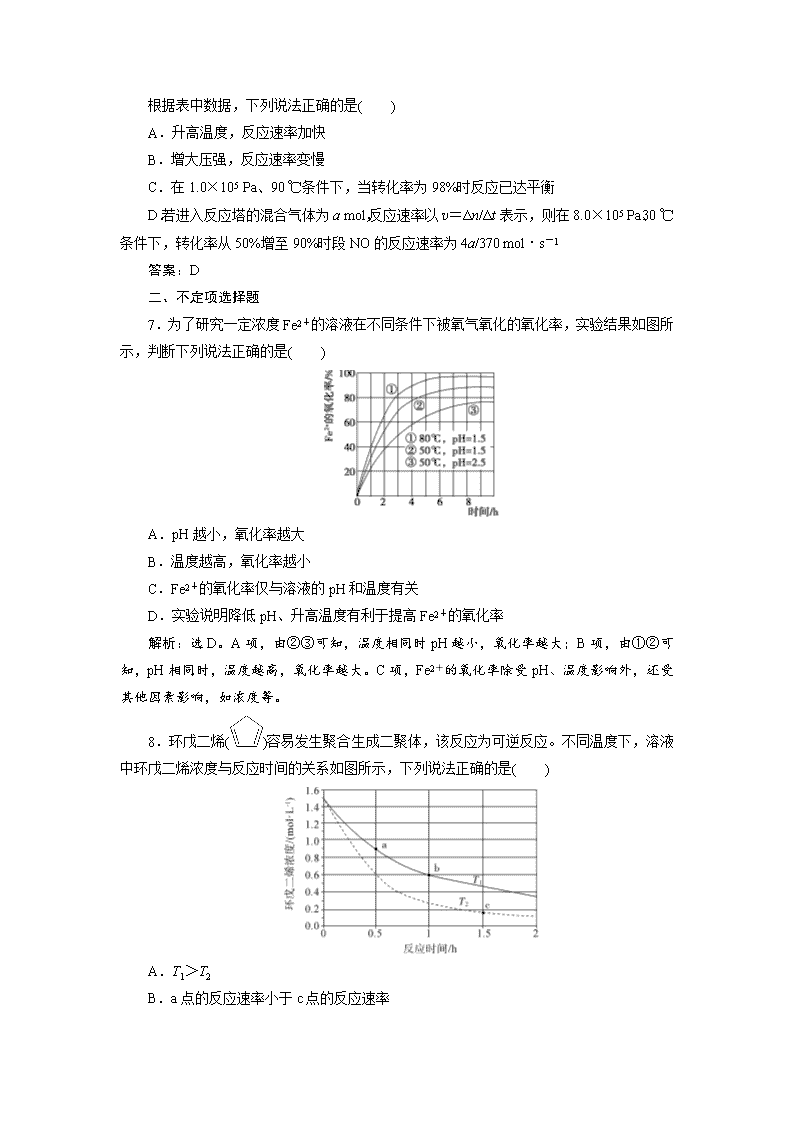
6.(2018·浙江4月选考)某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为 0.10 和0.06,发生化学反应2NO(g)+O2(g)===2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/
(×105 Pa)
温度
/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2 830
90
25
510
5 760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据,下列说法正确的是( )
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在1.0×105 Pa、90 ℃条件下,当转化率为98%时反应已达平衡
D.若进入反应塔的混合气体为a mol,反应速率以v=Δn/Δt表示,则在8.0×105 Pa、30 ℃条件下,转化率从50%增至90%时段NO的反应速率为4a/370 mol·s-1
答案:D
二、不定项选择题
7.为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法正确的是( )
A.pH越小,氧化率越大
B.温度越高,氧化率越小
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率
解析:选D。A项,由②③可知,温度相同时pH越小,氧化率越大;B项,由①②可知,pH相同时,温度越高,氧化率越大。C项,Fe2+的氧化率除受pH、温度影响外,还受其他因素影响,如浓度等。
8.环戊二烯()容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
解析:选CD。由相同时间内,环戊二烯浓度减小量越大,反应速率越快可知,T1
0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确的是( )
A.曲线a表示NO2的物质的量随时间的变化
B.10 s时,v(正)=v(逆)
C.20 s时反应达到平衡
D.0~20 s内平均反应速率 v(O2)=0.05 mol·L-1·s-1
解析:选BD。由图可知曲线b表示反应物N2O5的物质的量随时间的变化,20 s内物质的量减少2.0 mol,在同一时间段内,曲线a物质的量增加4.0 mol,曲线a表示NO2的物质的量随时间的变化,A正确。20 s后反应物和生成物的浓度不再发生变化,说明达到平衡,前20 s是平衡向正反应方向进行的过程,则v(正)>v(逆),B错误,C正确。0~20 s内,v(N2O5)==0.05 mol·L-1·s-1,则v (O2)=v(N2O5)=0.025 mol·L-1·s-1,D错误。
三、非选择题
10.一定温度下,向1.0 L密闭容器中加入0.60 mol X(g),发生反应X(g)Y(s)+2Z(g) ΔH>0,测得反应物X浓度与反应时间的数据如下表:
反应时间
t/min
0
1
2
3
4
6
8
c(X)/
(mol·L-1)
0.60
0.42
0.30
0.21
0.15
a
0.037 5
(1)0~3 min内用Z表示的平均反应速率v(Z)=______。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是______________________
__________________________________________________。
由此规律推出反应在6 min时反应物的浓度a为______ mol·L-1。
(3)反应的逆反应速率随时间变化的关系如图所示,t2时改变的条件可能是____________或____________。
解析:(1)0~3 min内Δc(X)=0.39 mol·L-1,v(X)==0.13 mol·L-1·min-1,而v(Z)=2v(X)=0.26 mol·L-1·min-1。(2)根据题中数据,可知每间隔2 min,X的浓度减少为原来的一半;由此规律推出反应在6 min 时反应物的浓度a为0.075 mol·L-1。(3)t2时刻,v(逆)瞬间增大,可能改变的条件为加入生成物Z或增大体系的压强。
答案:(1)0.26 mol·L-1·min-1
(2)每间隔2 min,X的浓度减少为原来的一半 0.075
(3)加入Z 增大体系的压强
11.2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示____________、____________,E的大小对该反应的反应热有无影响?__________(填“有”或“没有”)。该反应通常用V2O5做催化剂,加V2O5会使图中B点升高还是降低?________,理由是
________________________________________________________________________
________________________________________________________________________。
(2)图中ΔH=________kJ·mol-1。
(3)V2O5的催化循环机理可能为V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:______________
________________________________________________________________________。
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=________mol·L-1·min-1、v(SO3)=________mol·L-1·min-1。
解析:(2)图中表示的是2 mol SO2参加反应的能量变化,因此ΔH=-99×2 kJ·mol-1;(4)依据反应速率之比等于化学计量数之比来计算。
答案:(1)反应物能量 生成物能量 没有 降低
催化剂改变了反应的历程,使活化能E降低 (2)-198
(3)SO2+V2O5===SO3+2VO2、4VO2+O2===2V2O5 (4)0.025 0.05
12.碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O+2I-===2SO+I2(慢)
I2+2S2O===2I-+S4O(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的__________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O与加入的S2O的物质的量需满足的关系为n(S2O)∶n(S2O)________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号
体积V/mL
K2S2O8溶液
水
KI溶液
Na2S2O3溶液
淀粉溶液
①
10.0
0.0
4.0
4.0
2.0
②
9.0
1.0
4.0
4.0
2.0
③
8.0
Vx
4.0
4.0
2.0
表中Vx=__________mL,理由是______________________________________
________________________________________________________________________。
(3)已知某条件下,浓度c(S2O)~反应时间t的变化曲线如图,若保持其他条件不变,请分别画出降低反应温度和加入催化剂时,c(S2O)~t的变化曲线示意图(进行相应的标注)。
解析:(1)为保证能观察到溶液的颜色改变,必须最后有I2剩余,即Na2S2O3必须耗尽,第②个反应不能发生。由两个反应的计量数关系知n(S2O)∶n(S2O)=2∶1 时,I2恰好反应完全,为保证有I2剩余,必须减少S2O的物质的量,故n(S2O)∶n(S2O)<2。
(2)探究中为保证三组实验溶液总体积均相等,Vx=2.0。
(3)两个反应均不可逆,温度改变、加入催化剂只影响反应时间。
答案:(1)S2O <2
(2)2.0 保持溶液总体积相同,仅改变S2O的浓度而其他物质浓度不变
(3)
13.某同学分析Zn与稀H2SO4的反应。
(1)制H2时,用稀硫酸而不用浓硫酸,原因是_________________________________
________________________________________________________________________。
(2)该同学用如图装置进行实验,分析影响反应速率的因素。
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K)
34
59
86
117
…
102
1分钟水滴数(闭合K)
58
81
112
139
…
78
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率________(填“快”或“慢”),主要原因是___________________________________
________________________________________________________________________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是__________________________。
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
答案:(1)浓H2SO4具有强氧化性,与Zn反应不能生成氢气
(2)①快 闭合K时,装置A中形成原电池,反应速率加快 ②断开K时溶液中的c(H+)大于闭合K时溶液中的c(H+) ③断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快