- 2021-08-23 发布 |
- 37.5 KB |
- 48页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习对2018年北京市高考化学第27题的分析与思考课件(共48张PPT)
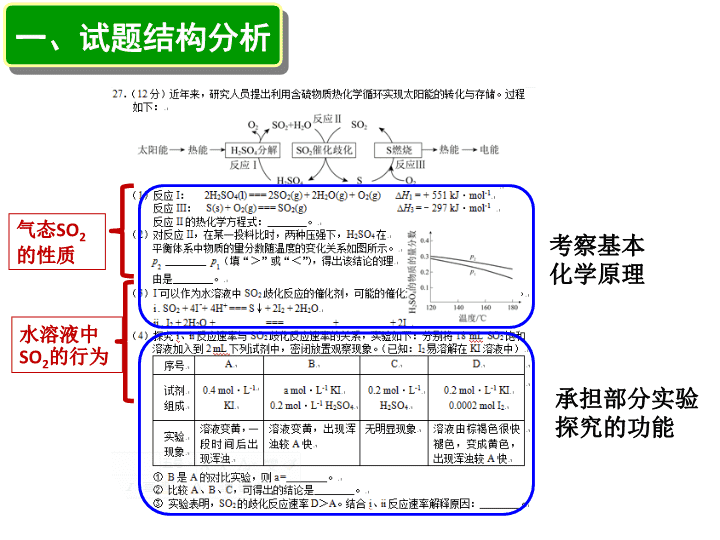
对 2018 年北京市高考化学第 27 题的分析与思考 内容 一 、试题结构 二、考点解析 三 、试题评价 四、教学启示 一、试题结构分析 气态 SO 2 的性质 水溶液中 SO 2 的行为 承担部分实验探究的功能 考察基本化学原理 4 个小题 (1) 、 (3) 考查方程式书写,均为 氧化还原反应 ,分别是基于流程图的 热化学方程式 、基于催化剂概念的 离子反应 (2) 考查 平衡移动原理 (4) 考查实验设计和实验探究 ① 控制变量 在实验设计中的运用 ②提取 表格 中的 关键信息 (物质种类和浓度,反应现象,反应速率), 推实验结论 ③根据 实验现象解释原因 答案: 3SO 2 (g) + 2H 2 O(g) === 2H 2 SO 4 (l) + S(s) △ H 2 = -254 kJ · mol -1 二、考点解析 反应 I : 2H 2 SO 4 (l) == 2SO 2 (g) + 2H 2 O(g) + O 2 (g) △ H 1 = + 551 kJ · mol -1 反应 III : S(s) + O 2 (g) == SO 2 (g) △ H 3 = - 297 kJ · mol -1 反应 Ⅱ : 3SO 2 (g) + 2H 2 O(g) == 2H 2 SO 4 (l) + S(s) △ H 2 = -254 kJ · mol -1 三个方程式相加: 所有物质抵消,从而实现了物质的循环利用和能量的转化与存储 共 34 份, 13 份未控制变量(温度相同,或其他条件相同) 0 人从分子、分母两个角度回答 本该将最优秀的学生区分出来,结果不理想 为什么? 与平时的训练有关 3SO 2 (g) + 2H 2 O(g) === 2H 2 SO 4 (l) + S(s) △ H 2 = -254 kJ · mol -1 学生形成思维定式 当增大压强时,解释 CO 的物质的量分数变化? 该题中,若 S 前系数为 4 ,或者 5 呢? H 2 SO 4 物质的量分数一定增大吗? 3A(g) + 2B(g) === 2C(l) + 5D(s) i . SO 2 + 4I - + 4H + === S ↓ + 2I 2 + 2H 2 O ii . I 2 + 2H 2 O + === + + 2I - ( 3 ) I - 可以作为水溶液中 SO 2 歧化反应的催化剂,可能的催化过程如下。将 ii 补充完整。 SO 2 SO 4 2- 4H + i . SO 2 做氧化剂,被 I - 还原 ii . SO 2 做还原剂,被 I 2 氧化,存在形式 SO 4 2- 思路 1 : 素养好的同学,利用化学的学科思维和化学原理的本质答题 歧化反应 催化剂 i . I - 被消耗,生成 I 2 ii . I 2 被消耗,生成 I - 该类学生脑中 的图 (对催化理解到位) 思路 2 :成绩一般的同学,利用总反应和分反应的关系得分 总 反应 : 3SO 2 (g) + 2H 2 O(g) === 2H 2 SO 4 (l) + S(s) i . SO 2 + 4I - + 4H + === S ↓ + 2I 2 + 2H 2 O ii . I 2 + 2H 2 O + === + + 2I - ii . 2I 2 + 4H 2 O + 2 ===2 + 2 + 4I - SO 2 SO 4 2- 4H + SO 2 SO 4 2- 4H + 不足 :容易思维固化,就题论题,不能理解本质,出现错答 × 共 34 份, 9 份写错 ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应 速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A B C D 试剂 组成 0.4 mol · L -1 KI a mol · L -1 KI 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊 较 A 快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较 A 快 空白实验 E SO 2 饱和溶液 无明显现象 表格题,核心是“对比” 对比不同实验现象,方可得结论 看似 4 组,实则 5 组 ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应 速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A B C D 试剂 组成 0.4 mol · L -1 KI a mol · L -1 KI 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较 A 快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较 A 快 溶液变黄,是 I 2 吗?证据不足 资料显示溶液变黄是 SO 2 与 KI 溶液相互作用生成复杂的显色物质 出现浑浊是 S 的生成 D 中棕褐色反映了 I 2 的颜色(实为 I 3 - ) 空白实验 E SO 2 饱和溶液 无明显现象 控制变量: 碘原子: 8 mmol ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应 速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A B C D 试剂 组成 0.4 mol · L -1 KI a mol · L -1 KI 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊 较 A 快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较 A 快 0.4 空白实验 E SO 2 饱和溶液 无明显现象 ① B 是 A 的 对比实验 ,则 a = 。 市 0.87 区 0.91 区一类校 0.98 ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应 速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A B C D 试剂 组成 0.4 mol · L -1 KI a mol · L -1 KI 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊 较 A 快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较 A 快 空白实验 E SO 2 饱和溶液 无明显现象 市 0.49 区 0.56 区一类校 0.65 ② 比较 A 、 B 、 C ,可得出的结论是 。 比较对象不明显,需自己提取 学生不懂分类,答不全 两个对象比较,可得小结论 强化分类与比较的能力与意识 2017 西城一模 两两对比, 指向明确 ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应 速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A B C D 试剂 组成 0.4 mol · L -1 KI a mol · L -1 KI 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊 较 A 快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较 A 快 E SO 2 饱和溶液 无明显现象 ② 比较 A 、 B 、 C ,可得出的结论是 。 对比 A 与 E : I - 是催化剂 对比 C 与 E : H + 不催化 对比 A 与 B : H + 能加快 I - 的催化 对比 C 与 B :突出 I - 的作用 思路 1 : 直接对比 空白实验 ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应 速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A B C D 试剂 组成 0.4 mol · L -1 KI a mol · L -1 KI 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊 较 A 快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较 A 快 E SO 2 饱和溶液 无明显现象 空白实验 参照物(现象最明显) 思路 2 :缺位实验 A :缺 H + , 反应慢 C :缺 I - , 无现象 空白实验:都缺,无现象 I - 最关键,是催化剂 H + 锦上添花,能加快 I - 的催化 B : 有 H + , I - ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A B C D 试剂 组成 0.4 mol · L -1 KI a mol · L -1 KI 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 H 2 SO 4 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较 A 快 无明显现象 溶液由棕褐色很快褪色,变成黄色,出现浑浊 较 A 快 i . SO 2 + 4I - + 4H + === S ↓ + 2I 2 + 2H 2 O ii . I 2 + 2H 2 O + SO 2 === SO 4 2- + 4H + + 2I - 讨论微粒: H + , I - 研究对象:反应 i 讨论微粒: I 2 研究对象:反应 ii A , D 对比, 实为反应 i , ii 的相互影响,及对总反应的影响 ( 4 )探究 i 、 ii 反应速率与 SO 2 歧化反应速率的关系,实验如下:分别将 18 mL SO 2 饱和溶液加入到 2 mL 下列试剂中,密闭放置观察现象。(已知: I 2 易溶解在 KI 溶液中) 序号 A D 试剂 组成 0.4 mol · L -1 KI 0.2 mol · L -1 KI 0.0002 mol I 2 实验 现象 溶液变黄,一段时间后出现浑浊 溶液由棕褐色很快褪色,变成黄色,出现 浑浊较 A 快 ③ 实验表明, SO 2 的歧化反应速率 D > A 。 结合 i 、 ii 反应速率 解释原因: 。 i . SO 2 + 4I - + 4H + === S ↓ + 2I 2 + 2H 2 O ii . I 2 + 2H 2 O + SO 2 === SO 4 2- + 4H + + 2I - I 2 的加入,直接影响了反应 ii 的速率,进而影响了总速率,因此 反应 ii 比 i 快 ; 且生成 的 H + 和 I - 使 反应ⅰ加快 I 2 很快消耗,即反应的中间体很活泼 市 0.10 区 0.14 区一类校 0.24 1 、对只答“产生 I - 、 H + 使反应 i 加快”的看法 逻辑不严谨,片面研究反应 i ∵碘总量相同,只谈反应 i 的浓度不会呈现结果 D > A ,最多是个 D=A 只说了差异,没有触及本质: “ I 2 对反应 ii 的影响超过同碘量的 I - ( H + )对反应 i 的影响” 这位考生提到正反两方面,未表述本质? 决定性的:速率 ii > i ; 2 、如果第 i 步>第 ii 步,会出现什么? D 中颜色不会很快褪去,反而会加深, A 中也不是“黄色” 如果第 i 步快, I - 、 H + 怎能影响总速率? AD 总速率 A > D 关于实验本身 气体制备 气体收集 制备饱和溶液 尾气吸收 上:蘸了 KI 溶液的试纸 下:淀粉 -KI 试纸 SO 2 气体反应:几乎无现象 SO 2 溶液与 KI 溶液的反应 左:二者混合,点点黄色 右:混合后加淀粉溶液, 蓝色不明显 颜色比照: 左:稀碘水,浓碘水 右:二者混合,饱和溶液, KI 溶液 实验结论 :无论气相反应还是溶液反应, SO 2 与 I - 的反应都很慢,很难观察到变浑浊 (S) ,很难看到变蓝 (I 2 ) ,加 H 2 SO 4 (aq) 后,依然很慢 决速步 i . SO 2 + 4I - + 4H + === S ↓ + 2I 2 + 2H 2 O ii . I 2 + 2H 2 O + SO 2 === SO 4 2- + 4H + + 2I - 如何理解呢? i . SO 2 + 4I - + 4H + === S ↓ + 2I 2 + 2H 2 O E θ =0.45-0.535 = -0.085V ii . I 2 + 2H 2 O + SO 2 === SO 4 2- + 4H + + 2I - E θ =0.535-0.172 = 0.363V 对氧化还原反应,可以用电极电势解释 查阅资料 I 2 + 2e - = 2I - φ θ =0.535V O 2 +4H + + 4e - = 2H 2 O φ θ =1.229V SO 4 2- + 4H + +2e - = H 2 SO 3 + H 2 O φ θ =0.172V H 2 SO 3 + 4H + + 4e - = S + 3H 2 O φ θ =0.45V 此外, O 2 的氧化性强于 SO 2 ,故 O 2 的干扰不能忽视,反应需在无氧条件下进行 热力学分析 查阅 298K 时 的标准热力学 数据 物质 f H m ( kJ ·mol - 1 ) S m ( J ·K -1 ·mol - 1 ) f G m ( kJ ·mol - 1 ) SO 2 -296.8 248.2 -300.1 I - -55.2 111.3 -51.6 H + 0 0 0 S 0 31.8 0 I 2 0 116.1 0 H 2 O -285.83 69.91 -237.13 SO 4 2- -909.3 20.1 -744.5 i . SO 2 + 4I - + 4H + === S ↓ + 2I 2 + 2H 2 O 或由: ii . I 2 + 2H 2 O + SO 2 === SO 4 2- + 4H + + 2I - 反应 i : 反应 ii : 也可求得 从计算结果看: E<0 ,反应不自发 E>0 ,反应自发; △G>0 ,反应不自发, △G<0 ,反应自发; 热力学数据表明,反应 i 是不容易进行的。 动力学分析 化学反应速率属于动力学范畴 需综合考虑外界因素,浓度、温度、压强、状态等对实际速率的影响 三、试题评价 关注能源危机,注重培养科学精神和社会责任 取材于利用硫的热化学循环实现 太阳能的转化和存储 的 最新进展 ,展现出 绿色科技 推动人与自然和谐发展的基本理念,展现化学在 社会领域的广泛应用 。 贴近教材,突出基础性和学科特色,加强实验能力考查。 以饱和二氧化硫溶液在不同条件下的 反应现象为情境 ,引导考生归纳 影响反应的因素 ,最终理解 分步反应与总反应的关系 ,以及 热方程式的书写、歧化反应、催化剂等基本概念和基本原理。 注重能力考查,展现基于实际问题的思维推理过程。 考查应用化学反应原理等相关知识对 实验数据和现象、图形、图表 的分析加工与推理能力。 2015 年北京卷 1 、素材:太阳能的综合利用,绿色化学 2 、呈现形式:流程图,原理图,多曲线图像 3 、考察内容:分步反应与总反应,平衡移动原理 试题亮点 2017 年北京卷 1 、素材:解决污染气体排放,绿色化学 2 、呈现形式:原理图,多曲线图 2 、 纯理论推导 ,展示学生思维过程 2018 年北京卷 1 、素材:太阳能综合利用,绿色化学 2 、呈现形式:原理图,多曲线图, 表格信息 3 、考查内容:热方程式,平衡移动原理,催化剂机理 创新点 4 、实验探究,对思维过程、推导能力的考察进一步加强。承担 28 题部分功能 1 、用好高考题 对教学的启示 2016 高考题 四、对教学的启示 2 、关注化学学科价值,把握核心知识,提高复习针对性 催化化学是一门新兴的交叉学科,对催化剂的研究是化学研究的热点 IUPAC 编写的 《21 世纪的化学丛书 》 ,第一部即为 《 催化化学 》 化学工业与石油化工, 80% 以上的过程都涉及到催化剂 2.1 催化剂 2016 高考题 2018 朝阳二模 2018 西城一模 反应速率是反应原理中的重要教学内容,但中学阶段仅停留在定性阶段,没有到定量阶段。 核心主干知识 ( 动力学 / 热力学 ) , 考生的误区,学生轻速率,重平衡。 实际生产很多速率问题,近几年也多次涉及到速率的探究 趋势:由表及里(能力考查切入点),由易到难,由 宏观到微观 分解 / 浸取率等 — →产物选择性 — →分 / 总反应关系 — →?基元反应?决速步?碰撞理论? 2.2 化学反应速率 2018 高考 26 题 2017 高考 28 题最后一问 80 ℃后, H 2 O 2 分解速率大,浓度显著降低 2018 全国卷 II 2017 朝阳一模 解释物质的量分数的变化 2017 海淀二模 2017 海淀二模 对教学的启示 3 、重视化学学科思想方法的训练( 分类,比较,控制变量 …… ) 充分利用教材中的素材 平时多做训练,如何找共性?找差异? 让学生多说,多表达(暴露问题) M 值相近的烷烃与醇,沸点如何比较? 讨论平衡移动,为何强调其他条件相同? 对教学的启示 4 、用好 《 考试说明 》 谢谢!查看更多