- 2021-08-23 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新人教版高二化学选修3:3_4离子晶体(第2课时)教案
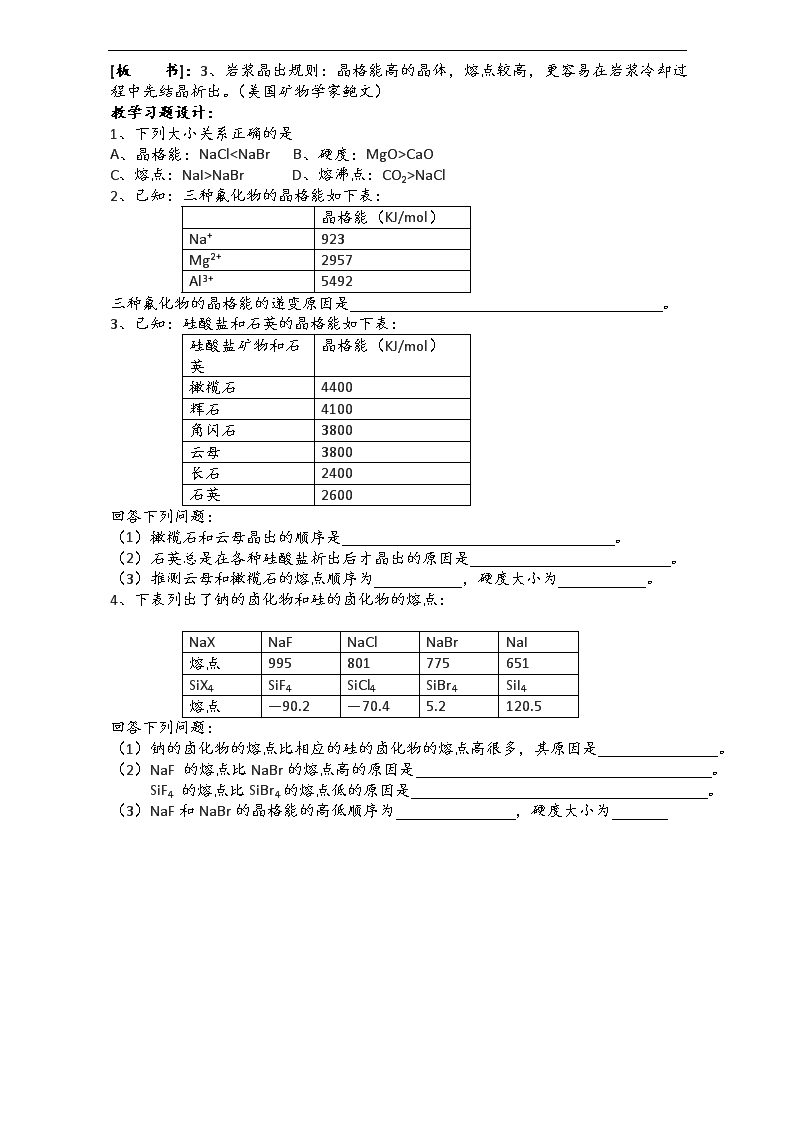
第二课时 教学目标设定: 通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。 教学重点、难点: 晶格能的定义和应用。 教学方法建议: 分析、归纳、应用 教学过程设计: [复 习]:四种类型晶体的比较: 晶体类型 离子晶体 分子晶体 原子晶体 金属晶体 构成粒子 粒子间相互作用 硬度 熔沸点 导电性 溶解性 典型实例 [阅读与思考]:阅读下表,讨论、分析得出哪些结论?(小组讨论、交流、汇报) 表1: F- Cl- Br- I- Li+ 1036 853 807 757 Na+ 923 786 747 704 K+ 821 715 682 649 Cs+ 785 689 660 630 Rb+ 740 659 631 604 表2: AB型离子晶体 离子电荷 晶格能(KJ/mol 熔点 摩氏硬度 NaF 1 923 993 3.2 NaCl 1 786 801 2.5 NaBr 1 747 747 <2.5 NaI 1 704 661 <2.5 MgO 2 3791 2852 6.5 CaO 2 3401 2614 4.5 SrO 2 3223 2430 3.5 BaO 2 3054 1918 3.3 [板 书]:二、晶格能 1、定义:气态离子形成1mol离子晶体时释放的能量。 2、规律: (1)离子电荷越大,离子半径越小的离子晶体的晶格能越大。 (2)晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。 [科学视野]:阅读P84----科学视野,从中你知道了什么? [板 书]:3、岩浆晶出规则:晶格能高的晶体,熔点较高,更容易在岩浆冷却过程中先结晶析出。(美国矿物学家鲍文) 教学习题设计: 1、下列大小关系正确的是 A、晶格能:NaCl查看更多