山东省潍坊市2020届高三化学第三次模拟试题(Word版附答案)
淮坊市高考模拟考试
化 学 2020.6
l. 答题前,考生先将自己的学校、班级、姓名、考生号、座号填写在相应位置, 认真核
对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上 。
2.选择题答案必须使用 2 B 铅笔( 按填涂样例) 正确填涂; 非选择题答案必须使用
0. 5 毫米黑色签字笔书写,字体工整 、迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试
题卷上答题无效。保持卡面清洁,不折叠 、不破损 。
可能用到的相对原子质量: H 1 Li 7 C 12 N 14 O 16 F 19 S 32 Cl 35. 5
K 39 Mn 55 Fe 56 Ga 70 Bi 209
一、选择题:本题共 10 小题, 每小题 2 分,共 20 分。每小题只有一个选项符合题意。
l. 古代化学源远流长。下列说法错误的是
A.“熬胆矾铁釜,久之亦化为铜”,说明铁能置换出铜; 这样铁釜能减缓锈蚀
B.“欲试药金(铜锌合金) ,烧火有五色气起”, 通过焰色反应可检验金属元素
C.“龙泉水,可以淬刀剑” ,高温的铁与水反应生成 Fe3O4
D.“取朴硝 ( 含有 KNO3)以温汤溶解 ,次早结块”,该过程为重结晶
2.在芒硝 ( Na2SO4• l 0H2O ) 结晶水含量测定的实验过程中 ,下列仪器或操作未涉及的
是
A B C D
3. X 、 Y 、 Z 、 W 是 短周期同 一 周期的主族元素 ,原子序数依次增大 ; 基态
X 的价电子轨道表示式为 , Z 最外层电子数是其次外层电子数的 3 倍;四
种元素与锂组成的化合物结构如图(箭头表示配位键)。下列说法正确的是
A. 四种元素中第一电离能最大的是 z
B. Y和 Z形成的化合物常温下均易溶于水
C.X 的最高价氧化物的水化物是一种强酸
D.Z 和 W 分别与氢元素形成的 10 电子化合物的沸点:前者高于后者
4. 对羟基苯甲酸乙酯用于食品防腐剂,工业上可用下列方法制备,以下说法错误的是
A.对羟基苯甲酸能发生缩聚反应、取代反应
B.可用浓溴水检验产物中是否有对羟基苯甲酸乙酯生成
C.l mol 对羟基苯甲酸乙酯最多与 2molNaOH 反应
D.乙醇脱水生成的乙烯不存在顺反异构
5.硫代硫酸钠( Na2S2O3)可作为照相业的定影剂, 反应的化学方程式为 : AgBr + 2
Na2S2O3 = Na3[ Ag (S2O3)2]+ NaBr。下列说法正确的是
A.基态 Br 原 子中电子的空间运动状态有 35 种
B. [ Ag (S2O3)2]3- 中含有离子键、共价键、配位键
C. S2O32-中心原子 S 的杂化方式为 sp3
D.非金属元素 S、O、Br 中电负性最大的是 Br
6. 下列实验操作能达到实验目的的是
实验目的 实验操作
A.除去苏打中混有的少量小苏打 将固体溶解,加入足量澄清石灰水后过滤、结晶
B.除去乙酸乙酯中的乙酸 加入氢氧化钠溶液,充分反应后, 静置、分液
C.除去铜粉中混有的氧化铜 加入稀硝酸溶解、 过滤、洗涤、 干燥
D.加快锌与稀硫酸反应制氢气的速率 往溶液中滴加几滴硫酸铜溶液
7. 设 NA为阿伏加德罗常数的值, 下列说法正确的是
A.17 g - OH 中含有的电子数为 10 NA
B. 25 °C 时 ,Ksp (BaSO4 )= 1×10-10,则 BaSO4饱和溶液中 Ba2 +数目为 1×10-5 NA
C.1 Ll mol • L 一 1 CH3COONH4溶液中CH3 COO 一
与 NH4+数目均为 NA
D.含 0. 5 mol 晶胞(右图) 的 Cu2O晶体中 Cu2+的数目为 2 NA
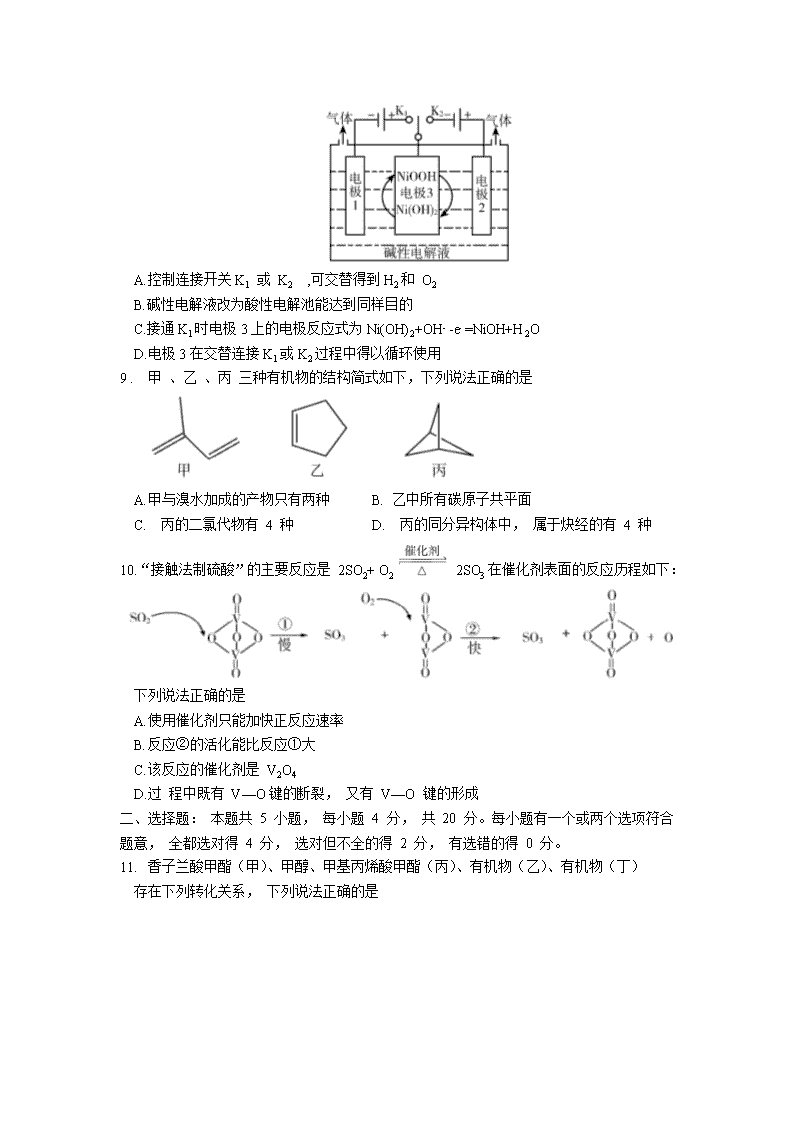
8.氢能源是最具应用前景的能源之一。可利用太阳能光伏电池电解水制高纯氢, 工作原理
如图所示 ( 电极 l 、 电极 2均为惰性电极)。 下列说法错误的是
A.控制连接开关 K1 或 K2 ,可交替得到 H2和 O2
B.碱性电解液改为酸性电解池能达到同样目的
C.接通 K1时电极 3上的电极反应式为 Ni(OH)2+OH- -e-=NiOH+H2O
D.电极 3在交替连接 K1或 K2过程中得以循环使用
9 . 甲 、乙 、丙 三种有机物的结构简式如下,下列说法正确的是
A.甲与溴水加成的产物只有两种 B. 乙中所有碳原子共平面
C. 丙的二氯代物有 4 种 D. 丙的同分异构体中, 属于炔经的有 4 种
10.“接触法制硫酸”的主要反应是 2SO2+ O2 2SO3在催化剂表面的反应历程如下:
下列说法正确的是
A.使用催化剂只能加快正反应速率
B.反应②的活化能比反应①大
C.该反应的催化剂是 V2O4
D.过 程中既有 V—O键的断裂, 又有 V—O 键的形成
二、选择题: 本题共 5 小题, 每小题 4 分, 共 20 分。每小题有一个或两个选项符合
题意, 全都选对得 4 分, 选对但不全的得 2 分, 有选错的得 0 分。
11. 香子兰酸甲酯(甲)、甲醇、甲基丙烯酸甲酯(丙)、有机物(乙)、有机物(丁)
存在下列转化关系, 下列说法正确的是
A.丙的分子式为 C5H10O2
B.乙→丁的反应类型为加成反应
C.乙、丁中的官能团种类均为 3 种
D.甲的同分异构体中含有苯环且取代基与甲完全相同有 9 种
12.Cl2O能与水反应生成次氯酸, 可杀死新型冠状病毒等多种病毒。一种制备 Cl2O原理为
HgO (红色粉末)+ 2 Cl2= HgCl2 (白色粉末)+ Cl2O ,某化学小组用下图装置制备 Cl2O ( 夹
持装置略去)
已知 : ①Cl2O的熔点为 - 116°C 、沸点为 3. 8°C , 易溶于水;
② 高浓度的 Cl2O易爆炸,Cl2O 与有机物接触或加热时会发生剧烈反应。
下列说法错误的是
A. 装置③中盛装的试剂是饱和食盐水,④中现象是红色粉末逐渐变为白色
B. 装置④中橡胶塞用锡箔包裹,防止 Cl2O 与橡胶塞反应
C. 从装置⑤中逸出气体的主要成分是 Cl2O
D. 通入干燥空气的目的是将生成的 Cl2O 稀释 ,防止发生爆炸
13. BMO ( Bi2MoO6) 是 一种高效光催化剂, 可用于光催化降解苯酚, 反应原理如下图
所示。下列说法错误的是
A. 苯酚被氧化的总反应:C6H5OH + 7O2 6CO2 + 3H2O
B. 反应过程中 BMO 表现较强氧化性
C. 在酸性条件下,反应①的离子方程式是
3 C6H5OH + 28 O2- + 28 H+ = l 8 CO2 ↑+ 23 H2O
D. 过程①和②中被降解的苯酚的物质的量之比为 1: 3
14. 向 7. 5mL 0. 03 mol •L-1 的 H3PO4溶液中 ,逐滴加入相同 浓度的 NaOH 溶液,溶液
pH 与 NaOH 溶液体积关系如图所示,已知 K a1 Ka2 Ka3 , 下列说法错误的是
A. H3PO4 第一级电离平衡常数 K a1的数量级为 10-3
B. 水的电离程度: b
c( H2PO4-) >c( HPO42-) > c( PO43-) > c( H+ ) > c( OH- )
D. c 点溶液中:2 c(H3PO4 )+ c(H2PO4- ) + c( H+) = c( OH- ) + c(PO43-)
15.某温度下,在起始压强为 80kPa 的刚性容器中,发 生 NO 的氧化反应: 2 NO (g) +
O2( g) 2 NO2( g) △H , 该反应的反应历程分两步进行,其速率方程和反应过程中
能量变化如下:
①2NO(g) N2O2 ( g) v1 正 = k1 正 c2 ( NO) v1 逆 = k1 逆 c (N2O2 )
②N2O2 ( g) + O2 ( g) 2 NO2 ( g) v2 正 = k2 正 c (N2O2 )c (O2 ) v2 逆 =k2 逆c2 (NO2)
下列说法正确的是
A. NO 氧化反应速率快慢的决定步骤的活化能是 E5 —E3
B. 一定温度下, 2 NO (g)+ O2 ( g) 2 NO2 ( g)平衡常数表达式 K=
C. 升高温度, NO 氧化反应的化学平衡向逆反应方向移动
D.该温度下,将等物质的量的 NO和 O2混合反应(忽略 2NO2 N2O4),NO的平衡转
化率为 40% 时, 该反应的平衡常数 Kp =
1
80
kPa-1
三、非选择题:本 题 共 5 小题, 共 60 分。
16. ( 11 分)锂是高能电池的理想负极,常用乙腈、二甲基甲酰胺等有机溶剂和 LiC1O4 、
LlBF4 、LiBr 等电解质制成锂非水电池。回答下列问题:
(1)二甲基甲酰胺( )中基态氮原子的电子排布是 ,乙
腈( CH3- C N) 中 碳原子的杂化轨道类型为 。
( 2 ) LiClO4和 LlBF4中都不存在的化学键是 (填代号)。
a.离子键 b. 共价键 c. 金属键 d. 配位键
(3) LiX (X=F, Cl , Br, I) 具有 NaCl 型晶体结构。当阴、阳离子电荷的绝对值相同且它
们的半径相近时, 生成的盐类一般难溶于水。由上述规则可以判断 LiF、LiCl、LiBr、LiI
中溶解度最小的是 。
(4)Li2S属立方晶体, 晶胞边长为 d pm , 晶胞截面图如下所示。每个晶胞中含有 S2-的数目
为 ,S2- 的 配位数是 ,NA表示阿伏加德罗常数的值,则 Li2S 晶体的
密度为 g • cm-3 ( 用代数式表示)。
17. ( 13 分) 某化学小组为研究甲醛和新制 Cu (OH )2反应,进行如下探究。
该小组设计下图装置(气密性良好)并进行实验: 向试管中依次加入 6mol • L-1NaOH 溶液
12 mL、0. 5 mol • L-1CuSO4溶液 8 mL , 振荡,再加入 40 % 的甲醛溶液 6 mL, 放入 65 °C
水浴中加热 ,20 min 后冷却至室温;反应过程中观察到有红色固体生成, 有少量气体产
生并收集该气体。回答下列问题:
已知:Cu2O易溶于浓氨水形成 [ Cu ( NH3)4]+( 无色),它在空气中能被氧化为[ Cu ( NH3)4]
2 +( 蓝色)。
(1)实验中 NaOH溶液过量的目的是 。使用水浴加热的目的是 。
( 2 ) 跟乙醛与氢氧化铜的反应相似,甲醛和新制 Cu ( OH )2反应的产物为甲酸钠、氧化亚铜
和水。该小组同学通过查阅资料发现,甲醛和新制 Cu ( OH )2 还能发生下列反应:
HCHO+ Cu (OH )2 Cu + CO↑+ 2 H2O
HCHO+4 Cu (OH )2+ 2NaOH 2Cu2O+ Na2CO3+ 6H2O
小组同学对实验中红色固体产物的组成作出猜想:铜或氧化亚铜或它们的混合物;为了验证
固体产物,设计如下实验方案并进行实验(以下每步均充分反应):
①摇动锥形瓶 i 的目的是 。
②锥形瓶 ii 中固体完全溶解得到深蓝色溶液的离子方程式为 。
③将容量瓶 ii 中的溶液稀释 100 倍后,溶液的颜色与容量瓶 i 相近。由此可知固体产物
的组成及物质的量之比约为 。
( 3 ) 为进一步确认生成的气体是 CO , 将收集的气体利用如图所示的装置进行实验(部分夹
持仪器略去)。
①无水氯化钙的作用是 。
②实验中“先通气,后加热” 的目的是 。
③ 证明气体是 CO的现象 。
(4 ) 甲醛与氢氧化铜反应的实验中, 甲醛可能被氧化的产物为甲酸钠或碳酸钠。请设计实
验方案证明溶液中甲醛的氧化产物: 。
18 . ( 12 分)氮化镓( GaN) 是 一种重要的半导体材料。某工厂利用铝土矿(成分为 Al2O3
、Ga2O3 、 Fe2O3等) 为原料制备 GaN 的 流程如下图所示:
已知:镓与铝同主族,镓的熔点是 29 . 8 °C , 沸点是 2403°C ; 其氧化物和氢氧化物
均为两性化合物; 氢氧化物的电离常数如下:
两性氢氧化物 Al( OH )3 Ga( OH )3
酸式电离常数 Ka 2×10-11 1×10-7
碱式电离常数 Kb 1.3×10-33 1.4×10-34
回 答下列问题:
( 1) 为了提高 “碱溶”效率应采用的措施是 (回答两种措施)。
( 2 ) 滤渣 l 的成分是 。
( 3 ) 滤液 2 中通入过量 CO2的理由是 (用离子方程式表示)。
( 4 ) 流程中利用镓与 NH3在 1000 °C 反应生成固体半导体材料 GaN,每生成 l molGaN 时
放 出 15. 45 kJ 热量, 写出该反应的热化学方程式 。
(5 ) 在密闭容器中 ,充入一定量的 Ga 与 NH3发生反应 ,测得反应平衡体系中 NH3 的体
积分数与压强 P 和温度 T 的关系曲线如右图所示。图中 A 点和 C 点化学平衡常数的
大小关系: KA KC (填“<”“=”或 “ > ”) , 判断的依据是 。
( 6 ) 已知铝土矿中 Ga2O3 的质量分数为 a%,某工厂使用 w 吨铝土矿经过一系列反应,反
应过程中镓元素的总利用率为 b%能制得 吨氮化镓
19. ( 12 分)丙烯是制造一次性医用口罩的重要原料。丙烷催化脱氢是工业生产丙烯的重要
途径,丙烷催脱氢技术主要分为氧化脱氢和直接脱氢两种。回答下列问题:
( 1 ) 丙烷催化氧化脱氢法主要反应如下:
2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) △H1=-236kJ·mol-1(i)
反应过程中消耗的 C3H8和 生成的 C3H6 的物质的量随温度的变化关系见右表。
①反应 i 中反应物的总能量 生成物的总能量(填“大于”“小于”或“等于” )。
②分析表中数据得到丙烯的选择性随温度的升高而 (填写“不变”“升高”“降 低”);
出现此结果的原因除生成乙烯等副产物外还可能是 。
(C3H6的选择性= ×100%)
( 2 ) 丙烷催化直接脱氢反应:
C3H8(g) C3H6 ( g) + H2 ( g)
△H2= + 124. 3kJ•mol -1 ( ii )
副反应:C3H8 ( g) C2H4 ( g) + CH4 ( g) △H3(iii)
①反应 ii 的平衡常数 、产物丙烯选择性、副产物乙烯选择性与温度关系如图所示, 分析
工业生产中采用的温度为 650°C 左右的原因是 。
②温度为 670°C 时 , 若在 IL 的容器中投入 8 molC3H8 ,充分反应后 ,平衡混合气体中
有 2molCH4和一定量 C3H8 、 C3H6、 H2 、 C2H4, 计算该条件下 C3H6 的选择性为
%。
③ 欲使丙烯的产率提高, 下列措施可行的是 ( 填写序号 )
a. 恒压条件下向原料气中掺杂水蒸气 b. 增大氢气与丙烷的投料比
c. 选择对脱氢反应更好选择性的催化剂 d. 增大压强
(3 ) 科学家探索出利用无机膜催化丙烷脱氢制丙烯的新工艺,该工艺利用特定功能膜将生成
的氢气从反应区一侧有选择性的及时移走,从平衡角度分析该工艺的优点 。
20. ( 12 分 ) 化合物 H 是合成抗胆碱药的一种中间体,合成路线如下 :
已知:
回答下列问题 :
(1)化合物 A 的结构简式是 , E→F 的反应类型是 。
( 2 )可证明 G 已经完全转化为 H 的物质是 (填代号)。
a. 溴水 b. 酸性 KMnO4 溶液 c. 四氯化碳 d. 钠
(3)D→E 的化学方程式为 。
( 4 )写出符合下列条件的 E 的 3 种同分异构体的结构简式 。
①含氧官能团与 E 不同;
②与 NaOH 溶液完全反应时, 二者的物质的量之比为 1: 1 ;
③苯环上有两种不同化学环境的氢,取代基上共有三种不同化学环境的氢。
(5)写出以环己烯和乙醇为原料合成的 合成路线 ( 其它试剂任选)
高三化学参考答案及评分标准
说明: l. 本答案供阅卷评分使用, 考生若写出其它正确答案,可参照评分标准给分。
2. 化学专用名词中出现错别字、元素符号有错误, 书 写不规范,都不得分 。
3. 化学方程式、离子方程式不按要求书写、未配平都不得分。漏掉或写错反应条
件扣 1 分。漏掉↑、 ↓不扣分。
一、选择题:本 题 共 10 小题, 每 小 题 2 分 , 共 20 分。每小题只有一个选项符
合题意。
1. A 2. C 3. D 4. B 5. C 6. D 7. D 8. B 9. C 10. D
二、选择题: 本题共 5 小题, 每小题 4 分 , 共 20 分。每小题有一个或两个选项符
合题意, 全都选对得 4 分 , 选对但不全的得 2 分, 有选错的得 0 分 。
11. BD 12. AC 13. BD 14. C 15. BC
三、非选择题:本题 共 5 小题, 共 60 分。
16. ( 11 分)
(1 ) 1s2 2s22p3 ( 1 分 )sp3杂化 sp 杂化 ( 2 分)
( 2 ) c (2 分)
(3) LiF ( 1 分)
(4) 4 ( 1 分)8 ( 2 分) × 1030 ( 2 分 )
17. ( 13 分)
( 1 ) 提供碱性溶液环境或 OH 一与 Cu ( OH )2 反应生成 [ Cu ( OH )4 ] 2-(1 分)
受热均匀便于控制温度 ( 1 分)
( 2 ) ①有利于溶液与空气中的氧气接触 (1 分)
②2Cu + 8NH3•H2O + O2=2[Cu ( NH3)4]2+ + 4OH- + 6 H2O ( 2 分 )
③n( Cu2O ) : n( Cu ) = 1: 200 ( 2 分)
( 3 ) ①吸收水蒸气 ( 1 分)
②排尽装置中的空气, 防止加热时发生爆炸 ( 1 分 )
③黑色粉末变为红色 , 澄清的石灰水变浑浊 ( 2 分 )
( 4 ) 取少量反应后的澄清溶液于试管 中 , 滴入过量的盐酸 , 若无气泡产生 , 说明
甲醛被氧化成甲酸钠 ;若有气泡产生 ,说明甲醛被氧化为碳酸钠。(其他合理答案也
给分 ) ( 2 分 )
18. ( 12 分)
( 1 ) 搅拌、适当提高温度、粉碎、适当提高溶液浓度等 ( 2 分)
( 2 ) Fe2O3( 1 分 )
(3) [ Ga( OH)4 ] -+ CO2= Ga( OH )3↓+ HCO3-或 GaO2-+ CO2+ 2H2O= Ga(OH)3↓+ HCO3- ( 2
分 )
( 4 ) 2Ga(l ) + 2 NH3 ( g) 2GaN(s ) +3H2(g) △H = -30. 9kJ•mol-1 ( 2 分
( 5)< ( 1 分) 由 C 点 到 B 点 , NH3体积分数增大 ,说明 T1 > T2 ;反应放热 ,
升高温度 , K 减小 ,所 以 KA < KC ( 2 分)
( 6) ( 2 分)
19. (12 分)
( 1) ①大于 ( 1 分)
②降低 ( 1 分) 升高温度,催化剂的活性降低 ,反应 i 的化学平衡逆向移动
( 2 分 )
( 2 ) ①温度控制在 650°C , 丙烯选择性高 , 反应速率快 , 平衡常数大(2 分 )
②50 ( 2 分)
③ac ( 2 分)
( 3) 将氢气及时移走 ,化学平衡C3H8(g) C3H6(g)+ H2( g) 正向移动,
提高丙烯产率 ( 2 分 )
20. (12 分)
(1) ( 1 分 )取代反应 (1 分)
( 2 ) d ( 2 分)
(3) ( 2 分)
(4)
( 3 分,其他合理答案也给分 )
(5)
( 3 分)