- 2021-08-23 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习“7+1”小卷练10(全国通用)
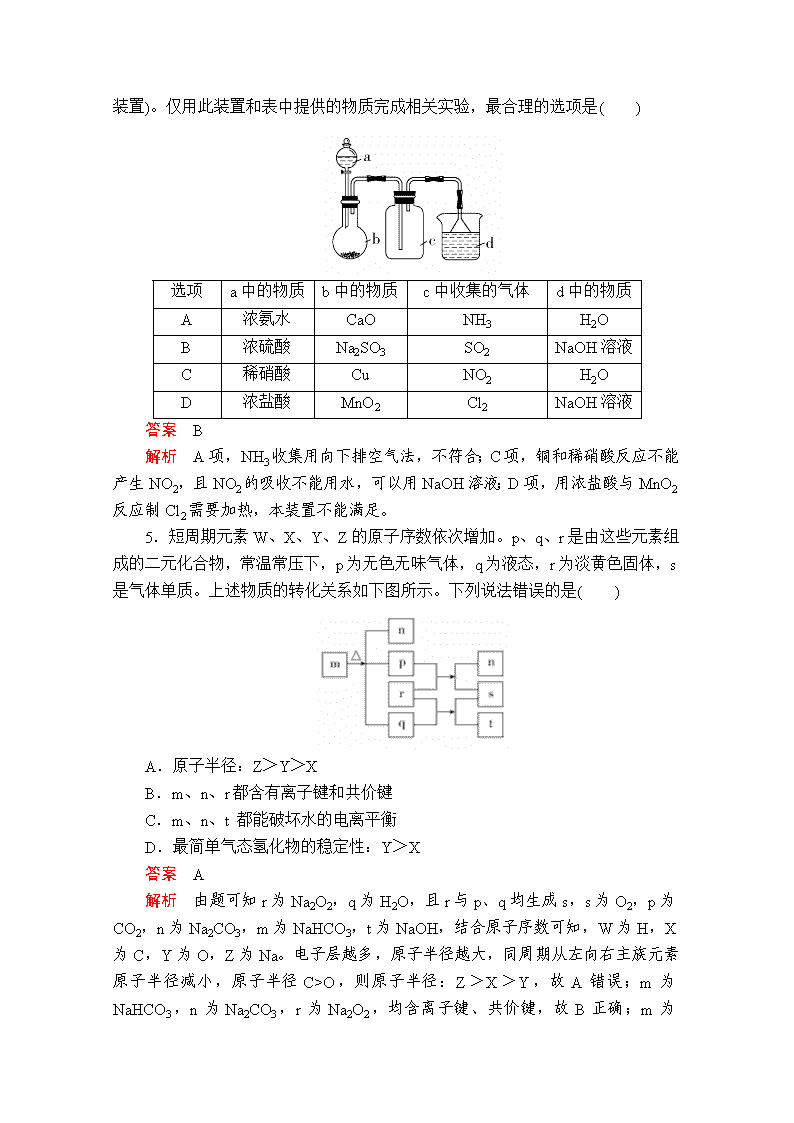
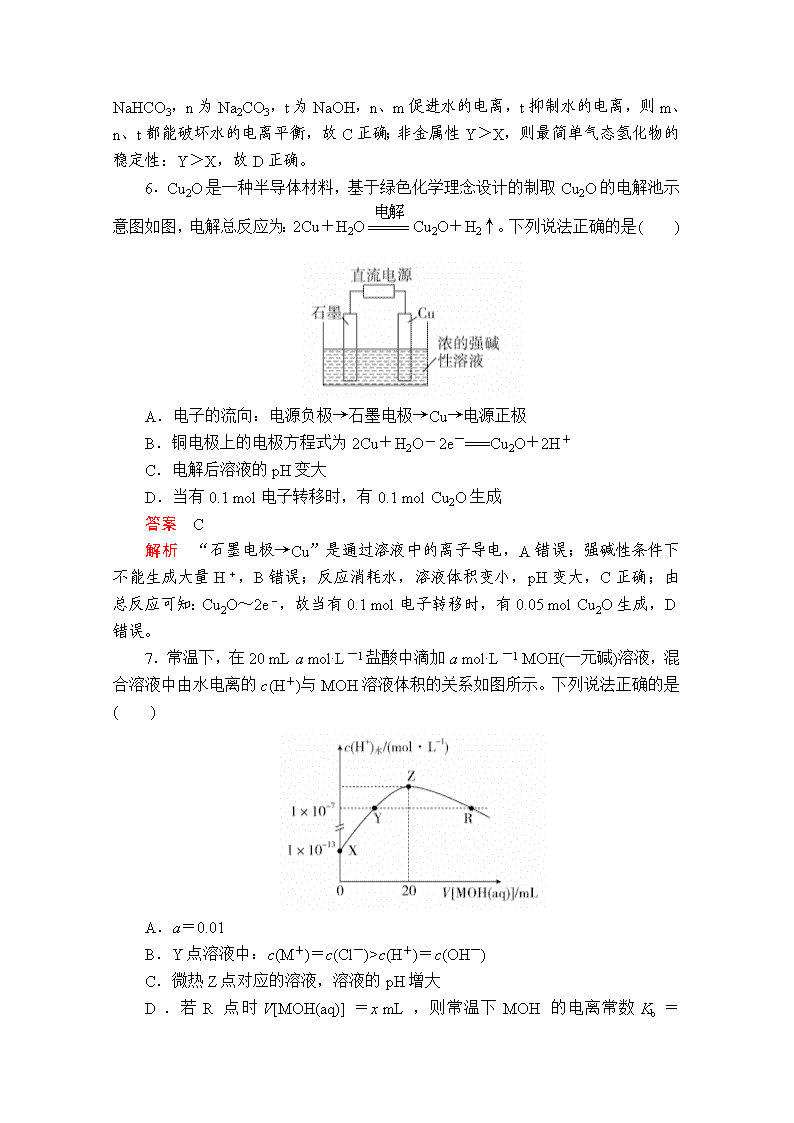
“7+1”小卷练10 1.化学与生活、社会发展息息相关。下列说法正确的是( ) A.有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素 B.聚乳酸酯的降解和油脂的皂化都是高分子生成小分子的过程 C.疫苗一般应冷藏存放,其目的是避免蛋白质变性 D.“玉兔二号”的太阳能电池帆板的材料是二氧化硅 答案 C 解析 丝绸的主要成分是蛋白质,故A错误;聚乳酸酯的降解是高分子生成小分子的过程,油脂不属于高分子,故B错误;疫苗一般应冷藏存放,其目的是避免蛋白质变性,使蛋白质失去活性,故C正确;硅是半导体,“玉兔二号”的太阳能电池帆板的材料是硅,故D错误。 2.下列关于有机物的说法正确的是( ) A.己烯和环己烷互为同分异构体 B.乙烷和氯气在光照条件下反应的产物都难溶于水 C.糖类和油脂都可发生水解反应 D.可用饱和NaOH溶液除去乙酸乙酯中混有的乙酸 答案 A 解析 己烯和环己烷的分子式均为C6H12,且结构不同,互为同分异构体,A正确;无机产物HCl易溶于水,B错误;单糖不能水解,C错误;乙酸乙酯会在NaOH溶液中发生水解反应,D错误。 3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A.常温常压下,密闭容器中92 g NO2含有的分子数为2NA B.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA C.标准状况下,14 g CO与11.2 L SO3所含分子数均为0.5NA D.电解精炼铜时,若阴极得到的电子数为2NA,则阳极质量一定减少64 g 答案 B 解析 NO2与N2O4之间存在平衡:2NO2N2O4,故92 g NO2含有的分子数小于2NA,A错误;碳酸钠为强碱弱酸盐,在溶液中存在水解平衡:CO+H2OHCO+OH-,使得阴离子数增加,溶液中还存在水的电离,所以阴离子总数大于0.1NA,B正确;标准状况下,SO3不是气态,不能用气体摩尔体积计算其物质的量,C错误;电解精炼铜时阳极是粗铜,其中含有的锌、铁等比铜活泼的金属也会失电子,因此阴极得到的电子数为2NA时,阳极质量不一定减少64 g,D错误。 4.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( ) 选项 a中的物质 b中的物质 c中收集的气体 d中的物质 A 浓氨水 CaO NH3 H2O B 浓硫酸 Na2SO3 SO2 NaOH溶液 C 稀硝酸 Cu NO2 H2O D 浓盐酸 MnO2 Cl2 NaOH溶液 答案 B 解析 A项,NH3收集用向下排空气法,不符合;C项,铜和稀硝酸反应不能产生NO2,且NO2的吸收不能用水,可以用NaOH溶液;D项,用浓盐酸与MnO2反应制Cl2需要加热,本装置不能满足。 5.短周期元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质。上述物质的转化关系如下图所示。下列说法错误的是( ) A.原子半径:Z>Y>X B.m、n、r都含有离子键和共价键 C.m、n、t 都能破坏水的电离平衡 D.最简单气态氢化物的稳定性:Y>X 答案 A 解析 由题可知r为Na2O2,q为H2O,且r与p、q均生成s,s为O2,p为CO2,n为Na2CO3,m为NaHCO3,t为NaOH,结合原子序数可知,W为H,X为C,Y为O,Z为Na。电子层越多,原子半径越大,同周期从左向右主族元素原子半径减小,原子半径C>O,则原子半径:Z>X>Y,故A错误;m为NaHCO3,n为Na2CO3,r为Na2O2 ,均含离子键、共价键,故B正确;m为NaHCO3,n为Na2CO3,t为NaOH,n、m促进水的电离,t抑制水的电离,则m、n、t都能破坏水的电离平衡,故C正确;非金属性Y>X,则最简单气态氢化物的稳定性:Y>X,故D正确。 6.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应为:2Cu+H2OCu2O+H2↑。下列说法正确的是( ) A.电子的流向:电源负极→石墨电极→Cu→电源正极 B.铜电极上的电极方程式为2Cu+H2O-2e-===Cu2O+2H+ C.电解后溶液的pH变大 D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成 答案 C 解析 “石墨电极→Cu”是通过溶液中的离子导电,A错误;强碱性条件下不能生成大量H+,B错误;反应消耗水,溶液体积变小,pH变大,C正确;由总反应可知:Cu2O~2e-,故当有0.1 mol电子转移时,有0.05 mol Cu2O生成,D错误。 7.常温下,在20 mL a mol·L-1盐酸中滴加a mol·L-1 MOH(一元碱)溶液,混合溶液中由水电离的c(H+)与MOH溶液体积的关系如图所示。下列说法正确的是( ) A.a=0.01 B.Y点溶液中:c(M+)=c(Cl-)>c(H+)=c(OH-) C.微热Z点对应的溶液,溶液的pH增大 D.若R点时V[MOH(aq)]=x mL,则常温下MOH的电离常数Kb= 答案 D 解析 Z点对应溶液中水的电离程度最大,则Z点时酸和碱恰好完全反应:MOH+HCl===MCl+H2O,又水电离的c(H+)大于10-7 mol·L-1,说明MOH是弱碱。Y点对应的溶液中溶质是MCl和HCl,溶液呈酸性,Z点之后继续加入MOH溶液,R点对应的溶液呈中性。A项,X点对应的溶液为a mol·L-1盐酸,c(H+)==0.1 mol·L-1,c(HCl)=0.1 mol·L-1,错误;B项,Y点对应的溶液呈酸性,则c(Cl-)>c(M+),c(H+)>c(OH-),错误;C项,Z点对应的溶液呈酸性,加热时M+的水解程度增大,溶液酸性增强,pH减小,错误;D项,R点对应的溶液中c(MOH)=×a mol·L-1,c(M+)=c(Cl-)=×a mol·L-1,c(H+)=c(OH-)=1×10-7 mol·L-1,Kb==,正确。 8.为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题: (1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。 ①反应中加入铁粉可以提高反应速率,其原因是____________________。 ②已知某些化学键键能数据如下表: 化学键 H—H N≡N N—H E/(kJ/mol) 436 946 391 反应N2(g)+H2(g) NH3(g)的活化能Ea=254 kJ/mol,则反应NH3(g) N2(g)+H2(g)的活化能Eb=________ kJ/mol。 (2)汽车内燃机工作时会将N2转化为NO,反应方程式为N2(g)+O2(g) 2NO(g),该反应在不同温度下的平衡常数K如下表: 温度 27 ℃ 2000 ℃ K 3.8×10-31 0.1 温度为2000 ℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2 mol/L,c(O2)=0.03 mol/L,c(NO)=0.03 mol/L,此时该反应的速率(v)应满足的关系为________(填字母序号)。 A.v正>v逆 B.v正=v逆 C.v正查看更多
相关文章
- 当前文档收益归属上传用户