- 2021-08-23 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
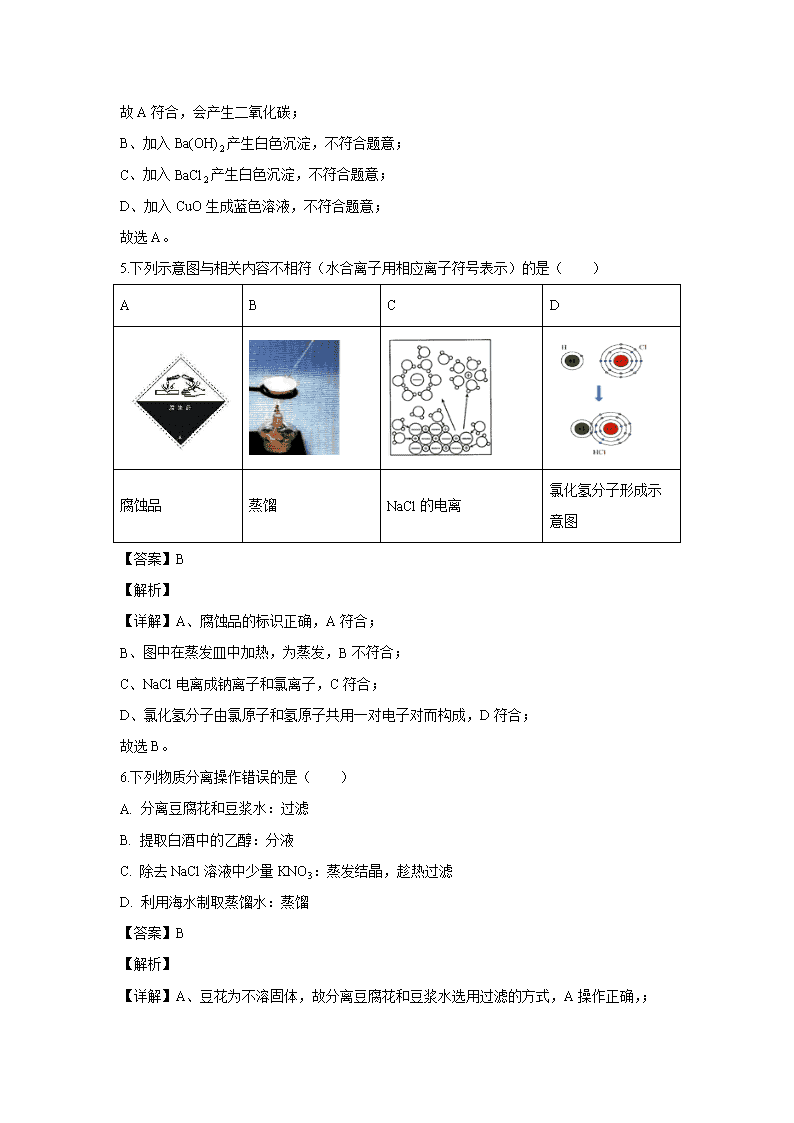
【化学】四川省巴中市巴州区2019-2020学年高一上学期期中考试试题(解析版)
四川省巴中市巴州区 2019-2020 学年高一上学期期中考试试 题 H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39 Ca-40 Fe-56 Zn-65 一、选择题(每题只有一个选项符合题意,1-15 每题 2 分,16-25 每题 3 分,共 60 分) 1.2019 年 10 月 1 日我国在天安门广场举行了建国 70 周年国庆大阅兵。下列环节与化学无关 的是( ) A. 研制出战机编队使用的无毒、环保的彩烟剂 B. 制造广泛用于坦克、飞机和服装等的隐形涂料 C. 释放 7 万羽和平鸽象征着中国人民爱好和平 D. 用氦气代替氢气填充彩色气球更加安全 【答案】C 【解析】 【详解】A、研制出战机编队使用的无毒、环保的彩烟剂需要用到化学,A 不符合题意; B、制造广泛用于坦克、飞机和服装等的隐形涂料需要用到化学,B 不符合题意; C、释放 7 万羽和平鸽象征着中国人民爱好和平,不涉及化学,C 符合题意; D、氢气球易爆炸,而氦气性质稳定,D 不符合题意; 故选 C。 2.2019 年 10 月 9 日,本年度诺贝尔化学奖授予美、日三位科学家,表彰其在锂离子电池的 发展方面作出的贡献。在充电时,LiCoO2、LiFePO4 在电池反应中常作还原剂。下列说法错 误的是( ) A. LiCoO2、LiFePO4 都是复杂的氧化物 B. 锂离子电池广泛用于新能源汽车、手机等产业 C. LiFePO4 中 Fe 显+2 价 D. LiCoO2 在充电时,电池反应中某种元素化合价会升高 【答案】A 【解析】 【详解】A、氧化物是只含有两种元素,其中一种为氧元素的化合物,故 A 错误,符合题意; B、新型锂电正极材料,具有容量高、成本低、安全性好等优异特性,所以广泛用于新能源 汽车、手机等产业,故 B 正确,不符合题意; C、LiFePO4 中 Li 显+1 价 PO43-显-3 价,根据化合价代数和为 0 可知 Fe 显+2 价,故 C 正确, 不符合题意; D、在充电时,LiCoO2 在电池反应中常作还原剂,还原剂化合价升高,故 D 正确,不符合 题意; 故选 A。 3.下列物质的化学用语使用正确的是( ) A. 碳酸钠:NaCO3 B. 氯化钙的电离:CaCl2=Ca2++Cl 2 2 C. 钠在氯气中燃烧的反应电子转移情况:2Na+Cl2 2e 点燃 2NaCl D. 氯离子结构示意图: 【答案】D 【解析】 【详解】A、碳酸钠的化学式为:Na2CO3,故 A 错误,不符合题意; B、氯化钙的电离方程式:CaCl2=Ca2++2Cl-,故 B 错误,不符合题意; C、钠在氯气中燃烧的反应电子由钠原子转移到氯原子,即 , C 错误,不符合题意; D、氯离子为氯原子得到一个电子形成,所以结构示意图: ,故 D 正确,符合题 意; 故选 D。 4.NaHSO4 溶于水时和熔融态下电离方式有所不同,向 NaHSO4 溶液中分别加入下列物质, 有气体生成的是( ) A. NaHCO3 B. Ba(OH)2 C. BaCl2 D. CuO 【答案】A 【解析】 【详解】NaHSO4 溶液的电离方程式为:NaHSO4= Na++H++SO42-,加入的物质要产生气体, 故 A 符合,会产生二氧化碳; B、加入 Ba(OH)2 产生白色沉淀,不符合题意; C、加入 BaCl2 产生白色沉淀,不符合题意; D、加入 CuO 生成蓝色溶液,不符合题意; 故选 A。 5.下列示意图与相关内容不相符(水合离子用相应离子符号表示)的是( ) A B C D 腐蚀品 蒸馏 NaCl 的电离 氯化氢分子形成示 意图 【答案】B 【解析】 【详解】A、腐蚀品的标识正确,A 符合; B、图中在蒸发皿中加热,为蒸发,B 不符合; C、NaCl 电离成钠离子和氯离子,C 符合; D、氯化氢分子由氯原子和氢原子共用一对电子对而构成,D 符合; 故选 B。 6.下列物质分离操作错误的是( ) A. 分离豆腐花和豆浆水:过滤 B. 提取白酒中的乙醇:分液 C. 除去 NaCl 溶液中少量 KNO3:蒸发结晶,趁热过滤 D. 利用海水制取蒸馏水:蒸馏 【答案】B 【解析】 【详解】A、豆花为不溶固体,故分离豆腐花和豆浆水选用过滤的方式,A 操作正确,; B、白酒中的乙醇与水互溶,应选用蒸馏,B 操作错误; C、KNO3 的溶解度随温度变化较大,而 NaCl 的溶解度随温度变化几乎不变,故除去 NaCl 溶液中少量 KNO3 方式为:蒸发结晶,趁热过滤,C 操作正确; D、利用海水制取蒸馏水选用蒸馏的方式,D 操作正确; 故选 B。 7.下列反应既是氧化还原反应,又是化合反应的是( ) A. 灼热的碳与二氧化碳反应 B. 铝片与稀硫酸的反应 C. 甲烷在氧气中的燃烧 D. Ca(OH)2 溶液与足量 CO2 反应 【答案】A 【解析】 【详解】氧化还原反应是有化合价变化的反应;化合反应是由两种及两种以上物质反应生成 一种物质的反应;符合条件的为 A 选项; B、铝片与稀硫酸的反应属于置换反应,B 不符合; C、甲烷在氧气中的燃烧,不属于四种基本反应,C 不符合; D、Ca(OH)2 溶液与足量 CO2 反应不属于氧化还原反应,D 不符合; 故选 A。 8.下列氧化物与盐酸或氢氧化钠溶液都不反应的是( ) A. CO B. CO2 C. CaO D. SO2 【答案】A 【解析】 【详解】与盐酸或氢氧化钠溶液都不反应氧化物为不成盐氧化物,A 符合;BD 为酸性氧化 物,能与碱反应,C 为碱性氧化物,能与酸反应; 故选 A。 9.下列分离过程不涉及萃取的是( ) A. 用四氯化碳分离碘水中的碘单质 B. 屠呦呦团队科研人员从青蒿中提取青蒿素 C. 用汽油除去衣服上的油污 D. 粗盐的提纯 【答案】D 【解析】 【详解】萃取需要将溶质从一种溶剂转移到另一种溶剂中,ABC 均符合,粗盐的提纯采用 过滤的方式,不涉及萃取,D 项符合题意, 故选 D。 10.浑浊的泥水是复杂的分散系,过滤后可以得到胶体。下列描述错误的是( ) A. 浊液是一种不稳定的分散系 B. 可以用“丁达尔”效应区别胶体和溶液 C. 过滤得到的胶体可能带负电荷 D. 河流在入海口形成“三角洲”,因为发生了胶体的凝聚 【答案】C 【解析】 【详解】A、浊液的粒子直径大于 1nm,静止易分层或产生沉淀,不稳定,A 正确,不符合 题意; B、用“丁达尔”效应区别胶体和溶液时,胶体会出现一条光亮的通路,而溶液没有,B 正确, 不符合题意; C、胶体不带电,胶粒带电,故 C 错误,符合题意; D、土壤胶粒带负电,由于入海口处海水中含电解质(氯化钠为主),使得胶体溶液发生聚 沉,泥沙沉淀形成“三角洲”,D 正确,不符合题意; 故选 C。 11.下列仪器及名称没有错误的是( ) A B C D 钳埚 冷凝管 长颈漏斗 溶量瓶 【答案】B 【解析】 【详解】A、坩埚为泥土烧制,所以应为坩埚,A 错误; B、为冷凝管,B 正确; C、漏斗有活塞,为分液漏斗,C 错误; D、应为容量瓶,D 错误; 故选 B。 12.进行化学实验时应强化安全意识。下列做法正确的是( ) A. 用试管加热碳酸氢钠固体时使试管口竖直向上 B. 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 C. 蒸发食盐溶液实验后,用坩埚钳将蒸发皿放在石棉网上冷却 D. 用量筒量取一定体积浓硫酸加入容量瓶中,加水至刻度线可以得到稀硫酸 【答案】C 【解析】 【详解】A、用试管加热碳酸氢钠固体时使试管口倾斜向上,并且不能将试管口对着人,A 错误; B、浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗会导致二次伤害,故少量浓硫酸溅到皮 肤上时立即用大量水冲洗,然后涂抹碳酸氢钠溶液,B 错误; C、蒸发食盐溶液实验后,用坩埚钳将蒸发皿放在石棉网上冷却,操作无误,C 正确; D、不能在容量瓶内配置溶液,D 错误; 故选 C。 13.物质的量是表示一定数目微粒集体的物理量。下列说法错误的是( ) A. 该物理量不宜用于描述宏观物体形成的集体 B. 微粒集体数目约为 6.02×1023 C. 1molN2 的质量等于 28 克 D. 化学反应中各物质的质量比等于它们的物质的量之比 【答案】D 【解析】 【详解】A、物质的量的计量对象是构成物质的微观粒子或某些微观粒子的特定组合,不可 用于计量宏观物质,A 正确; B、国际上规定,1 mol 粒子集体所含的粒子数与 0.012 kg12C 中所含的碳原子数相同,约为 6.02×1023,B 正确; C、N2 的摩尔质量为 28g/mol,所以 1molN2 的质量等于 28 克,C 正确; D、根据公式 m=n×M 可知:质量之比不等于物质的量之比,D 错误; 故选 D。 14.下列物质是非电解质的是( ) A. HCl B. CH3COOH C. P4 D. NH3 【答案】D 【解析】 【分析】非电解质:在水溶液中和熔融状态下不能导电的化合物。 【详解】A、HCl 为强酸,属于电解质,A 不符合; B、CH3COOH 为弱酸,属于电解质,B 不符合; C、P4 为单质,既不是电解质也不是非电解质,C 不符合; D、NH3 为非电解质,D 符合; 故选 D。 15.下列物质不易溶于水的是( ) A. MgSO4 B. Ba(OH)2 C. CH3COOH D. CaSO4 【答案】D 【解析】 【详解】根据溶解性口诀可知:CaSO4 微溶于水(不易溶于水),MgSO4 为可溶性盐, Ba(OH)2 为可溶性强碱,CH3COOH 为可溶性酸;D 项符合题意, 故选 D。 16.设 NA 为阿伏加德罗常数的值,下列说法正确的是( ) A. 标准状况下,2.24 L 乙醇中含有的氧原子数目为 0.1NA B. 1 L 1mol/L 的 NaHCO3 溶液中 Na+、H+和 CO32-的数目均为 NA C. 16 g 的 O2 和 O3 混合气体中所含原子总数为 NA D. 18 g 水中所含电子总数为 8NA 【答案】C 【解析】 【详解】A、乙醇在标准状况下为液体,不能用气体摩尔体积等于 22.4L/mol,A 错误; B、HCO3-在水溶液中不能完全电离,所以 H+和 CO32-的数目均小于 NA,B 错误; C、O2 和 O3 均只含有氧元素,所以 16 g的O2 和 O3 混合气体中所含原子总数为: 16 116 / A g mol Ng mol ,C 正确; D、一个 H2O 含有 10 个电子,所以 18 g 水中所含电子总数为 10NA,D 错误; 故选 C。 17.如图表示 1 g 气体 X 和 1 g O2 在相同容积的密闭容器中压强与温度的关系,则气体 X 可 能是( ) A. CH4 B. O3 C. H2S D. NO2 【答案】A 【解析】 【详解】根据阿伏伽德罗推论,同温同体积同质量,压强之比等于摩尔质量的反比,故 X 的摩尔质量小于 O2; 故选 A。 18.下列离子方程式中,正确的是( ) A. 碳酸氢钠溶液与稀硫酸混合:HCO3-+H+=CO2↑+H2O B. 稀盐酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ C. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+NO3- D. 硫酸镁溶液与氢氧化钠溶液混合:MgSO4+2OH-=Mg(OH)2↓+ SO42- 【答案】A 【解析】 【详解】A、碳酸氢钠溶液与稀硫酸混合的离子方程式为:HCO3-+H+=CO2↑+H2O,A 正 确; B、稀盐酸滴在铁片上的离子方程式为:Fe+2H+=Fe2++H2↑,B 错误; C、硝酸银溶液与氯化钠溶液混合的离子方程式为:Ag++Cl-=AgCl ↓,C 错误 D、硫酸镁溶液与氢氧化钠溶液混合的离子方程式为:Mg2++2OH-=Mg(OH)2↓,D 错误; 故选 A。 19.在透明溶液中能大量共存的一组离子是( ) A. NH4+、Ba2+、Br-、CO32- B. Cl-、S2-、Fe2+、H+ C. Na+、H+、NO3-、HCO3- D. K+、Na+、SO42-、MnO4- 【答案】D 【解析】 【详解】A、Ba2+与 CO32-生成 BaCO3 沉淀,不能大量共存,A 不符合; B、S2-与 H+反应生成 H2S 弱电解质,S2-和 Fe2+发生双水解不能大量共存,B 不符合; C、H+与 HCO3-反应生成水和二氧化碳,不能大量共存,C 不符合; D、离子间不发生相互反应,可以大量共存,D 符合; 故选 D。 20.在一定条件下,实现以下物质间转化,下列说法错误的是( ) Ca CaO Ca(OH)2 CaCO3 Ca(HCO3)2 A. 反应①中 Ca 做还原剂 B. CaO 是常见的干燥剂 C. 实现反应③只能向澄清石灰水中通入 CO2 气体 D. 反应④的离子反应方程式为:CaCO3+CO2+H2O=Ca2++2 HCO3- 【答案】C 【解析】 【详解】A、反应①中 Ca 化合价生成,做还原剂,A 正确; B、CaO 能与水反应,是常见的干燥剂,B 正确; C、实现反应③还可以加碳酸钠,C 错误; D、反应④的离子反应方程式为:CaCO3+CO2+H2O=Ca2++2 HCO3-,D 正确; 故选 C。 21.某同学在实验室中进行如下实验: 编号 Ⅰ Ⅱ Ⅲ 实验 现象 无明显变化,溶液仍为无色 有沉淀生成,溶液为蓝色 有无色气体放出 以下结论正确的是( ) A. Ⅰ中无明显变化,说明两溶液不反应 B. Ⅱ中的白色沉淀为 CuCl2 C. Ⅲ中发生的反应不是离子反应 D. Ⅲ中的离子方程式为 2H++Zn=Zn2++H2↑ 【答案】D 【解析】 【详解】A、Ⅰ中无明显变化,不能说明两溶液不反应,A 错误; B、Ⅱ中的白色沉淀为 BaSO4,B 错误; C、Ⅲ中发生的反应为:2H++Zn=Zn2++H2↑,是离子反应,C 错误; D、Ⅲ中的离子方程式为 2H++Zn=Zn2++H2↑,D 正确; 故选 D。 22.将 8.0 g 铁粉加入到 100 mL 2.0 mol/L FeCl3 溶液中,发生反应为 Fe+2Fe3+=3Fe2+,反应 后过滤、洗涤、烘干得固体质量为 m。下列说法不正确的是( ) A. m=2.4g B. Fe3+在反应中做氧化剂,失去 0.2mol 电子 C. 该反应是化合反应 D. 反应后溶液中 n(Fe2+)=0.3 mol 【答案】B 【解析】 【 详 解 】 反 应 前 , Fe 的 物 质 的 量 为 8g 1 mol56g / mol 7 , Fe3 + 的 物 质 的 量 为 : 0.1L×2mol/L=0.2mol,根据反应:Fe+2Fe3+=3Fe2+可知:Fe 过量,剩余 Fe 的质量为: 1 mol 0.1mol 56g / mol 2.4g7 ,生成的 Fe2+的物质的量为 0.3mol,AD 正确; B、根据反应:Fe+2Fe3+=3Fe2+可知 Fe3+化合价降低,在反应中做氧化剂,得到 0.1mol 电 子,B 不正确; C、根据反应:Fe+2Fe3+=3Fe2+可知为化合反应,C 正确; 故选 B。 23.下列化学方程式中,不能正确表达反应颜色变化的是( ) A. 向 CuSO4 溶液中加入足量 Zn 粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4 B. 澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O C. 将饱和氯化铁溶液滴入沸水中得到红褐色分散系:FeCl3+3H2O Δ Fe(OH)3↓+3HCl D. 向 CuO 粉末中加入碳粉加热得到红色固体:2CuO+C Δ 2Cu+CO2↑ 【答案】C 【解析】 【详解】A、向 CuSO4 溶液中加入足量 Zn 粉,发生反应:Zn+CuSO4=Cu+ZnSO4,铜离子消 失,变为无色,A 正确; B、澄清的石灰水久置后发生反应:Ca(OH)2+CO2=CaCO3↓+H2O 生成碳酸钙沉淀,出现白色 固体,B 正确; C、将饱和氯化铁溶液滴入沸水中得到红褐色分散系的反应:FeCl3+3H2O Δ Fe(OH)3↓(胶 体)+3HCl,C 错误; D、向 CuO 粉末中加入碳粉加热发生反应:2CuO+C Δ 2Cu+CO2↑,得到红色固体,D 正确; 故选 C。 24.设 NA 为阿伏伽德罗常数的值,如果 a g 某气态双原子分子的分子数为 p,下列说法错误 的是( ) A. a g 该气体含有的原子数为 2pNA B. 每个分子的质量为 a p 克 C. b g 该气体在标况下的体积约为 A 22.4bp aN 升 D. 该气体的摩尔质量为 AaN p 克/摩 【答案】A 【解析】 【 分 析 】 有 题 干 可 知 , 物 质 的 量 为 : A A N pn molN N , 摩 尔 质 量 为 : A A aNm agM g / molpn pmolN ,据此回答。 【详解】A、因为分子为双原子分子,所以原子数为分子数二倍,故原子数为:2p,A 错误; B、a g 分子的分子数为 p,则一个分子的质量为: a p 克,B 正确; C、由分析可知气体的摩尔质量为 AaN p 克/摩,则 b g 该气体在标况下的体积约为: m A A bg 22.4bpn V mol 22.4mol / L LaN aNg / molp ,C 正确; D、由分析可知气体的摩尔质量为 AaN p 克/摩,D 正确; 故选 A。 25.某工业废水含大量的 FeSO4,较多的 Cu2+和少量的 K+。某工厂计划回收金属铜并制取硫酸 亚铁,流程如下图,相关分析错误的是( ) A. 步骤①加入过量 Fe 粉后过滤,分别得到固体 A 和滤液 B B. 步骤②所加试剂是稀盐酸 C. 蒸发结晶时有大量晶体析出就停止加热 D. 取少量步骤①所得溶液 B 于试管中,先加入盐酸酸化,再加入 BaCl2 溶液,有白色沉淀 生成,表明溶液 B 中含 SO42- 【答案】B 【解析】 【分析】某工业废水含大量的 FeSO4,较多的 Cu2+和少量的 K+。先加过量铁,铁在金属活动 顺序表中排在铜的前面,所以铁粉把铜置换出来,发生 Fe+Cu2+=Cu+ Fe2+,过滤出 Cu,Fe. 滤液是 FeSO4,在 A 中加入稀硫酸除去过量的 Fe,发生反应为 Fe+H2SO4=FeSO4+H2↑,最 后所得滤液经蒸发浓缩、冷却结晶、过滤可得到 FeSO4.7H2O 晶体。 【详解】A、由分析可知步骤①加入过量 Fe 粉后过滤,分别得到固体 A 和滤液 B,A 正确, 不符合题意; B、由分析可知步骤②所加试剂是稀硫酸,B 错误,符合题意; C、蒸发时,当有大量固体析出时停止加热,利用余热蒸干,C 正确,不符合题意; D、取少量步骤①所得溶液 B 于试管中,先加入盐酸酸化,再加入 BaCl2 溶液,有白色沉淀 生成,表明溶液 B 中含 SO42-,D 正确,不符合题意; 故选 B。 二、填空题(40 分) 26.(1)某种原子的质量是 a g,若 NA 只表示阿伏伽德罗常数的数值,该原子的相对原子质 量为______,b g 该原子的物质的量为______mol。 (2)a g A 气体与 b g B 气体分子数相等,同温同压下,气体 A 与气体 B 的密度之比为 ___________。 (3)向 10 mL 0.1mol/LNaHCO3 溶液中缓缓滴入 0.1mol/LCa(OH)2 溶液,首先发生反应的两 种离子为____________(填离子符号,下同),随后溶液中有白色沉淀生成,生成沉淀的两 种离子为____________。当加入少量 Ca(OH)2 溶液时,发生的离子反应方程式为 _______________________。 (4) 将 3.22 g 芒硝(Na2SO4·10H2O)溶于水中,要使每 100 个水分子中溶有 1 个 Na+,则 需加入水的质量为___g。 【答案】(1). aNA (2). A b aN (3). a:b (4). HCO3-、OH- (5). Ca2+ 、CO32- (6). 2 OH-+ Ca2++2 HCO3-=CaCO3↓+ CO32-+2H2O (7). 34.2 【解析】 【详解】(1)、某原子的质量是 ag,若 NA 只表示阿伏加德罗常数的数值, 则 1mol 原子的质 量为: aNAg,其摩尔质量为 aNAg/mol,b g 该原子的物质的量为: A A bg b molaN g / mol aN , 故答案为:aNA; A b aN ; (2)、在标准状况下,agA 气体与 bgB 气体分子数相等, 根据 mn M 可知,A 气体与 B 气 体的摩尔质量之比为 a:b,同温同压下气体密度之比等于摩尔质量之比为:a:b, 故答案为 a:b ; (3)、向 10 mL 0.1mol/LNaHCO3 溶液中缓缓滴入 0.1mol/LCa(OH)2 溶液,此时 Ca(OH)2 溶液 少量,所以首先发生反应的两种离子为:HCO3-、OH-;HCO3-与 OH-反应产生 CO32-,所以 生成沉淀的两种离子为:Ca2+ 、CO32-;当加入少量 Ca(OH)2 溶液时,发生的离子反应方程 式为:2OH-+ Ca2++2 HCO3-=CaCO3↓+ CO32-+2H2O; 故答案为:HCO3-、OH-;Ca2+ 、CO32-;2OH-+ Ca2++2 HCO3-=CaCO3↓+ CO32-+2H2O; (4)、3.22g 芒硝的物质的量为 m 3.22gn 0.01molM 322g / mol ,所以溶液中 n(Na+)= 2n(Na2SO4·10H2O)=0.01mol×2=0.02mol,每 100 个水分子中溶有 1 个钠离子,所以 n(H2O)= 100n(Na+) = 2mol,中含有水的 0.01mol Na2SO4·10H2O 物质的量为 0.01mol×10=0.1mol,所 以需要的水的物质的量为 2mol-0.1mol=1.9mol,所以需要水的质量为 1.9mol x×18g/ mol= 34.2g, 故答案为:34.2。 27.实验室需要 750 mL 0.16 mol·L-1 的 NaCl 溶液,有如下操作步骤: A. 把称量好的 NaCl 晶体放入小烧杯中,加适量蒸馏水溶解,冷却至室温 B. 继续向容量瓶中加蒸馏水至液面距刻度线以下 1~2 cm 处,改用胶头滴管小心滴加蒸馏 水至溶液凹液面与刻度线相切 C. 用少量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶 D. 把 A 所得溶液小心转入一定容积的容量瓶中 E. 将容量瓶瓶塞塞紧,充分摇匀 请填写下列空白: (1)简述容量瓶使用前必须进行的操作________________________________ (2)操作步骤的顺序为____________________(填序号)。 (3)实验室有如下规格的容量瓶:a.100 mL,B. 250 mL,C. 500 mL,d. 1000 mL,本实验 选用__________(填序号)。 (4)本实验用到的基本实验仪器除容量瓶、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还 必须用到的仪器有____________,实验中玻璃棒的作用是_________________。 (5)本实验需用托盘天平称取 NaCl 晶体的质量是___________g。 (6)误差分析(填“偏高”“偏低”或“无影响”): A. 某同学试验时未洗涤烧杯:____________。 B. 某同学观察液面的情况如图所示:____________。 C. 称取的食盐中混有 Na2CO3 杂质:___________。 (7) 已知所得溶液密度为 1.04 g/mL,则所得溶液的质量分数为:___________ 【答案】(1). 检查是否漏水 (2). A→D→C→B→E (3). d (4). 托盘天平(带砝码) (5). 搅拌加速溶解、引流 (6). 9.4 (7). 偏低 (8). 偏低 (9). 偏低 (10). 0.9% 【解析】 【分析】(1)、容量瓶在使用前需要检漏; (2)、配置溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、装瓶; (3)、根据大而近的原则选取; (4)、根据溶液配置过程选取; (5)、根据 m=cVM,称量; (6)、根据公式 nc V 进行分析; (7)、根据公式 1000ρωc M 进行计算。 【详解】(1)、容量瓶在使用前需要检验是否漏水,故答案为:检查是否漏水; (2)、配置溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,故答案为: A→D→C→B→E; (3)、根据大而近的原则选取,需要配置 750mL 的溶液需要选取 1000mL 的容量瓶,故答案 为 d; (4)、根据溶液配置过程还需要选取托盘天平(带砝码),玻璃棒的作用:在溶解时搅拌,加 速溶解,在转移和洗涤时引流,故答案为:托盘天平(带砝码);搅拌加速溶解、引流; (5)、根据 m=cVM 计算需要称量的质量为: m cVM 0.16mol / L 1L 58.5g / mol 9.4g ,故答案为:9.4g; (6)、A、未洗涤烧杯导致溶质未完全转移到容量瓶,根据公式 nc V 进行分析可知导致浓度 偏低,故答案为:偏低; B、定容时仰视刻度导致溶液体积偏大,根据公式 nc V 进行分析可知导致浓度偏低,故答 案为:偏低; C、称取的食盐中混有 Na2CO3 杂质导致 NaCl 的物质的量减少,根据公式 nc V 进行分析可 知导致浓度偏低,故答案为:偏低; (7)、根据公式 1000ρωc M 可知: cM 0.16mol 58.5g / molω 0.9%1000ρ 1000 1.04g / mL ,故答案为 0.9%。 28.在中学化学中,KMnO4 是常见的氧化剂之一。某实验小组收集整理了相关知识: (1) KMnO4 中 Mn 的化合价为_______。 (2) 实验室中可以加热分解 KMnO4 制取 O2,其反应方程式为_______________。 (3) 实验中常在 KMnO4 溶液中加入适量稀硫酸,增加 KMnO4 的氧化性,但不宜用盐酸 酸化,因为浓度较大时,KMnO4 可能将 Cl-氧化成 Cl2,该反应中氧化剂和还原剂的物质的 量之比为:____________ ,比较以下两种物质的氧化性:KMnO4_____________于 Cl2(填“强” 或“弱”) (4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将 H2C2O4 溶液滴入硫酸酸化的 KMnO4 溶液,当 KMnO4 被完全还原时,溶液颜色由_______变成无色, 同时有无色气体生成。该反应方程式为:_____________________。 (5)某同学将 KMnO4 溶液加入 H2O2 溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生, 且出现黑色沉淀。该沉淀化学式为____________________ 【答案】(1). +7 (2). 2KMnO4 Δ K2MnO4+MnO2+O2↑ (3). 1:5 (4). 强 (5). 紫 红色 (6). 2 KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O (7). MnO2 【解析】 【详解】(1)、常见元素化合价:K 为+1 价,O 为-2 价,根据化合价代数和可知:Mn 为+7 价,故答案为+7; (2)、实验室用 KMnO4 制取 O2 的反应方程式为:2KMnO4 Δ K2MnO4+MnO2+O2↑,故答案 为:2KMnO4 Δ K2MnO4+MnO2+O2↑; (3)、KMnO4 的还原产物为 Mn2+,KMnO4 将 Cl-氧化成 Cl2,所以氧化剂为:KMnO4,还原 剂为:Cl-,根据得失电子守恒可知氧化剂和还原剂的物质的量之比为:1:5,氧化剂的氧化 性大于氧化产物的氧化性,所以 KMnO4 的氧化性强于 Cl2,故答案为:1:5,强; (4)、高锰酸钾为紫红色,所以未完全反应时溶液为紫红色,根据得失电子守恒配平方程式: 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,故答案为:紫红色;2 KMnO4 +5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O; (5)、高锰酸钾的氧化性强弱由溶液的酸性强弱决定,当溶液为酸性时,还原产物为:Mn2+; 当溶液为中性时,还原产物为:MnO2;当溶液为碱性时还原产物为:MnO42-; 故答案为 MnO2。 29.将 10mL98%浓硫酸(密度为 1.84g/mL)加水稀释至 1L,然后向溶液中加入 6.5g 锌粒。 (1)稀释后硫酸溶液中 H+的物质的量浓度是_________________? (2)标出反应中电子转移方向及数目___________,并计算生成气体在标况下的体积是 _____________? 【答案】(1). 0.368mol/L (2). (3). 2.24L 【解析】 【 详 解 】 (1) 、 浓 硫 酸 的 物 质 的 量 浓 度 为 : 1000ρω 1000 1.84g / mL 98%c 18.4mol / LM 98 ,根据稀释前后溶质的物质的量不 发生改变可知:c1V1=c2V2,稀释后的硫酸浓度为: 18.4mol / L 10mLc 0.184mol / L1000mL , 则 H+的物质的量浓度是 0.368mol/L,故答案为:0.368mol/L; (2)、标出反应中电子转移方向及数目即单线桥 ;,6.5g 锌的物 质的量为: 6.5g 0.1mol65g / mol ,硫酸的物质的量为:0.184mol/L×1L=0.184mol,根据反应 Zn+H2SO4═ZnSO4+H2↑可知,硫酸过量,所以产生氢气的物质的量为 0.1mol,在标况下的体 积是:0.1mol×22.4L/mol=2.24L, 故答案为: ;2.24L。查看更多