- 2021-08-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年四川省棠湖中学高二上学期期末模拟化学试题 Word版
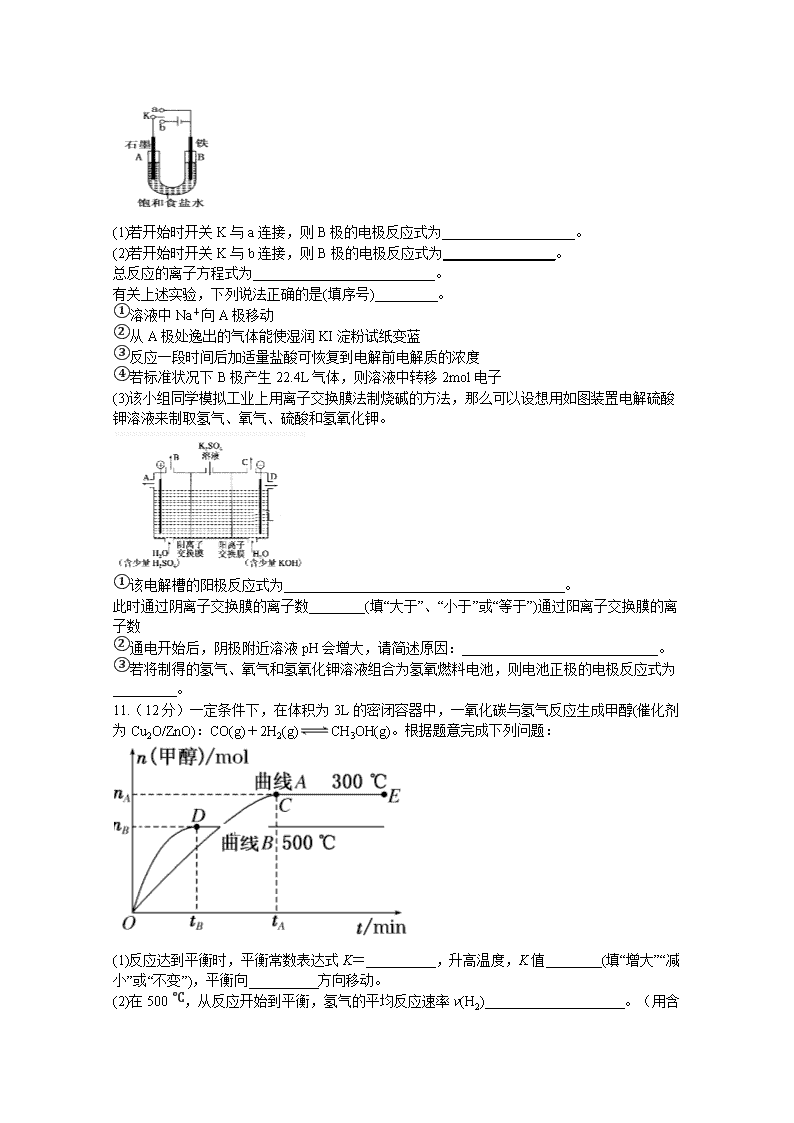
2019年秋四川省棠湖中学高二期末模拟考试 化学试题 可能用到的相对原子质量: H-1 C-12 O-16 N-14 S-32 Fe-56 Na-23 S32 C135.5 Fe56 Ba137 第I卷 选择题(45分) 一、选择题(每题只有一个答案符合题意,每小题5分,共45分) 1.用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是 A.滴定前滴定管中有气泡,滴定后消失 B.碱式滴定管量取NaOH溶液时,未进行润洗操作 C.滴定时达到滴定终点时俯视读数 D.锥形瓶取用NaOH待测液前加少量水洗涤 2.在10mL 0.1mol·L-1 NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是 A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) C.c(Na+)=c(CH3COO-)+c(CH3COOH) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) 3.在下列给定条件的溶液中,一定能大量共存的离子组是 A. 无色溶液:K+、Cl- 、Mg2+、、 B. =0.1mol/L的溶液:、、、 C. Na2CO3溶液: K+、Fe3+、、 D. 能使pH试纸呈红色的溶液:Na+、、I-、 4.一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)Z(g) △H<0,反应经60s达到平衡并生成0.3mol Z,则下列说法中正确的是 A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) B.其他条件不变,将容器体积扩大至20L,则Z的平衡浓度变为原来的1/2 C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 5.对于可逆反应:2SO2+O22SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是 A.增大压强 B.升高温度 C.使用催化剂 D.多充O2 6.下列各溶液中,微粒的物质的量浓度关系正确的是 A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c()>c(Cl-)> c(OH-)>c(H+) B. 0.1mol·L-1 Na2CO3溶液:c(Na+)=c()+2c()+2c(H2CO3) C. 0.1mol·L-1 NH4Cl溶液:c()=c( Cl-) D. 向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)=c(CH3COO-)+c(OH-) 7.如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 A.a电极是负极 B.b电极的电极反应为:4OH--4e-=2H2O+O2↑ C.氢氧燃料电池是一种具有应用前景的绿色电源 D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 8.可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 A.使用催化剂,C的物质的量分数增加 B.升高温度,平衡向正反应方向移动 C.化学方程式的系数a<c+d D.根据图像无法确定改变温度后平衡移动方向 9.常温下,在20.00mL 0.1000mol·L-1 NH3·H2O溶液中逐滴滴加0.1000mol·L-1HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是 A.①溶液:c(Cl-)>c()>c(OH-)>c(H+) B.②溶液:c()=c(Cl-)>c(OH-)=c(H+) C.①、②、③三点所示的溶液中水的电离程度②>③>① D.滴定过程中不可能出现:c(NH3·H2O)>c()>c(OH-)>c(Cl-)>c(H+) 第II卷 非选择题(55分) 10.(14分)某课外活动小组同学用如图装置进行实验,试回答下列问题: (1)若开始时开关K与a连接,则B极的电极反应式为___________________。 (2)若开始时开关K与b连接,则B极的电极反应式为________________。 总反应的离子方程式为__________________________。 有关上述实验,下列说法正确的是(填序号)_________。 ①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生22.4L气体,则溶液中转移2mol电子 (3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。 ①该电解槽的阳极反应式为__________________________ 。 此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数 ②通电开始后,阴极附近溶液pH会增大,请简述原因:____________________________。 ③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为_________。 11.(12分)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)。根据题意完成下列问题: (1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值________(填“增大”“减小”或“不变”),平衡向__________方向移动。 (2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)____________________。(用含 相应字母的式子表示) (3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(填选项字母)。 A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快 C.甲醇的物质的量增加 D.重新平衡时增大 (4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_________________________________(用化学方程式表示)。 12.(14分)为证明化学反应有一定的限度,进行如下探究活动: I.取5ml 0.1mol/L的KI溶液,滴加5至6滴FeCl3稀溶液 Ⅱ.继续加入2mlCCl4振荡 Ⅲ.取萃取后的上层清液,滴加KSCN溶液 (1)探究活动I的实验现象为________ 探究活动Ⅱ的实验现象为 __________ (2)为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作: ①移取20.00mLFeCl3稀溶液至锥形瓶中,加入___________用作指示剂,再用c mol/LKI标准溶液进行滴定,达到滴定终点时的现象是 ______ ②重复滴定三次,平均耗用dmol/LKI标准溶液MmL,则FeCl3溶液物质的量浓度为 ___________mol/L ③若滴定前滴定管尖嘴中无气泡,滴定后有气泡,则测定结果_______ (填“偏高”或“偏低”或“不变”)。 Ⅳ.探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想: 猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察为了验证猜想,查阅资料获得下列信息: 信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大 信息二:Fe3+可与[Fe(CN)6]4—反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高 结合新信息,现设计以下实验方案验证猜想: ①完成下表 实验操作 现象和结论 步骤一:取萃取后的上层清液滴加________ 若 ,则猜想一不成立。 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 若 ,则猜想二成立。 ②写出实验操作“步骤一”中的反应离子方程式: 。 13.(15分)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ·moL−1 2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ·moL−1 H2O(g)=H2O(l) ΔH3=-44.0kJ·moL−1 (1)氢气的标准燃烧热ΔH=______kJ.moL−1. (2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式__________________. (3)往1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃ 时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为______;反应达到平衡后,升高温度,此时平衡常数将______(填“变大”、“不变”或“变小”),平衡将向______(填“正”或“逆”)方向移动. (4)为了提高CO的转化率,可采取的措施是( ) A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度 (5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是______. 化学试题参考答案 1-5:AABAB 6-9:ABCB 10.(1) Fe-2e-=Fe 2+ (2) 2H+ + 2e- = H2↑, 2Cl- + 2H2O H2↑ + Cl2↑ + 2OH-,②④ (3)①4OH- - 4e- = O2↑+ 2H2O, 小于 ② H+放电,促进水电离,OH-浓度增大 ③ O2+ 4e- + 2H2O = 4OH- 11.(1); 减小; 逆反应(2)(3)BC (4)Cu2O+CO2Cu+CO2 12.(1)液体呈棕黄色 , 溶液分层,下层四氯化碳层呈紫色 (2)① KSCN溶液,当滴加最后一滴KI标准溶液时,红色褪去且30秒内不恢复 ②0.05cV ③ 偏低 Ⅳ. ① 实 验 操 作 现 象 和 结 论 2滴K4[Fe(CN)6] 若产生蓝色沉淀 若乙醚层呈血红色 ② 4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3↓ 13.(1)285.8; (2)CO(g)+H2O(g)=CO2(g )+H2(g) ΔH=-41.2kJ·moL−1; (3)50%;变小,逆; 4.BD; 5.H2-2e-+2OH-═2H2O查看更多