2020高考化学考前微专题突破练九溶液中离子反应图象题的答题技巧选择题含解析
溶液中离子反应图象题的答题技巧(选择题)
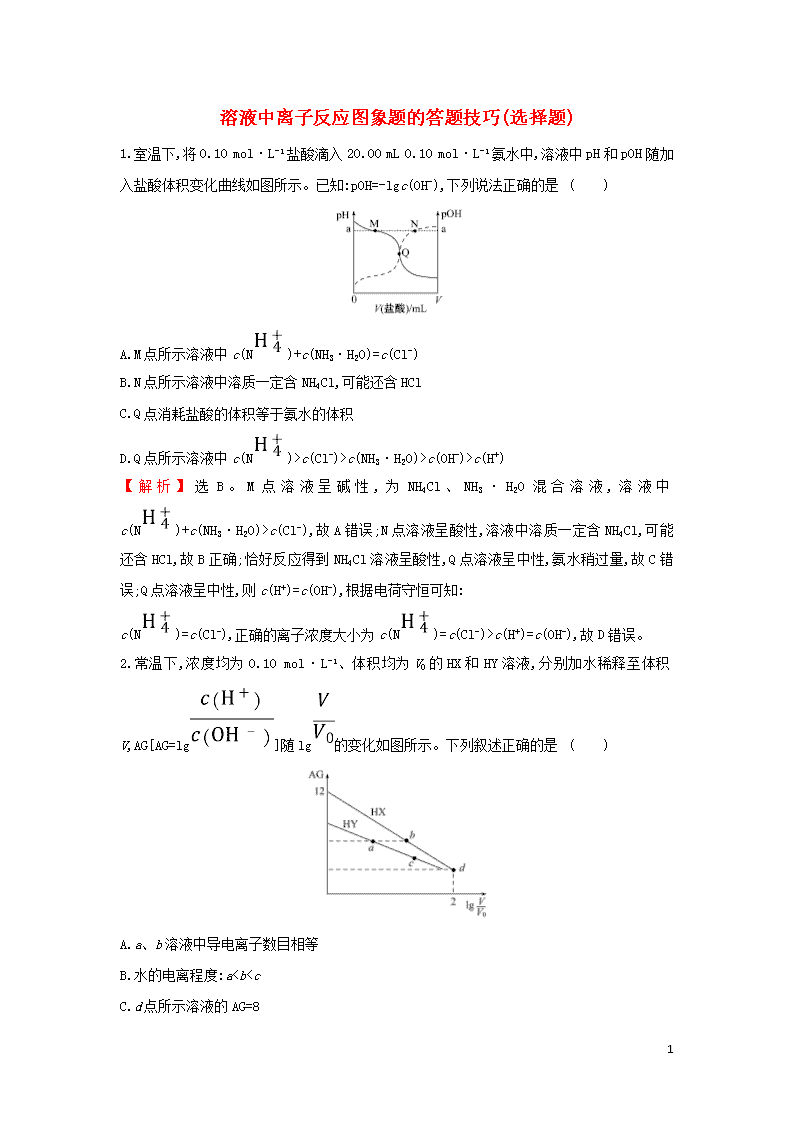
1.室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lgc(OH-),下列说法正确的是 ( )
A.M点所示溶液中c(N)+c(NH3·H2O)=c(Cl-)
B.N点所示溶液中溶质一定含NH4Cl,可能还含HCl
C.Q点消耗盐酸的体积等于氨水的体积
D.Q点所示溶液中c(N)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
【解析】选B。M点溶液呈碱性,为NH4Cl、NH3·H2O混合溶液,溶液中c(N)+c(NH3·H2O)>c(Cl-),故A错误;N点溶液呈酸性,溶液中溶质一定含NH4Cl,可能还含HCl,故B正确;恰好反应得到NH4Cl溶液呈酸性,Q点溶液呈中性,氨水稍过量,故C错误;Q点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:
c(N)=c(Cl-),正确的离子浓度大小为c(N)=c(Cl-)>c(H+)=c(OH-),故D错误。
2.常温下,浓度均为0.10 mol·L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=lg]随lg的变化如图所示。下列叙述正确的是 ( )
A.a、b溶液中导电离子数目相等
B.水的电离程度:a
10,因此pH=10的溶液中:c(HC)>c(C),A错误;B.根据物料守恒可知E点溶液中:c(Na+)>3c(C),B错误;C.根据物料守恒c(HC)+c(C)+c(H2CO3)=0.100 mol·L-1和电荷守恒c(H+)+c(Na+)
=c(OH-)+2c(C)+c(HC)可知pH=11的溶液中:c(H+)+c(Na+)+c(H2CO3)
=c(OH-)+c(C)+0.100 mol·L-1,C正确;D.在E点溶液中加入等体积
11
0.100 mol·L-1的NaOH溶液碳酸氢钠转化为碳酸钠,根据物料守恒可知c(C)与c(HC)之和发生变化,D错误,答案选C。
4.25 ℃时,向1 L 0.1 mol·L-1 NaA溶液中,不断通入HCl气体后,c(A-)与c(HA)的变化趋势如图所示(假设通入的HCl气体被溶液完全吸收,且不考虑溶液体积的变化),下列说法不正确的是 ( )
A.通入HCl气体过程中水的电离程度不断减小
B.M点:n(H+)-n(OH-)=(a-0.05)mol
C.随着HCl的加入,[c(HA)·c(OH-)]/c(A-)不断增大
D.当n(HCl)=0.1 mol时,c(H+)>c(Na+)-c(HA)
【解析】选C。A.根据图象,虚线为HA的变化曲线,实线为A-的变化曲线,原溶液为NaA溶液,水解促进水的电离,通入HCl气体过程中c(A-)减小,水的电离程度减小,故A正确;B.在M点时,溶液中存在电荷守恒为c(Na+)+c(H+)=
c(Cl-)+c(A-)+c(OH-),则c(H+)-c(OH-)=c(Cl-)+c(A-)-c(Na+)=a+0.05-0.1
=(a-0.05)mol·L-1,故B正确;C.温度不变,水解常数Kh=不变,故C错误;D.当n(HCl)=0.1 mol时,NaA与HCl恰好反应生成等浓度的NaCl和HA,由于HA部分电离溶液显酸性,根据电荷守恒为c(Na+)+c(H+)=c(Cl-)+c(A-)+c(OH-),根据物料守恒,c(HA)+c(A-)=c(Na+),且c(Na+)=c(Cl-),因此c(H+)=
c(A-)+c(OH-)=c(Na+)-c(HA)+c(OH-)>c(Na+)-c(HA),故D正确;故选C。
5.常温下,向20.00 mL 0.100 0 mol·L-1(NH4)2SO4溶液中逐滴加入
0.200 0 mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是 ( )
11
A.点a所示溶液中:c(N)>c(S)>c(OH-)>c(H+)
B.点b所示溶液中:c(N)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(S)+c(H+)=c(NH3·H2O)+c(OH-)
D.点d所示溶液中:c(S)>c(NH3·H2O)>c(N)>c(OH-)
【解析】选C。a点为硫酸铵溶液,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH-),铵根离子水解程度较小,知c(N)>c(S),所以溶液中离子浓度大小顺序是c(N)>c(S)>c(H+)>c(OH-),故A错误;b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(N)+c(Na+)=2c(S)+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(N)>
c(Na+),故B错误;c点溶液中,溶液呈碱性,所以c(H+)c(S),故D错误。
6.常温下,浓度均为0.10 mol·L-1、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述正确的是 ( )
11
A.该温度下HB的电离平衡常数ab
C.相同条件下NaA溶液的pH小于NaB溶液的pH
D.当lg=3时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则减小
【解析】选C。温度不变平衡常数不变,所以该温度下HB的电离平衡常数a=b,故A错误;酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大,氢离子浓度:a=c>b,所以溶液中水的电离程度:a=cc(HY)
D.b点时酸碱恰好完全中和
【解析】选C。lg越大,溶液中氢离子浓度越大,未加NaOH时,HX溶液中lg的值大,所以HX的酸性大于HY,故A错误;a点lg=12,则溶液中c(H+)=0.1 mol·L-1,溶液中水电离的c(H+)==10-13mol·L-1,故B错误;
c点lg=6,则溶液中c(H+)=10-4mol·L-1,此时消耗的NaOH为0.005 mol,则溶液中的溶质为NaY和HY,由于溶液显酸性,所以HY的电离程度大于NaY的水解程度,所以c(Y-)>c(HY),故C正确;浓度均为0.1 mol·L-1、体积均100 mL的HY与NaOH恰好中和消耗NaOH为0.01 mol,而b点时消耗的NaOH为0.008 mol,所以酸过量,故D错误。
8.常温下用0.100 0 mol·L-1的盐酸分别逐滴加入20.00 mL 0.100 0 mol·L-1的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列说法不正确的是 ( )
A.XOH为强碱,MOH、YOH均为弱碱
B.V(HCl)=15.00 mL时,三份溶液中离子总浓度大小顺序:XOH>MOH>YOH
C.当盐酸滴加至20.00 mL时,三条曲线刚好相交
D.在逐滴加入盐酸至40.00 mL的过程中,三份溶液中水的电离程度均先增大后减小
【解析】选C。A、由图象可知,0.100 0 mol·L-1的三种一元碱XOH、MOH、YOH溶液的pH分别为13、11、9,所以XOH为强碱,MOH、YOH均为弱碱,即A正确;B、当V(HCl)=15.00 mL时,
11
三份溶液中c(Cl-)相等,由溶液的pH可知其c(OH-)大小顺序为XOH>MOH>YOH,溶液中的阴离子只有Cl-和OH-,所以溶液中离子总浓度大小顺序也是XOH>MOH>YOH,故B正确;C、当盐酸滴加至20.00 mL时,三者都恰好完全反应,但由于三种碱的强弱不同,生成的盐中XCl不水解,MCl和YCl的水解程度不同,所以三种盐溶液的pH不同,三条曲线不会相交,故C不正确;D、当逐滴加入盐酸至40.00 mL的过程中,开始在盐酸逐渐与三种碱反应生成盐的过程中,水的电离程度逐渐增大,随着过量盐酸的逐渐增多,增大了抑制水电离的程度,使水的电离程度逐渐减小,所以D正确。本题正确答案为C。
9.(2020·绍兴模拟)25 ℃时,向10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入20 mL 0.1 mol·L-1的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是 ( )
A.盐酸滴加一半时,溶液pH>7
B.0.1 mol·L-1 Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(C)+c(HC)
C.在A点:c(Na+)>c(C)=c(HC)>c(OH-)>c(H+)
D.当pH=5时,溶液中c(Na+)=2c(H2CO3)+2c(HC)+2c(C)
【解析】选D。A.盐酸滴加一半时,也就是10 mL,恰好与盐酸完全反应生成碳酸氢钠和氯化钠,其中碳酸氢钠水解溶液呈碱性,所以溶液的pH>7,所以A选项是正确的;B.Na2CO3溶液中存在电荷守恒,为c(Na+)+c(H+)=2c(C)+c(HC)+c(OH)-,所以B选项是正确的;C.在A点:n(C)=n(HC)=0.000 5 mol时,得到等物质的量碳酸钠和碳酸氢钠两者水解溶液呈碱性,所以离子浓度大小为c(Na+)>c(C)=c(HC)>c(OH-)>c(H+),所以C选项是正确的;D.当pH=5时,溶液为酸性,Na2CO3溶液中满足物质守恒:c(Na+)=2c(H2CO3)+2c(HC)+2c(C),pH=5时,溶液呈酸性,一部碳元素以CO2的形式逸出,故此时溶液中c(Na+)>2c(H2CO3)+2c(HC)+2c(C),故D错。
10.25 ℃时,c mol·L—1 CH3COOH溶液加水稀释,溶液中CH3COOH和CH3COO-
11
二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是 ( )
A.由图可知,25 ℃时醋酸的Ka=10-4.76
B.c mol·L—1 CH3COOH溶液加水稀释中,α(CH3COOH)增大,c(CH3COO-)也一定增大
C.在pH=4.76的溶液中通入HCl,α(CH3COOH)增大,α(CH3COO-)减小,α(CH3COOH)+α(CH3COO-)=1
D.对于图象中曲线上任意一点所对应的溶液中,都有c(CH3COO-)+c(OH-)=c(H+)
【解析】选B。A.由图可知,pH=4.76时,α(CH3COOH)=α(CH3COO-),所以25 ℃时醋酸的Ka=10-4.76,A正确;B.c mol·L-1 CH3COOH溶液加水稀释中,CH3COOH的电离平衡正向移动,所以α(CH3COOH)减小,c(CH3COO-)减小,B不正确;C.在pH=4.76的溶液中入HCl,HCl电离使溶液中c(H+)增大,CH3COOH的电离平衡逆向移动,所以α(CH3COOH)增大,α(CH3COO-)减小,根据物料守恒可知,α(CH3COOH)+
α(CH3COO-)=1,C正确,D.根据质子守恒可知,对于图象中曲线上任意一点所对应的溶液中,都有c(CH3COO-)+c(OH-)=c(H+),D正确。本题选B。
11.室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1 CH3COOH溶液,曲线如图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较正确的是 ( )
A.在A、B间任一点,溶液中一定都有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1
【解析】选A。在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,
11
根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;在B点溶液显中性,则c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;在C点,溶液显酸性,故有c(OH-)c(S)
C.pH=7的溶液中:c(Na+)=c(HS)+2c(S)
D.1 moI·L-1的NaHSO3溶液中存在:c(H2SO3)=c(H+)+c(OH-)+c(S)
【解析】选C。A.由图象可知,a表示HS物质的量分数随溶液pH变化的曲线,A错误;B.a表示HS物质的量分数随溶液pH变化的曲线,b表示S物质的量分数随溶液pH变化的曲线,由图象可知,pH=8时的溶液中,c(HS)c(HT-)>c(H+)>c(H2T)>c(T2-)
C.V(NaOH)=30 mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+)
D.V(NaOH)=40 mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
【解析】选D。A项,V(NaOH)=10 mL时,反应前n(H2T)∶n(NaOH)=2∶1,根据物料守恒,有2c(Na+)=c(H2T)+c(HT-)+c(T2-);B项,V(NaOH)=20 mL时,反应前n(H2T)∶n(NaOH)=1∶1,反应后得到含2×10-3mol NaHT的溶液,此时溶液呈酸性,HT-的电离程度大于水解程度,则c(Na+)>c(HT-)>c(H+)>c(T2-)>c(H2T);
C项,V(NaOH)=30 mL时,反应后得到均含1×10-3mol NaHT和Na2T的混合溶液,此时溶液呈酸性,NaHT的电离程度大于Na2T的水解程度,则c(Na+)>c(T2-)
>c(HT-)>c(H+)>c(OH-);D项,V(NaOH)=40 mL时,反应后得到含2×10-3mol Na2T的溶液,根据质子守恒有c(OH-)=c(HT-)+2c(H2T)+c(H+)。
14.常温下,向1 L pH=10的NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述不正确的是 ( )
A.a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B.b点溶液中:c(H+)=1×10-7 mol·L-1
11
C.c点溶液中:c(Na+)>c(C)>c(HC)
D.d点溶液中:c(Na+)+c(H+)=2c(C)+c(HC)+c(OH-)
【解析】选B。a点是没有通入CO2的情况,即pH=10的NaOH溶液,则c(H+)=1×
10-10 mol·L-1,而氢离子来源于水的电离,所以水电离出的c(H+)=10-10mol·L-1,故A说法正确;b点是强碱溶液,对水的电离起抑制作用,所以溶液中c(H+)<1×
10-7 mol·L-1,故B说法错误;c点,水电离出的c(OH-)达到最大,此时的溶质为Na2CO3,C水解:C+H2OHC+OH-,水解的程度微弱,即离子浓度大小顺序是c(Na+)>c(C)>c(HC),故C说法正确;根据电荷守恒:c(Na+)+c(H+)
=2c(C)+c(HC)+c(OH-),故D说法正确。
11