- 2021-07-06 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学考前微专题突破练二物质成分的推断非选择题含解析
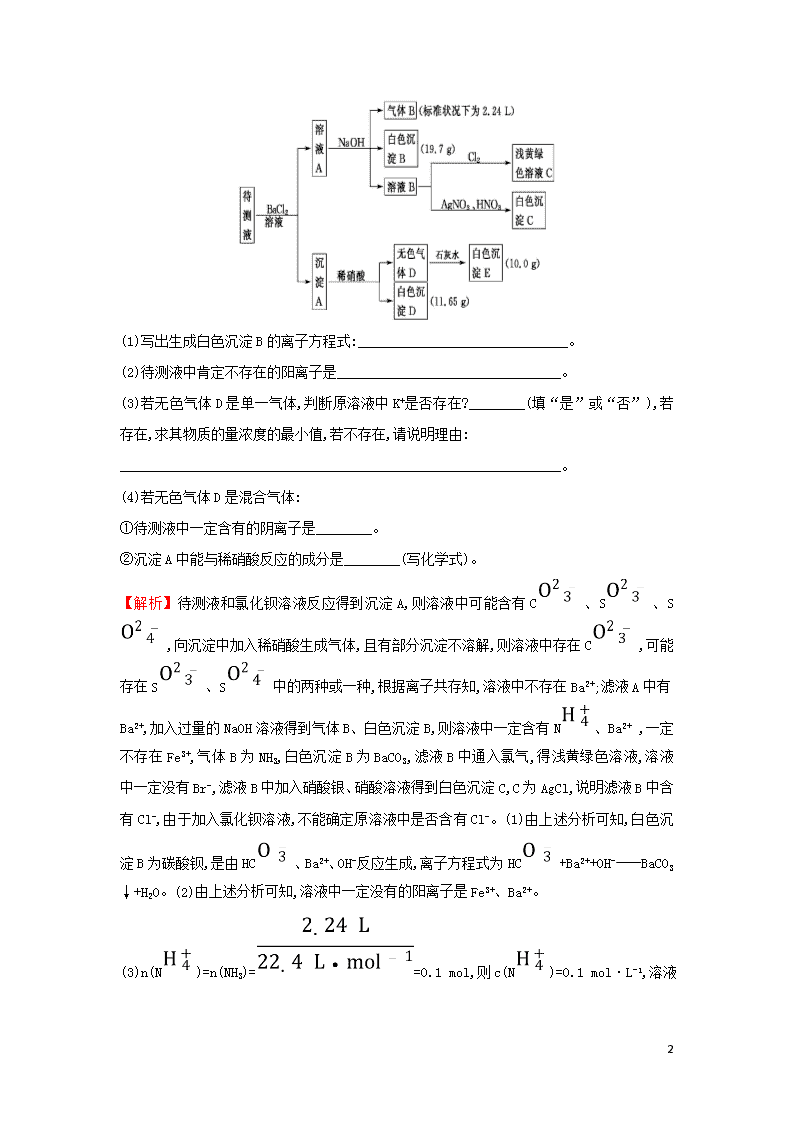
物质成分的推断(非选择题) 1.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验: ①将部分粉末加入水中,振荡,有白色沉淀生成,过滤溶液呈无色; ②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生; ③取少量②的溶液,滴入稀硫酸,有白色沉淀产生; ④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。试根据上述实验事实,回答下列问题: (1)原白色粉末中一定含有的物质是________,一定不含的物质是________,可能含有的物质是________。(以上各种物质均写化学式) (2)写出各步骤中可能发生的离子方程式 __________________________。 【解析】加水溶解,有白色沉淀,过滤滤液呈无色,说明无CuSO4,沉淀为碳酸钡,所以白色粉末中一定有Ba(NO3)2、Na2CO3;向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,沉淀一定为BaCO3;原白色粉末中一定含有的物质是Ba(NO3)2、Na2CO3,一定不含的物质是CuSO4,可能含有的物质是NaCl。 答案:(1)Ba(NO3)2、Na2CO3 CuSO4 NaCl (2)Ba2++CBaCO3↓、BaCO3+2H+Ba2++CO2↑+H2O、S+Ba2+BaSO4↓、 C+2Ag+Ag2CO3↓、Ag++Cl-AgCl↓(合理即可) 2.1 000 mL某待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种: 阳离子 K+、N、Fe3+、Ba2+ 阴离子 Cl-、Br-、C、HC、S、S 现进行如下实验操作(每次实验所加试剂均过量): 10 (1)写出生成白色沉淀B的离子方程式: ____________________________。 (2)待测液中肯定不存在的阳离子是________________________________。 (3)若无色气体D是单一气体,判断原溶液中K+是否存在?________(填“是”或“否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由: _______________________________________________________________。 (4)若无色气体D是混合气体: ①待测液中一定含有的阴离子是________。 ②沉淀A中能与稀硝酸反应的成分是________(写化学式)。 【解析】待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有C、S、S,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在C,可能存在S、S中的两种或一种,根据离子共存知,溶液中不存在Ba2+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有N、Ba2+ ,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-。(1)由上述分析可知,白色沉淀B为碳酸钡,是由HC、Ba2+、OH-反应生成,离子方程式为HC+Ba2++OH-BaCO3↓+H2O。(2)由上述分析可知,溶液中一定没有的阳离子是Fe3+、Ba2+。 (3)n(N)=n(NH3)==0.1 mol,则c(N)=0.1 mol·L-1, 10 溶液中c(Na+)=0.2 mol·L-1,c(HC)=0.1 mol·L-1,c(C)=0.1 mol·L-1,c(S)= 0.05 mol·L-1,单位体积内正电荷=1×0.1 mol·L-1+1×0.2 mol·L-1=0.3 mol·L-1,单位体积内负电荷=1×0.1 mol·L-1+2×0.1 mol·L-1+2×0.05 mol·L-1=0.4 mol·L-1,单位体积内正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl-,K+浓度最小,根据电荷守恒可知,c(K+)最小=0.4 mol·L-1-0.3 mol·L-1=0.1 mol·L-1。(4)由上述分析可知,溶液中一定含有的阴离子为C、HC,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-。若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有S,不能确定是否含有S,沉淀A中一定含有BaCO3,BaSO3。①待测液中一定含有的阴离子是C、HC、S;②沉淀A中BaSO3能与稀硝酸反应转化为硫酸钡。 答案:(1)Ba2++HC+OH-BaCO3↓+H2O (2)Fe3+、Ba2+ (3)是 0.1 mol·L-1 (4)①C、HC、S ②BaCO3、BaSO3 3.某无色废水中可能含有H+、N、Fe3+、Al3+、Mg2+、Na+、N、C、S中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图象如图所示: Ⅰ: 请回答下列问题: (1)根据上述3组实验可以分析废水中一定不存在的离子有___________。 10 (2)实验③中所发生反应的离子反应方程式为_______________________。 (3)分析图象,在原溶液中c(N)与c(Al3+)的比值为________, N是否存在?________(填“存在”“不存在”或“不确定”)。 Ⅱ:现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复) 阳离子 H+、Na+、Al3+、Ag+、Ba2+ 阴离子 OH-、Cl-、C、N、S 已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性; ②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生; ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀; ④上述沉淀包括难溶物和微溶物。 试回答下列问题: (1)A溶液呈碱性的原因是 ______________________________ (用离子方程式表示)。 (2)D是________溶液,E是________溶液(均写化学式)。 【解析】Ⅰ.(1)无色废水中确定无Fe3+,根据实验①确定有Na+,根据实验②确定有S,根据实验③确定有Al3+、N、H+,一定不含Fe3+、Mg2+,因为C与Al3+不能共存,所以无C;故溶液中存在的离子为Na+、Al3+、N、H+、S,废水中一定不存在的离子有Fe3+、Mg2+、C。(2)实验③中依次发生的离子反应有酸碱中和:H++OH-H2O,生成沉淀:Al3++3OH-Al(OH)3↓,生成一水合氨: N+OH-NH3·H2O,氢氧化铝能溶于氢氧化钠中,即Al(OH)3+OH- Al+2H2O。(3)已知硫酸钡沉淀为2.33 g,则n(S)==0.01 mol, 根据图象可知与Al(OH)3反应的n(OH-)=0.007 mol, Al(OH)3 + OH-Al+2H2O n(Al3+) 0.007 mol 10 所以n(Al3+)=0.007 mol,将铝离子完全沉淀需要氢氧化钠0.021 mol,溶液中H+消耗氢氧化钠0.014 mol,氢离子的物质的量是0.014 mol,N+OH-NH3·H2O,消耗氢氧化钠0.007 mol,所以铵根离子的物质的量是0.007 mol,原溶液中c(N)与c(Al3+)的比值为1∶1,根据电荷守恒,一定存在硝酸根离子。 Ⅱ.①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3。(1)A为碳酸钠溶液,因碳酸根离子的水解溶液显碱性,水解离子反应式为C+H2OHC+OH-。(2)D是AgNO3,E为Al2(SO4)3。 答案:Ⅰ.(1)Fe3+、Mg2+、C (2)H++OH-H2O、 Al3++3OH-Al(OH)3↓、 N+OH-NH3·H2O、 Al(OH)3+OH-Al+2H2O (3)1∶1 存在 Ⅱ.(1)C+H2OHC+OH- (2)AgNO3 Al2(SO4)3 4.某强酸性溶液X含有Ba2+、Al3+、N、Fe2+、Fe3+、C、S、S、Cl-、N中的一种或几种,取该溶液进行实验,实验内容如下: 根据以上信息,回答下列问题: 10 (1)溶液X中除H+外还肯定含有的离子是________; (2)写出有关离子方程式:步骤①中生成A________;步骤②生成沉淀I________。 (3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量为0.07 mol,能说明该溶液不能确定阴离子存在的理由是_________。 【解析】在酸性溶液中不能含有挥发性的弱酸的酸根离子C、S,向某强酸性溶液X中加入过量Ba(NO3)2溶液,产生气体A能够与O2发生反应产生气体D,D与O2及H2O发生反应产生溶液E,则证明在溶液中含有还原性离子Fe2+;向产生的溶液B中加入过量的NaOH溶液产生气体F,证明含有N;沉淀G中一定含有Fe(OH)3,向所得的溶液H中通入过量的CO2气体,能够产生沉淀I,说明原溶液中含有Al3+,当加入过量NaOH溶液时变为Al,当通入过量的CO2气体时发生离子反应生成沉淀Al(OH)3同时还生成HC;向原溶液中加入过量Ba(NO3)2溶液,产生沉淀C,则证明含有S。 (1)溶液X中除H+外还肯定含有的离子是Al3+、N、Fe2+、S; (2)步骤①中发生氧化还原反应,生成A的离子方程式是3Fe2++N+4H+3Fe3++NO↑+2H2O;步骤②生成沉淀Ⅰ的离子方程式是Al+CO2+2H2OAl(OH)3↓+HC; (3)n(S)=0.07 mol;n(N)=0.01 mol;n(Al3+)=0.01 mol;n(H+)=0.04 mol; n(NO)=0.01 mol;根据离子方程式3Fe2++N+4H+3Fe3++NO↑+2H2O中NO与Fe2+的物质的量的关系可知:n(Fe2+)=0.03 mol,可见此时溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等,因此若溶液中不存在Fe3+,就无Cl-存在;若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等。 答案:(1)Al3+、N、Fe2+、S (2)3Fe2++N+4H+3Fe3++NO↑+2H2O Al+CO2+2H2OAl(OH)3↓+HC (3)若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等 5.1 L某混合溶液,可能含有的离子如表格。 可能大量含有的阳离子 H+、K+、Mg2+、Al3+、N、Fe2+、Fe3+ 10 可能大量含有的阴离子 Cl-、Br-、I-、C、Al (1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。 则该溶液中一定不含有的离子是_________________________________。 (2)BC段离子方程式为_________________________________________。 (3)V1、V2、V3、V4之间的关系为__________________________________。 【解析】(1)根据图表,开始加入NaOH时,无沉淀产生,则说明溶液中含有H+,随后加入NaOH,有沉淀产生,沉淀量达到最大时继续加入NaOH,沉淀量先保持不变后完全溶解,则说明一定含有Al3+、N,一定不含Mg2+、Fe2+、Fe3+。根据离子共存知识,C、Al与H+、Al3+不能共存,故一定不含C、Al。因此溶液中一定不含的离子为Mg2+、Fe2+、Fe3+、C、Al。(2)BC段的离子反应为N与OH-的反应。(3)V1至V2段的反应为Al3++3OH-Al(OH)3↓、V3至V4段的反应为Al(OH)3+OH-Al+2H2O,两段消耗的NaOH的物质的量之比为3∶1,即V2-V1=3(V4-V3)。 答案:(1)Mg2+、Fe2+、Fe3+、C、Al (2)N+OH-NH3·H2O (3)V2-V1=3(V4-V3) 6.凤凰石是一种用于建材装饰的硅酸盐矿物,已知某地出产的凤凰石可看作由主要成分硅酸铜盐X·3H2O(摩尔质量=334 g·mol-1)与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液Ⅱ中滴入KSCN溶液显红色。 请回答: 10 (1)杂质Y中除氧以外还含有的元素为________(填元素符号),X的化学式为____________。 (2)如果向溶液Ⅱ中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所导致,写出反应的离子方程式: _____________________。 【解析】(1)溶液Ⅱ中含有Fe3+,X·3H2O是硅酸铜盐,X、Y的混合物加入足量盐酸,生成二氧化碳,所以Y中除氧以外还含有的元素为Fe、C;生成氯化铜的物质的量为27 g÷135 g·mol-1=0.2 mol;二氧化硅的物质的量为12 g÷60 g·mol-1= 0.2 mol,即n(Cu)∶n(Si)=1∶1,则X的化学式可表示为(CuO·SiO2)n,X·3H2O的摩尔质量为334 g·mol-1,X的摩尔质量为280 g·mol-1,n=280÷140=2,X的化学式为2CuO·2SiO2或Cu2Si2O6。(2)分析可知,Y中的Fe3+具有氧化性,其将H2O2氧化的离子方程式为2Fe3++H2O22Fe2++2H++O2↑。 答案:(1)Fe、C Cu2Si2O6或2CuO·2SiO2 (2)2Fe3++H2O22Fe2++2H++O2↑ 7.M、E是人类使用最早、应用最广泛的两种常见金属。 请回答下列问题: (1)写出图中M→MSO4的化学方程式 ___________________________。 (2)将酸化的X溶液滴加到盛有H2O2溶液的试管中,发生反应的离子方程式为 ___________________________________________________________; 一段时间后,某同学发现试管中有气泡出现,管壁发热,随后还有沉淀生成。则沉淀的化学式为____________________________。 【解析】根据MSO4为蓝色溶液,可以推断M为Cu,MSO4为CuSO4,E为Fe,X为FeSO4,Y为Fe2(SO4)3。一段时间后,因为2H2O22H2O+O2↑,所以气泡为O2,沉淀为Fe(OH)3。 答案:(1)2Cu+2H2SO4+O22CuSO4+2H2O (2)2Fe2++H2O2+2H+2Fe3++2H2O Fe(OH)3 8.固体粉末X中含有K2SO3、K2CO3、FeO、MnO2等物质,现取X进行连续实验,实验过程如下: 10 请回答下列问题: (1)气体C的主要成分是________(填化学式)。 (2)溶液B中存在的所有阳离子是 _______________________________。 (3)沉淀甲中加浓盐酸产生气体A的离子方程式是 _________________。 【解析】根据流程图,因FeO、MnO2不溶于水,则沉淀甲含有FeO和MnO2;沉淀甲中加入足量浓盐酸加热,MnO2与之反应生成MnCl2和Cl2,FeO与盐酸反应生成FeCl2;溶液B中加入KSCN后会出现红色溶液,则溶液B中一定含有Fe3+;滤液乙中含有K2SO3和K2CO3,加入足量稀盐酸,生成气体C,则气体C是SO2和CO2。 答案:(1)SO2、CO2 (2)H+、Mn2+、Fe3+、Fe2+ (3)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 9.下图为某工厂处理含Fe3+、Cu2+、Ag+废水的流程图: 据图回答下列问题: (1)操作①中发生反应的离子方程式为 ______________________________________________、 ______________________________________________、 ______________________________________________。 (2)操作②中H2O2起了________剂(填“氧化”或“还原”)的作用。 (3)操作③中产生的沉淀为________(填化学式)。 10 (4)操作④中通入的X气体为________(填化学式)。 【解析】向含Fe3+、Cu2+、Ag+的废水中加入过量的铁屑,发生的反应依次是2Ag++Fe2Ag+Fe2+、2Fe3++Fe3Fe2+、Cu2++FeFe2++Cu,所以得到的沉淀是Fe和Cu的混合物,滤液中的阳离子只有Fe2+。加入H2O2具有强氧化性,能够将Fe2+氧化成Fe3+,加入过量的生石灰发生的反应为CaO+H2OCa(OH)2, 2Fe3++3Ca(OH)22Fe(OH)3↓+3Ca2+,滤液中含有过量的Ca(OH)2,通入适量CO2将其转化成难溶性的CaCO3沉淀,即可消除污染,达到排放的目的。 答案:(1)Cu2++FeFe2++Cu 2Ag++Fe2Ag+Fe2+ 2Fe3++Fe3Fe2+ (2)氧化 (3)Fe(OH)3 (4)CO2 10查看更多