- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届河北省定州中学高二(承智班)上学期期中考试(2017
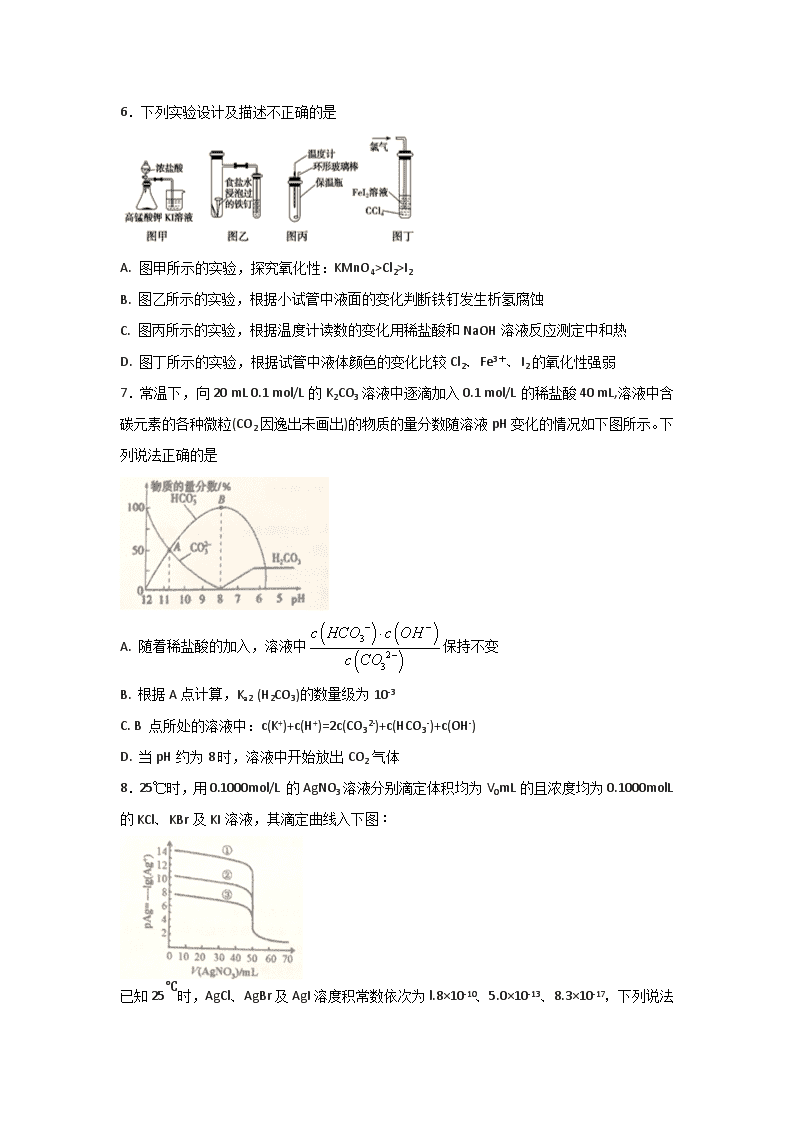
河北定州中学2017—2018学年度第一学期期中考试 高二年级承智班化学试卷 一、选择题 1.历史上最早应用的还原性染料是靛蓝,春秋时期,我国人民已能从蓝草中提取这种染料,比欧洲早1500多年。靛蓝的结构简式如图,下列关于靛蓝的叙述错误的是 () A. 靛蓝由碳、氢、氧、氮4种元素组成 B. 它的分子式是C16H10N2O2 C. 分子中所有原子都能共平面 D. 该物质属于环状化合物 2.CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是 () A. 2,3-二甲基-4-乙基戊烷 B. 2-甲基-3,4-二乙基戊烷 C. 2,5-二甲基-3-乙基己烷 D. 2,4-二甲基-3-乙基已烷 3.下列物质的溶液加热蒸干、灼烧后,所得的固体成份不相同的是 A. FeCl2、FeCl3 B. NaHCO3、Na2CO3 C. Al2(SO4)3、AlCl3 D. Mg(HCO3)2、MgCl2 4.下列叙述正确的是 ( ) A. SO2的水溶液能导电,所以SO2是电解质 B. 酸式盐的水溶液呈酸性 C. 醋酸的电离程度随温度的升高而增大 D. 凡是强酸和碱生成的盐,其水溶液呈中性 5.1.52g铜镁合金完全溶解于50mL密度为1.40g•mL﹣1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0mol•L﹣1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是 A. 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L﹣1 C. NO2和N2O4的混合气体中,NO2的体积分数是80% D. 该合金中铜与镁的物质的量之比是1:2 6.下列实验设计及描述不正确的是 A. 图甲所示的实验,探究氧化性:KMnO4>Cl2>I2 B. 图乙所示的实验,根据小试管中液面的变化判断铁钉发生析氢腐蚀 C. 图丙所示的实验,根据温度计读数的变化用稀盐酸和NaOH溶液反应测定中和热 D. 图丁所示的实验,根据试管中液体颜色的变化比较Cl2、Fe3+、I2的氧化性强弱 7.常温下,向20 mL 0.1 mol/L的K2CO3溶液中逐滴加入0.1 mol/L的稀盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是 A. 随着稀盐酸的加入,溶液中保持不变 B. 根据A点计算,Ka2 (H2CO3)的数量级为10-3 C. B 点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) D. 当pH约为8时,溶液中开始放出CO2气体 8.25℃时,用0.1000mol/L的AgNO3溶液分别滴定体积均为V0mL的且浓度均为0.1000molL的KCl、KBr及KI溶液,其滴定曲线入下图: 已知25℃时,AgCl、AgBr及AgI溶度积常数依次为l.8×10-10、5.0×10-13、8.3×10-17, 下列说法正确的是 A. V0= 45.00 B. 滴定曲线①表示KCl的滴定曲线 C. 滴定KCl时,可加入少量的KI作指示剂 D. 当AgNO3溶液滴定至60.00mL 时,溶液中 c(I-)查看更多