- 2021-08-06 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习能力提升训练12利用综合实验探究元素化合物的性质含解析
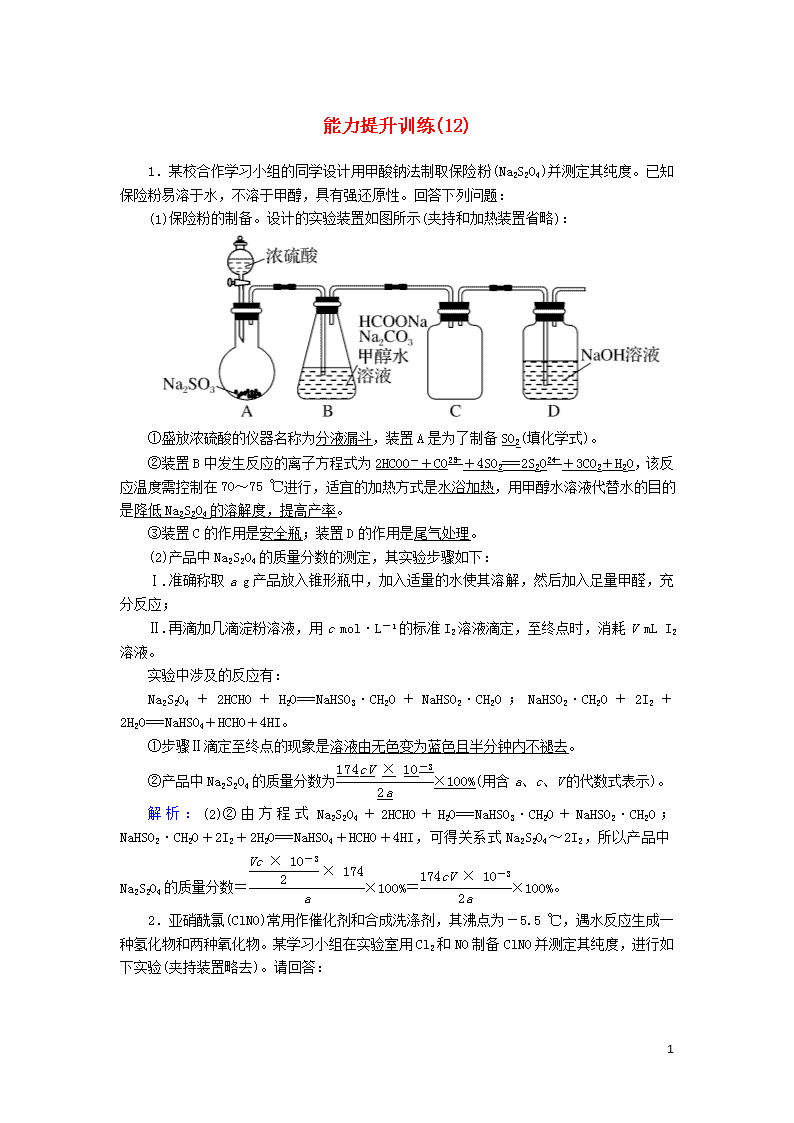
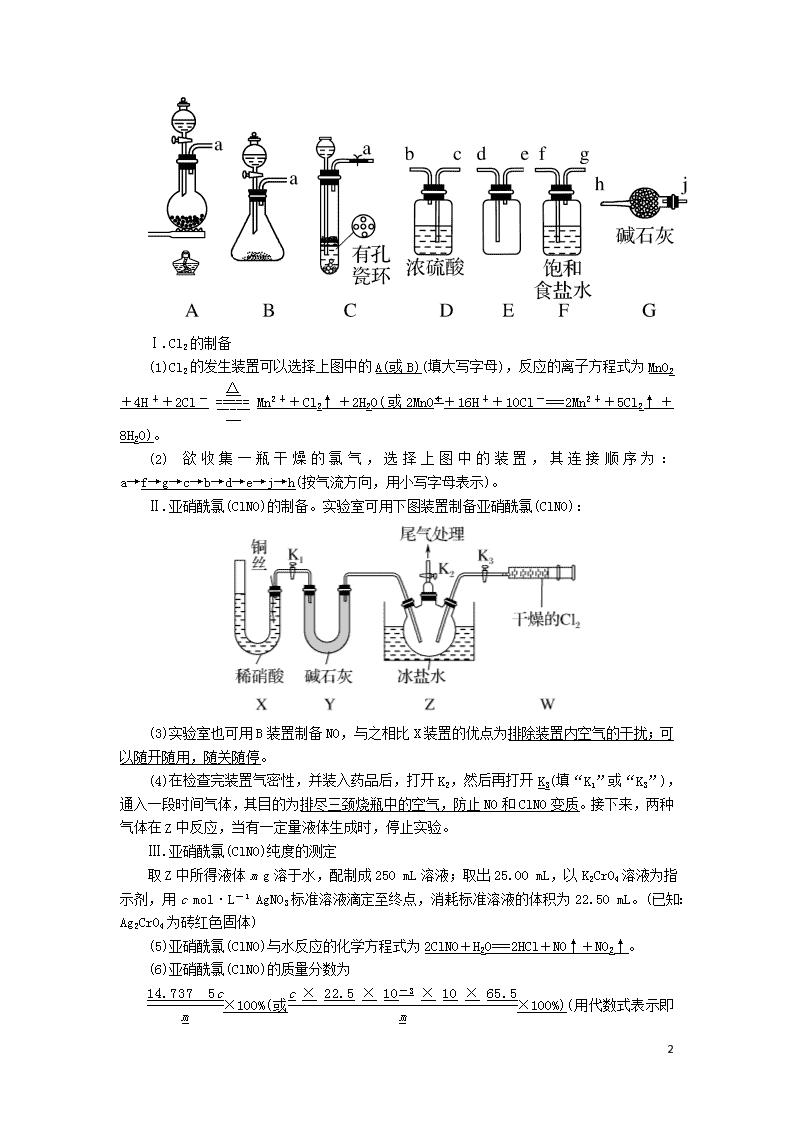
能力提升训练(12) 1.某校合作学习小组的同学设计用甲酸钠法制取保险粉(Na2S2O4)并测定其纯度。已知保险粉易溶于水,不溶于甲醇,具有强还原性。回答下列问题: (1)保险粉的制备。设计的实验装置如图所示(夹持和加热装置省略): ①盛放浓硫酸的仪器名称为分液漏斗,装置A是为了制备SO2(填化学式)。 ②装置B中发生反应的离子方程式为2HCOO-+CO+4SO2===2S2O+3CO2+H2O,该反应温度需控制在70~75 ℃进行,适宜的加热方式是水浴加热,用甲醇水溶液代替水的目的是降低Na2S2O4的溶解度,提高产率。 ③装置C的作用是安全瓶;装置D的作用是尾气处理。 (2)产品中Na2S2O4的质量分数的测定,其实验步骤如下: Ⅰ.准确称取a g产品放入锥形瓶中,加入适量的水使其溶解,然后加入足量甲醛,充分反应; Ⅱ.再滴加几滴淀粉溶液,用c mol·L-1的标准I2溶液滴定,至终点时,消耗V mL I2溶液。 实验中涉及的反应有: Na2S2O4+2HCHO+H2O===NaHSO3·CH2O+NaHSO2·CH2O;NaHSO2·CH2O+2I2+2H2O===NaHSO4+HCHO+4HI。 ①步骤Ⅱ滴定至终点的现象是溶液由无色变为蓝色且半分钟内不褪去。 ②产品中Na2S2O4的质量分数为×100%(用含a、c、V的代数式表示)。 解析:(2)②由方程式Na2S2O4+2HCHO+H2O===NaHSO3·CH2O+NaHSO2·CH2O;NaHSO2·CH2O+2I2+2H2O===NaHSO4+HCHO+4HI,可得关系式Na2S2O4~2I2,所以产品中Na2S2O4的质量分数=×100%=×100%。 2.亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5 ℃,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。请回答: 7 Ⅰ.Cl2的制备 (1)Cl2的发生装置可以选择上图中的A(或B)(填大写字母),反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(或2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O)。 (2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a→f→g→c→b→d→e→j→h(按气流方向,用小写字母表示)。 Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO): (3)实验室也可用B装置制备NO,与之相比X装置的优点为排除装置内空气的干扰;可以随开随用,随关随停。 (4)在检查完装置气密性,并装入药品后,打开K2,然后再打开K3(填“K1”或“K3”),通入一段时间气体,其目的为排尽三颈烧瓶中的空气,防止NO和ClNO变质。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。 Ⅲ.亚硝酰氯(ClNO)纯度的测定 取Z中所得液体m g溶于水,配制成250 mL溶液;取出25.00 mL,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50 mL。(已知:Ag2CrO4为砖红色固体) (5)亚硝酰氯(ClNO)与水反应的化学方程式为2ClNO+H2O===2HCl+NO↑+NO2↑。 (6)亚硝酰氯(ClNO)的质量分数为 ×100%(或×100%) 7 (用代数式表示即可)。 解析:(1)实验室制取氯气可以利用二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,则发生装置可以选择题图中的A,反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;也可以利用高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气和水,则装置可以选择题图中的B,反应的离子方程式为2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。(2)制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是大气污染物,要进行尾气处理,可利用碱石灰作吸收剂进行尾气处理,故装置的连接顺序为:a→f→g→c→b→d→e→j→h。(3)实验室也可用B装置制备NO,与之相比X装置的优点为排除装置内空气的干扰;可以随开随用,随关随停。(4)在检查完装置气密性,并装入药品后,打开K2,然后再打开K3,通入一段时间气体,其目的为排尽三颈烧瓶中的空气,防止NO和ClNO变质。(5)亚硝酰氯(ClNO)与水反应生成盐酸、一氧化氮和二氧化氮,反应的化学方程式为2ClNO+H2O===2HCl+NO↑+NO2↑。(6)取Z中所得液体m g溶于水,25.00 mL溶液中n(ClNO)=n(Cl-)=n(Ag+)=c mol·L-1×22.50 mL×10-3 L·mL-1=0.022 5c mol,亚硝酰氯(ClNO)的质量分数为×100%=×100%。 3.某化学课外活动小组通过实验研究NO2的性质。 已知:2NO2+2NaOH===NaNO3+NaNO2+H2O 任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。 (1)A和E中制取NH3的装置为A,所用试剂为浓氨水和CaO(合理即可)。装置中制取NO2的化学方程式是 Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。 (2)若NO2能够被NH3还原,预期观察到C装置中的现象是混合气体颜色变浅。 (3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是 ①NH3还原性较弱,不能将NO2还原; ②在此条件下,NO2的转化率极低; ③在此条件下,该反应的化学反应速率极慢。 7 (4)此实验装置存在一个明显的缺陷是缺少尾气吸收装置。 任务2:探究NO2能否与Na2O2发生氧化还原反应。 (5)实验前,该小组同学提出三种假设。 假设1:两者不反应; 假设2:NO2能被Na2O2氧化; 假设3:NO2能被Na2O2还原(其他合理答案也可)。 (6)为了验证假设2,该小组同学选用任务1中的、B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。 ①装置的合理连接顺序是(某些装置可以重复使用)EDBDF。 ②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为2NO2+Na2O2===2NaNO3。 解析:(1)干燥氨气不能用无水氯化钙,因而A为氨气发生装置,E为二氧化氮发生装置;固液反应制取氨气,要用浓氨水。(2)若NO2能够被NH3还原,则混合气体的颜色将变浅,氨气被二氧化氮氧化生成氮气和水。(3)实验过程中,未能观察到C装置中的预期现象,说明二氧化氮反应的量很少,可能是反应速率较低,或者二氧化氮的转化率较低。(4)氮氧化物为有毒气体不能直接排放到空气中。(5)Na2O2既有氧化性又有还原性,NO2中的氮元素为+4价,既可能表现氧化性,也可能表现还原性。(6)①验证假设2,首先要制取二氧化氮,因为水能和过氧化钠反应,所以要除去水的干扰,再使二氧化氮气体通过过氧化钠,最后要进行尾气处理;②过氧化钠变成白色固体且为纯净物,根据氧化还原反应中元素化合价的变化确定生成物。 4.(2019·云南七校适应性考试)某化学兴趣小组利用如图装置制取氯气并探究其有关性质。 7 (1)装二氧化锰的仪器的名称是圆底烧瓶。 (2)正确连接装置后,如何检验A装置的气密性用止水夹夹住A、B之间的橡胶管,打开A装置中分液漏斗的活塞与旋塞,向其中注水。若一段时间后,液体不再滴下,说明气密性良好;反之,则气密性差。 (3)室温下,将多余的Cl2用100 mL 1.7 mol·L-1的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测得其pH等于13(不考虑反应前后溶液的体积变化),ClO-和ClO的物质的量浓度之比为5∶1。请回答: ①吸收氯气消耗的NaOH的物质的量为0.16 mol。 ②被氧化的氯气的物质的量为0.03 mol。 (4)通二氧化硫和氯气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。 ①试分析甲同学实验过程中,品红溶液不褪色的原因:控制SO2和Cl2按物质的量之比1∶1进气,其涉及反应的离子方程式为SO2+Cl2+2H2O===SO+2Cl-+4H+。 ②你认为乙同学是怎样做到让品红溶液变得越来越浅的?控制SO2和Cl2进气的物质的量,使之不相等。 (5)下列装置可用于尾气处理的是(夹持仪器已略去)d(填序号)。 (6)请你帮该小组同学设计一个实验,证明装置B中的Na2SO3已被氧化:取少量B中溶液于试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴加氯化钡溶液,若产生白色沉淀,则证明B中的亚硫酸钠已被氧化(其他合理答案均可)。 解析:(2)用止水夹夹住A、B之间的橡胶管,打开A装置中分液漏斗的活塞与旋塞,向其中注水。若一段时间后,液体不再滴下,说明气密性良好;反之,则气密性差。(3)①反应前NaOH的物质的量为0.1 L×1.7 mol·L-1=0.17 mol,反应后溶液pH等于13,则反应后氢氧化钠的物质的量浓度为0.1 mol·L-1,故反应后NaOH的物质的量为0.1 L×0.1 mol·L-1=0.01 mol,吸收氯气消耗的NaOH的物质的量为0.17 mol-0.01 mol=0.16 mol。②ClO-和ClO的物质的量浓度之比为5∶1,发生的反应为8Cl2+16NaOH===5NaClO+NaClO3+10NaCl+8H2O,则反应掉的氯气的物质的量为0.16 mol×=0.08 mol,其中被氧化的氯气生成ClO-和ClO,物质的量为0.08 mol×=0.03 mol。(4)①氯气、二氧化硫和水反应生成盐酸和硫酸,盐酸和硫酸没有漂白性,所以控制SO2和Cl2按物质的量之比1∶1进气,反应的离子方程式为:SO2+Cl2+2H2O===SO+2Cl-+4H+。②让氯气或二氧化硫过量可使品红溶液变得越来越浅,所以控制SO2和Cl2 7 进气的物质的量,使之不相等。(5)广口瓶密闭,且导管没有伸入液面下,故a错误;食盐水不能与二氧化硫和氯气反应,且导管没有伸入液面下,故b错误;浓硫酸不能用来吸收SO2、Cl2,故c错误;二氧化硫和氯气都能与氢氧化钠溶液反应,且该装置可防倒吸,所以该装置可用于SO2、Cl2的尾气处理,故d正确。(6)证明Na2SO3已被氧化相当于检验B中溶液中存在硫酸根离子,实验方法为取少量B中溶液于试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴加氯化钡溶液,若产生白色沉淀,则证明B中的亚硫酸钠已被氧化。 5.(2019·郑州质量预测)中学教材显示“浓硫酸具有吸水性、脱水性、强氧化性,能使铁钝化”。某学习小组对“具有该四个特性的浓硫酸的浓度范围”进行了以下实验探究。 (1)配制不同浓度的硫酸 用18.4 mol·L-1的浓硫酸配制不同浓度的硫酸。下列操作正确的是BC。 (2)浓硫酸的吸水性、脱水性、钝化与浓度的关系 ①浓硫酸的吸水性:各取0.5 g胆矾颗粒于试管中,分别加入3 mL不同浓度的硫酸。 ②浓硫酸的脱水性:各取一根木柴梗于试管中,分别加入1 mL不同浓度的硫酸。 ③浓硫酸的钝化:各取约1 cm经过砂纸打磨过的铁丝,再向试管中加入3 mL不同浓度的硫酸。 实验结果如表: 结合表格中的数据回答下列问题: 用化学方程式表示胆矾由“蓝→白”的原因: CuSO4·5H2O===CuSO4+5H2O;当硫酸的浓度≥6 mol·L-1时即具有脱水性。 (3)浓硫酸的强氧化性与浓度的关系 在试管中分别加入1小块铜片,再向试管中分别加入2 mL 不同浓度的硫酸,用如图所示的装置进行实验。(夹持仪器略去) 7 ①b装置的作用是安全瓶(或防止液体倒吸入试管a)。 ②本实验中证明浓硫酸具有强氧化性的现象是铜片溶解、表面产生气泡,品红溶液褪色。 ③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式5Cu+4H2SO4(浓)Cu2S↓+3CuSO4+4H2O。 ④经过实验发现:c(H2SO4)≥6 mol·L-1时,硫酸与铜在加热反应时硫酸即可表现强氧化性。 有同学预测,铜片与5 mol·L-1的硫酸在长时间持续加热时,也会发生反应。该预测的理由是长时间加热时,水分蒸发,使硫酸浓度增大。 (4)综合该小组同学的探究结果,中学教材中同时具有吸水性、脱水性、强氧化性,使铁钝化的浓硫酸的浓度范围为c(H2SO4)≥12 mol·L-1。 解析:(1)量取浓硫酸时视线应与液体凹液面相平,A项错误;稀释浓硫酸时,将浓硫酸注入水中,并用玻璃棒不断搅拌,B项正确;转移溶液时,用玻璃棒引流,C项正确;定容时,胶头滴管不能伸入容量瓶中,D项错误。(2)胆矾由蓝变白是因为失去结晶水,化学方程式为CuSO4·5H2O===CuSO4+5H2O。火柴梗变黑是浓硫酸的脱水性所致,根据题表中的数据,当硫酸的浓度≥6 mol·L-1时具有脱水性。(3)①a装置为SO2的发生装置,b装置为安全瓶,作用是防止液体倒吸入试管a。②可通过铜片溶解,有SO2生成来证明浓硫酸具有强氧化性。③根据得失电子守恒、原子守恒,配平该化学方程式为5Cu+4H2SO4(浓)Cu2S↓+3CuSO4+4H2O。④硫酸的沸点高,不易挥发,长时间加热时,水分蒸发,会使硫酸浓度增大,因此长时间持续加热时5 mol·L-1的硫酸与铜也会发生反应。(4)实验①为探究浓硫酸吸水性的实验,硫酸浓度大于等于11 mol·L-1时具有吸水性;实验②为探究浓硫酸脱水性的实验,硫酸浓度大于等于6 mol·L-1时具有脱水性;实验③为探究浓硫酸钝化的实验,硫酸浓度大于等于12 mol·L-1时使铁钝化。浓硫酸具有强氧化性时要求硫酸浓度大于等于6 mol·L-1。故同时具有吸水性、脱水性、强氧化性、使铁钝化的浓硫酸的浓度范围为c(H2SO4)≥12 mol·L-1。 7查看更多