- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省滁州市民办高中2019-2020学年高一上学期期末考试化学试题
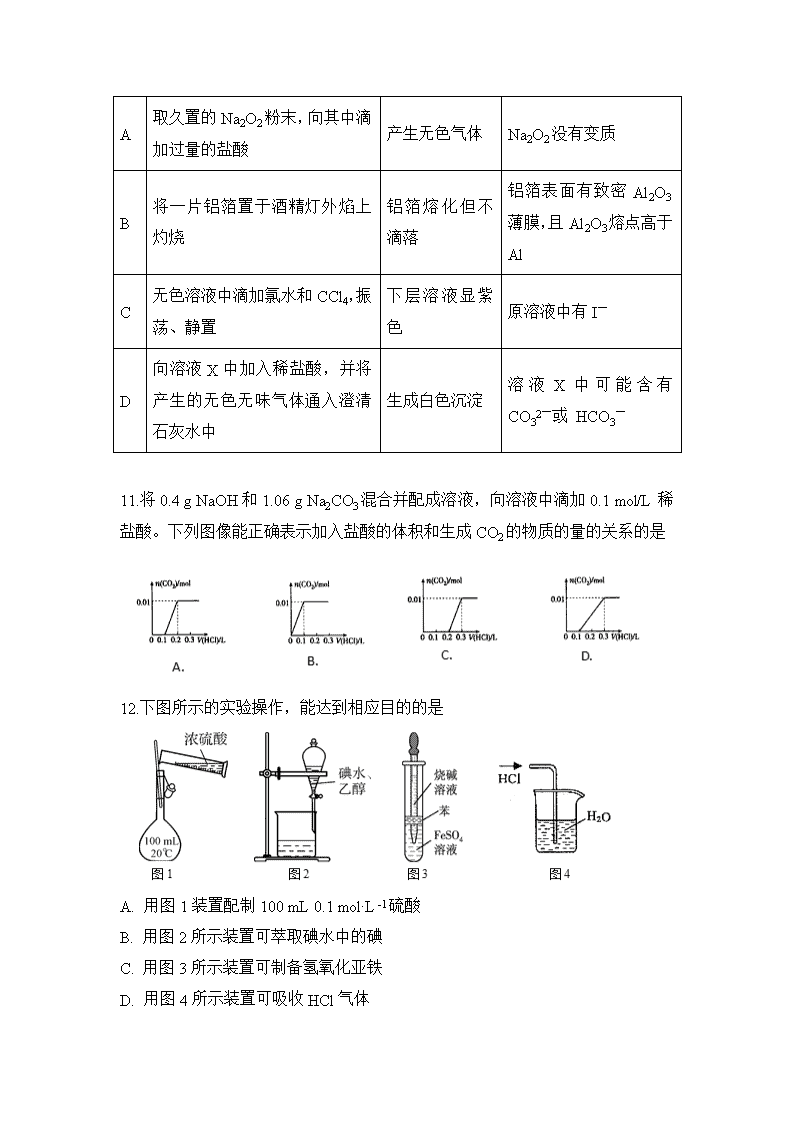
滁州市民办高中2019-2020学年度上学期期末试卷 高一化学试题 注意事项: 1.答题前在答题卡、答案纸上填写好自己的姓名、班级、考号等信息 2.请将选择题答案用2B铅笔正确填写在答题卡上;请将非选择题答案黑色中性笔正确填写在答案纸上。 第I卷(共 48分) 一、选择题(本题共16小题,每小题3分,共48分。) 1.下列化学物质在生活、生产的运用描述不正确的是 A. 氢氧化钠能与二氧化硅反应,故常用氢氧化钠在玻璃上进行刻画 B. 工业上常用氨气来检查氯气管道是否泄漏 C. 氧化铝俗名刚玉,耐磨,常用于做轴承材料 D. 钠和鉀的合金呈液态,常做核反应堆的导热剂 2.已知NA为阿伏加德罗常数的数值,下列说法正确的是 A. 56g铁在足量氧气中燃烧,转移的电子数为2NA B. lg氢气含有NA个氢气分子 C. 标准状况下,22.4L水含有1mol水分子 D. 2mol钠与过量稀盐酸反应生成NA个氢气分子 3.下列离子方程式书写正确的是 A. 实验室用大理石和稀盐酸制取CO2:2H++CO===CO2↑+H2O B. 碳酸氢钠与烧碱溶液反应:H++CO+OH-===CO+H2O C. 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO===BaSO4↓ D. 醋酸跟KOH溶液反应:CH3COOH+OH-===CH3COO-+H2O 4.比较法经常应有于碳酸盐与碳酸氢盐的性质学习中。下列说法中正确的是 A. 热稳定性:Na2CO3< NaHCO3 B. 溶解度:K2CO3> KHCO3 C. 溶液的碱性:Na2CO3< NaHCO3 D. 与酸反应速率:K2CO3> KHCO3 5.下列实验现象与氧化还原反应有关的是 A. 向碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀 B. 向含有酚酞的氢氧化钠溶液中滴加盐酸,红色褪去 C. 向硅酸钠溶液中通入二氧化碳,产生白色胶状沉淀 D. 硫酸铜溶液中插入铁片,铁片上出现红色物质 6.臭氧O3可以使湿润的淀粉碘化钾试纸变蓝,化学反应式为:KI + O3 + H2O → KOH + I2 + O2(未配平),下列叙述中正确的是 A. O3在反应中被氧化成O2; B. 反应中氧化产物O2与还原产物I2的物质的量之比为1:1 C. 1molO3在反应中得到6mol电子; D. 该反应中的还原产物是KOH 7.将Cl2通入200mL0.5mol·L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1︰2,则通入的Cl2在标准状况下的体积为 A. 0.56L B. 1.68L C. 2.24L D. 1.12L 8.误食NaNO2会导致血红蛋白中的Fe2+氧化为Fe3+而中毒,服用维生素C可以解除NaNO2引起的中毒。下列关于上述中毒、解毒过程的说法中正确的是 A. NaNO2是还原剂 B. 维生素C的还原性强于Fe2+ C. 1×10-3molFe2+被NaNO2氧化为Fe3+时得到1×10-3mol电子 D. 解毒过程中维生素C被还原 9.下列实验操作中,正确的是: A. 为增大气体物质的溶解度,常采取搅拌、加热等措施 B. 用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上 C. 用点燃的方法除去CO2中少量的CO D. 为使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 10.下列实验中,依据实验操作及现象,得出的结论不正确的是 选项 操 作 现 象 结 论 A 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生无色气体 Na2O2没有变质 B 将一片铝箔置于酒精灯外焰上灼烧 铝箔熔化但不滴落 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al C 无色溶液中滴加氯水和CCl4,振荡、静置 下层溶液显紫色 原溶液中有I- D 向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中 生成白色沉淀 溶液X中可能含有 CO32-或 HCO3- 11.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 12.下图所示的实验操作,能达到相应目的的是 A. 用图1装置配制100 mL 0.1 mol·L-1硫酸 B. 用图2所示装置可萃取碘水中的碘 C. 用图3所示装置可制备氢氧化亚铁 D. 用图4所示装置可吸收HCl气体 13.下列实验的现象与对应结论均正确的是 选项 操作 现象 结论 A 在AlCl3溶液中滴加过量氨水 有白色沉淀生成 实验室常用此法制备Al(OH)3 B 常温下将Al片放入浓硝酸中 无明显变化 Al与浓硝酸不反应 C 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化 滴加KSCN溶液,溶液变为红色 该Fe(NO3)2试样已经变质 D 将水蒸气通过灼热的铁粉 粉末变红 铁与水在高温下发生反应 14.下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的的是 A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢 C.用装置丙收集氯气并防止污染空气 D.用装置丁分离二氧化锰和氯化锰溶液 15.SO2既有氧化性又有还原性,还有漂白性。下列对它变化中表现的性质标注正确的是 ① SO2使溴水褪色 (还原性) ② SO2使品红溶液褪色 (漂白性) ③ SO2通入氢硫酸(H2S)产生淡黄色浑浊 (氧化性) ④ SO2使润湿的蓝色石蕊试纸变红 (水溶液酸性) A. 只有①②④ B. 只有③④ C. 只有①③ D. ①②③④ 16.某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是 A. ①和②中发生的反应均为复分解反应 B. 向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 C. 一段时间后②中有胶冻状物质生成 D. 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 第II卷(共 52分) 二、实验题(本题共3小题,共52分) 17.(16分)实验室可用氯酸钾与密度为1.19g•cm﹣3,溶质质量分数为36.5%的浓盐酸反应制取氯气。 I.反应方程式如下:___KClO3+ HCl= KCl+ Cl2↑+ H2O (1)配平方程式,并用双线桥法表示上述反应中电子转移的方向和数目。 (2)若反应中被氧化的盐酸为5mol,则生成的氯气体积为__________(标准状况下)。 II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题: (1)证明氯气和水反应的实验现象为__________,反应的化学方程式是__________。 (2)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是__________,漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是__________。 III.乙同学用上述浓盐酸配置0.100 mol·L-1的稀盐酸480 mL,下列说法正确的是__________。 A.取用240 mL的容量瓶 B.应量取上述浓盐酸的体积为4.2mL C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,所配溶液浓度偏小 D.定容时,仰视刻度线所配溶液浓度偏大 E.量取上述浓盐酸的体积时俯视刻度线所配溶液浓度偏大 18.(18分)铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示: I.回答下列有关问题: (1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。 (2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:_______ ____。检验反应后溶液中还存在Fe3+的试剂是__________。 (3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是____ __,生成1molNa2FeO4转移电子数目为__________。 II.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。 (1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是______; (2)向Fe2+的溶液中滴加NaOH溶液,现象是___________________ 。 (3)欲除去FeCl2中FeCl3选用合适的试剂和分离方法,并写出相应离子方程式:__________。 19.(18分)为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验: (1)仪器a的名称为:__________;在组装好上述实验装置后,在装入药品之前必需的实验操作是________________。 (2)写出A中发生反应的化学方程式____________________。该装置还可以用于实验室制取Cl2,请写出实验室制取Cl2的离子方程式并用单线桥标明电子转移________________。 (3)装置B的作用是____________________。 (4)能说明产物中一定存在CO2气体的实验现象为________________。 (5)质量分数为98%的浓硫酸,其密度为1.84g/ml,该浓硫酸的物质的量浓度为__________,用该硫酸配制500ml 0.5mol/L的稀硫酸,主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要____________,定容时由于俯视刻度线,则对浓度产生的影响为___________ (填“偏大”“偏小”或“无影响”)。 参考答案 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 A D D B D D D B B A C C A B D B 17. I.(1) (2)67.2L II.(1)装置B中的有色布条不褪色、装置C中的有色布条褪色 (2)Cl2+H2O=HCl+HClO 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O CO2+Ca(ClO)2+H2O=CaCO3+2HClO、2HClO═2HCl+O2↑ III. BC 18. I.(1)1-100 (2) 2FeCl3+Cu=2FeCl2+CuCl2 KSCN (3)Fe(OH)3 3NA II.(1)Fe2+ Fe3+ (2)生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色沉淀。 (3)加入过量铁粉,过滤 2Fe3++Fe=3Fe2+ 19. (1)分液漏斗 检查装置的气密性 (2)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O (3)除去混合气体中二氧化硫 (4) C中品红不褪色,D中溶液出现白色沉淀(或浑浊) (5)18.4mol/L 500 mL容量瓶 偏大查看更多