- 2021-08-06 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】湖北省(襄阳五中,夷陵中学,钟祥一中三校)2020届高三6月适应性考试理综
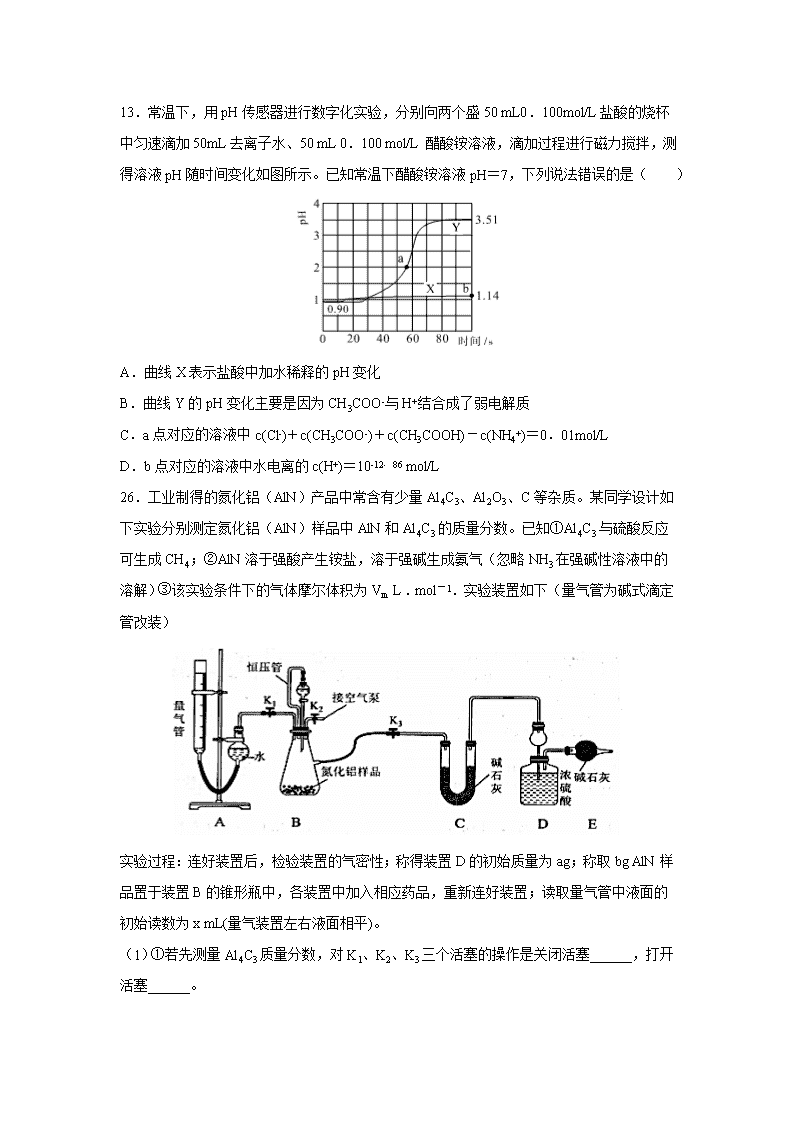
湖北省(襄阳五中,夷陵中学,钟祥一中三校)2020届高三6月适应性考试理综 可能用到的相对原子质量 H 1 C 12 O 16 Al 27 S 32 Mo 96 Ca 40 N 14 7.化学与生活、生产、社会可持续发展密切相关。下列说法错误的是( ) A.牙膏中添加的Na2PO3F、NaF所提供的氟离子浓度相等时,它们防治龋齿的作用相同 B.“光化学烟雾” “臭氧空洞”“硝酸型酸雨”的形成都与氮氧化合物有关 C.用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用 D.碳纳米管比表面积大,可用作新型储氢材料 8.目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说 法正确的是( ) A.①、②、③三步反应均释放能量 B.该反应进程中有两个过渡态 C.第①步反应的活化能最小 D.总反应速率主要由第①步反应决定 9.有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述错误的是( ) A.X中所有原子不可能在同一平面 B.X、Z均能与酸性KMnO4溶液反应 C.Y含有羧基的同分异构体有12种 D.室温下Z与Br2加成的产物最多有3种 10.硝基苯是一种重要有机合成中间体,实验室可用如下反应制备: 。 已知该反应在温度稍高的情况下会生成间二硝基苯。有关数据如下表: 物质 苯 硝基苯 间二硝基苯 浓硝酸 浓硫酸 沸点/℃ 80 211 301 83 338 溶解性 微溶于水 难溶于水 微溶于水 易溶于水 易溶于水 下列说法不正确的是( ) A.分液后的有机层,采用蒸馏的方法可将硝基苯首先分离出来 B.制备硝基苯的反应类型为取代反应 C.该反应温度控制在50~60 ℃的原因是减少反应物的挥发和副产物的生成 D.采用加入NaOH溶液、水洗涤、以及分液的方法可除去粗硝基苯中混有的无机杂质 11.Al—PMOF其结构如图(分子式:C4H9XYZ),可快速将芥子气降解为无毒物质。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法不正确的是( ) A.简单离子半径:Y>Z>X B.最简单氢化物稳定性:X>Z>Y C.含氧酸酸性:Z>Y D.YXZ2中Y的化合价为+4 12.南京大学科学家研究发现了一种电化学“大气固碳”方法电池工作原理示意图如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是( ) A. 该电池放电时的正极反应为:2Li-2e-+CO32-=Li2CO3 B. 该电池既可选用含水电解液,也可选无水电解液 C. 充电时阳极发生的反应是:C+2Li2CO3-4e-=3CO2+4Li+ D. 该电池每放、充4mol电子一次,理论上能固定1molCO2 13.常温下,用pH传感器进行数字化实验,分别向两个盛50 mL0.100mol/L盐酸的烧杯中匀速滴加50mL去离子水、50 mL 0.100 mol/L 醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间变化如图所示。已知常温下醋酸铵溶液pH=7,下列说法错误的是( ) A.曲线X表示盐酸中加水稀释的pH变化 B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质 C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(CH3COOH)-c(NH4+)=0.01mol/L D.b点对应的溶液中水电离的c(H+)=10-12.86 mol/L 26.工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数。已知①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气(忽略NH3在强碱性溶液中的溶解)③该实验条件下的气体摩尔体积为Vm L﹒mol-1.实验装置如下(量气管为碱式滴定管改装) 实验过程:连好装置后,检验装置的气密性;称得装置D的初始质量为ag;称取bg AlN样品置于装置B的锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管中液面的初始读数为x mL(量气装置左右液面相平)。 (1)①若先测量Al4C3质量分数,对K1、K2、K3三个活塞的操作是关闭活塞______,打开活塞______。 ②当____________时,说明反应已经结束。读取读数之前,应对量气管进行的操作为_______________ ;若量气管中的液面高于右侧球形容器中的液面,所测气体体积______(填“偏大”、“偏小”或“无影响”)。 ③记录滴定管的读数为y mL,则Al4C3的质量分数为____________(用可能含a、b、x、y、Vm的代数式表示)。 ④若无恒压管,对所测Al4C3质量分数的影响是______(填“偏大”、“偏小”或“无影响”)。 (2)若先测量AlN质量分数:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量的某物质,写出AlN与过量的某物质发生反应的离子方程式为__________________________ ;反应完成后,__________________________________________(填该步应进行的操作),最后称得装置D的质量为cg,进而测量AlN的质量分数。 27、钼及其化合物正越来越多的受到人们的关注 ,其中钼酸钠(Na2MoO4)可溶于水,是一种重要的金属缓蚀剂;钼酸钙(CaMoO4)微溶于水,常用作钼合金添加剂;钼酸属于弱酸,微溶于水,常用于制取高纯同多酸盐。工业上利用辉钼矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如图所示。 回答下列问题: (1)辉钼矿在空气中焙烧时,加入X是为了减少空气污染,焙烧后Mo元素以CaMoO4存在,则X是___________;焙烧时发生反应的化学方程式为_______________________________。 (2)已知25℃时,钼酸钙的KSP=1.6×10-5,则钼酸钙在该温度下的溶解度为_______g/100g水,但钼酸钙实际溶解度比计算值大许多,其原因是_______________________________。操作2中得到的钼酸钠晶体中常混有Y,进一步提纯钼酸钠晶体的方法为 。 (3)辉钼矿中MoS2含量测定:取辉钼矿0.2500g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体0.1210g(Mr=242g/mol),辉钼矿中MoS2的质量分数不低于___%。 (4)操作3发生反应的离子方程式为__________________________________________。 (5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图2所示。b电极的材料为_______(填“镍”或“钼”),电极反应为________________________________。 28.(15分)“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对工业生产、缓解环境污染、解决能源危机等具有重要意义。 ⑴ 已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol ②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol ③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol CO还原氧化铁的热化学方程式为_______________________。 ⑵ 氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表: 煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为_______________________________________;常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为_______________ 溶液(填化学式)。 ⑶ 一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。 ①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为 (填“a”或“b”),其判断依据是 。 ②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为 。 ⑷ 在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。 ① NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为 mol(结果保留三位有效数字)。 ② 将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图3)。 反应相同时间NOx的去除率随反应温度的变化曲线如图4所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是 ;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是 。 35.【化学-选修3:物质结构与性质】(15分) 早在1913年就有报道说,在400℃以上AgI晶体的导电能力是室温时的上万倍,可与电解质溶液相比。 ⑴ 已知Ag元素的原子序数为47,则Ag元素在周期表中的位置是_____________,属于_____区,基态Ag原子的价电子排布式为__________。 ⑵ 硫代硫酸银(Ag2S2O3)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(Na2S2O3)溶液生成[Ag(S2O3)2]3-等络阴离子。在[Ag(S2O3)2]3-中配位原子是________(填名称),配体阴离子的空间构型是________,中心原子采用________杂化。 ⑶ 碘的最高价氧化物的水化物有HIO4(偏高碘酸,不稳定)和H5IO6(正高碘酸)等多种形式,它们的酸性HIO4__________ H5IO6(填:弱于、等于或强于)。氯、溴、碘的氢化物的酸性由强到弱排序为_______________(用化学式表示),其结构原因是__________________。 ⑷ 在离子晶体中,当0.414查看更多