- 2021-08-06 发布 |
- 37.5 KB |
- 53页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
重庆市2021高考化学一轮复习专题三金属及其化合物第3讲铁及其化合物课件
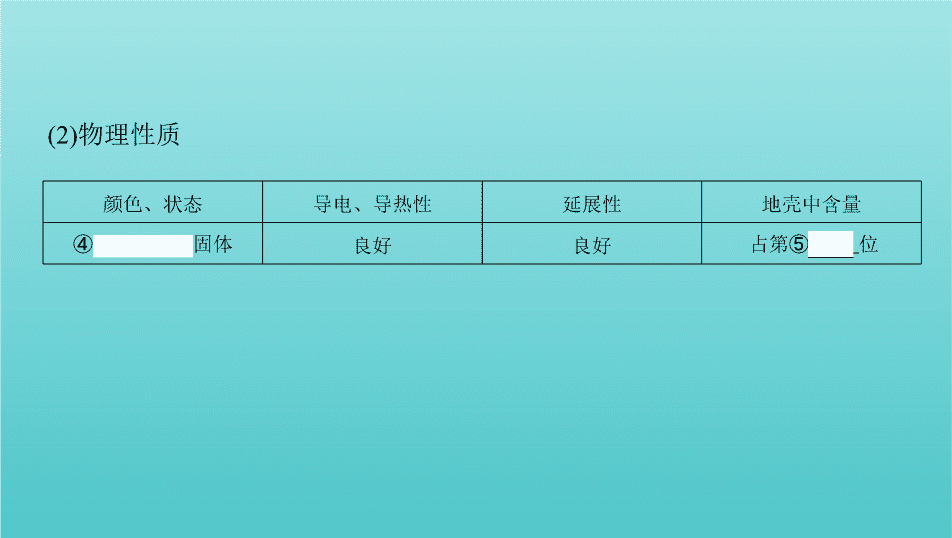
第 3 讲 铁及其化合物 1.铁 (1)铁的原子结构 铁位于元素周期表中第① 四 周期第② Ⅷ 族。 考点一 铁及其重要化合物 颜色、状态 导电、导热性 延展性 地壳中含量 ④ 银白色 固体 良好 良好 占第⑤ 4 位 (2)物理性质 (3)化学性质 2.铁的氧化物 FeO Fe 2 O 3 Fe 3 O 4 俗名 —— 铁红 磁性氧化铁 颜色、状态 黑色粉末 红棕色粉末 黑色晶体(有磁性) 溶解性 难溶于水 难溶于水 难溶于水 铁元素的 化合价 ⑨ +2 ⑩ +3 +2、+3 稳定性 不稳定 稳定 稳定 与H + 反应的 离子方程式 FeO+2H + Fe 2+ +H 2 O Fe 2 O 3 +6H + 2Fe 3+ +3H 2 O Fe 3 O 4 +8H + 2Fe 3+ +Fe 2+ +4H 2 O 3.铁的氢氧化物 Fe(OH) 2 Fe(OH) 3 颜色、状态 白色固体 红褐色固体 与盐酸反应 Fe(OH) 2 +2H + Fe 2+ +2H 2 O Fe(OH) 3 +3H + Fe 3+ +3H 2 O 受热分解 —— 2Fe(OH) 3 Fe 2 O 3 +3H 2 O 制法 新制可溶性亚铁盐与碱溶液隔绝空气反应: Fe 2+ +2OH - Fe(OH) 2 ↓ 可溶性铁盐与碱溶液反应: Fe 3+ +3OH - Fe(OH) 3 ↓ 二者的 关系 在空气中,Fe(OH) 2 能够迅速被氧气氧化成Fe(OH) 3 ,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为 4Fe(OH) 2 +O 2 +2H 2 O 4Fe(OH) 3 4.亚铁盐和铁盐 亚铁盐 铁盐 颜色 浅绿色(溶液) 棕黄色(溶液) 氧化 性与 还原性 (1)Fe 2+ 为中间价态,既有氧化性,又有还原性,其中以 还原性 为主,如:遇Br 2 、Cl 2 、H 2 O 2 、N (H + )等 均表现为 还原性 。(2)Fe 2+ 的酸性溶液与H 2 O 2 反应的离子方程式:2Fe 2+ +H 2 O 2 +2H + 2Fe 3+ +2H 2 O Fe 3+ 为铁的高价态,遇Fe、Cu、HI、H 2 S等均表现为 氧化性 。(1)Fe 3+ 与 、I - 、HS - 、S 等具有较强还原性的离子不能大量共存。(2)Fe 3+ 可腐蚀印刷电路板上的铜,反应的离子方程式为2Fe 3+ +Cu Cu 2+ +2Fe 2+ 水解性 水解呈酸性 (1)Fe 3+ 极易水解,只能存在于酸性较强的溶液中。(2)实验室可用FeCl 3 滴入沸水中制取氢氧化铁胶体,反应的化学方程式:FeCl 3 +3H 2 O Fe(OH) 3 (胶体)+3HCl 溶液的 配制 加少量 硫酸 抑制Fe 2+ 的水解,加少量 铁屑 防止Fe 2+ 被氧化 氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度 1. 易错易混辨析(正确的画“√”,错误的画“ ✕ ”)。 (1)铁位于元素周期表中第四周期第ⅧB族 ( ✕ ) (2)铁能被磁铁吸引,但是纯铁易被腐蚀 ( ✕ ) (3)红热的铁与水蒸气反应生成三氧化二铁和氧气 ( ✕ ) (4)过量的铁在加热时与氯气反应,生成氯化亚铁 ( ✕ ) (5)铁与强氧化剂硝酸反应的产物仅为硝酸铁 ( ✕ ) (6)铝热法制取铁的反应中,放出的热量能使铁熔化 ( √ ) (7)Fe分别与氯气和稀盐酸反应所得氯化物相同 ( ✕ ) (8)与相同浓度的盐酸反应生成氢气的速率:纯铁>生铁( ✕ ) 2. 铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。按要求书写 下列方程式: (1)Fe与Cl 2 、S反应的化学方程式: 、 。 (2)Fe与水蒸气的反应: 。 (3)与氧化性酸(如HNO 3 )的反应(写离子方程式)。 Fe与过量稀HNO 3 的反应: 。 Fe与少量稀HNO 3 的反应: 。 (4)Fe与FeCl 3 溶液的反应(写离子方程式): 。 答案 (1)2Fe+3Cl 2 2FeCl 3 Fe+S FeS (2)3Fe+4H 2 O(g) Fe 3 O 4 +4H 2 (3)Fe+N +4H + Fe 3+ +NO↑+2H 2 O 3Fe+2N +8H + 3Fe 2+ +2NO↑+4H 2 O (4)Fe+2Fe 3+ 3Fe 2+ 1. (2019黑龙江大庆一模)下列关于Fe的性质错误的是 ( C ) A.有银白色光泽 B.能被磁铁吸引 C.遇硫酸钝化 D.能和水蒸气反应 题组一 铁及其化合物的性质 答案 C 在常温下,铁遇浓硫酸发生钝化,C错误。 2. (2019安徽淮北地区摸底)人体正常的血红蛋白含有Fe 2+ ,若误食亚硝酸盐(如 NaNO 2 ),则导致血红蛋白中的Fe 2+ 转化为Fe 3+ 而中毒,服用维生素C可解毒。下 列叙述不正确的是 ( D ) A.亚硝酸盐被还原 B.维生素C是还原剂 C.维生素C将Fe 3+ 还原为Fe 2+ D.亚硝酸盐与一氧化碳使人中毒的原理相同 答案 D 一氧化碳使人中毒主要体现在能与血红蛋白结合,从而使血红蛋 白失去运输氧气的能力,与亚硝酸盐中毒原理不同,故D错误。 3. (2019安徽合肥调研)向FeCl 3 、CuCl 2 和HCl的混合溶液中加入铁粉,待反应 结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子 是 ( A ) A.Fe 2+ B.Fe 3+ C.Cu 2+ D.H + 答案 A 氧化性顺序为Fe 3+ >Cu 2+ >H + 。向氯化铁、氯化铜和盐酸的混合溶 液中加入铁粉,铁会先后与氯化铁、氯化铜和盐酸发生氧化还原反应。反应 结束后,所剩余的固体滤出后能被磁铁吸引,说明铁粉过量,溶液中的反应均 能发生,所以溶液中的阳离子只有Fe 2+ 和水电离出的微量的H + ,A正确。 4. 下列各图中能较长时间看到Fe(OH) 2 白色沉淀的是 ( B ) 题组二 氢氧化亚铁的制备 A.①②③④ B.①②③⑤ C.②③④⑤ D.全部 答案 B 因为Fe(OH) 2 在空气中很容易被氧化为红褐色的Fe(OH) 3 ,即4Fe (OH) 2 +O 2 +2H 2 O 4Fe(OH) 3 ,因此要较长时间看到Fe(OH) 2 白色沉淀,就要排 出装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排 尽,并使生成的Fe(OH) 2 处在有氢气的环境中;③的原理为铁作阳极产生Fe 2+ , 与电解产生的OH - 结合生成 Fe(OH) 2 ,且汽油能隔绝空气;⑤中苯可隔绝空气; ④空气中的氧气能将Fe(OH) 2 氧化,因而不能较长时间看到白色沉淀。 5. (2019甘肃静宁一模)下列关于Fe 3+ 、Fe 2+ 性质实验的说法错误的是 ( ) A.用如图装置可以制备Fe(OH) 2 B.配制FeCl 3 溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需 要的浓度 C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不 能确定溶液中含有Fe 2+ D.向FeCl 2 溶液中加入少量铁粉是为了防止Fe 2+ 被氧化 答案 C 反应开始时打开止水夹C,生成的H 2 进入B中,可排出其中的空气, 防止生成的Fe(OH) 2 被氧化,一段时间后关闭止水夹C,A中生成的FeSO 4 溶液 被H 2 压入B中与NaOH反应生成Fe(OH) 2 ,A正确;FeCl 3 易水解,为防止水解,配制 溶液时先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度,B正 确;Fe 3+ 与铁反应可生成Fe 2+ ,则向FeCl 2 溶液中加入少量铁粉是为了防止Fe 2+ 被 氧化,D正确。 题后悟道 防止Fe(OH) 2 氧化的方法 (1)将配制溶液的蒸馏水煮沸,排出溶解的氧气。 (2)将盛有氢氧化钠溶液的胶头滴管尖端插入试管里的亚铁盐溶液底部,再慢 慢挤出NaOH溶液。 (3)在亚铁盐溶液上面加保护层,如苯或植物油等。 (4)充入保护气,如氢气、氮气、稀有气体等。 (5)用铁作阳极,石墨作阴极,电解NaOH溶液或NaCl溶液;利用新产生的Fe 2+ 与 OH - 反应制取。 6. 将过量Fe粉放入200 mL 2 mol/L的HNO 3 溶液中,假设还原产物只NO且 HNO 3 完全反应,则参加反应的Fe的质量为 ( C ) A.4.2 g B.5.6 g C.8.4 g D.11.2 g 题组三 有关铁及其化合物的计算 答案 C 将过量Fe粉放入200 mL 2 mol/L的HNO 3 溶液中,反应方程式为3Fe +8HNO 3 3Fe(NO 3 ) 2 +2NO↑+4H 2 O,硝酸的物质的量为2 mol/L × 0.2 L=0.4 mol,则消耗的铁的物质的量为0.15 mol,其质量为0.15 mol × 56 g/mol=8.4 g,C 正确。 7. (2019宁夏育才中学月考)1 L溶液中含有Fe(NO 3 ) 3 和H 2 SO 4 两种溶质,其浓度 分别为0.2 mol·L -1 和1.5 mol·L -1 ,现向该溶液中加入39.2 g铁粉使其充分反应。 下列有关说法正确的是 ( C ) A.反应后溶液中Fe 3+ 物质的量为0.8 mol B.反应后产生13.44 L H 2 (标准状况) C.反应后溶液中Fe 2+ 和Fe 3+ 物质的量之和为0.9 mol D.由于氧化性:Fe 3+ >H + ,故反应中先没有气体产生后产生气体 答案 C 发生反应的顺序是Fe+4H + +N Fe 3+ +2H 2 O+NO↑,Fe+2Fe 3+ 3Fe 2+ ,如果酸有剩余,则有反应Fe+2H + Fe 2+ +H 2 ↑发生,溶液中 n (Fe 3+ )= (1 × 0.2)mol=0.2 mol, n (H + )=(1 × 2 × 1.5) mol=3 mol, n (N )=(1 × 3 × 0.2) mol=0.6 mol, n (Fe)= =0.7 mol,根据上述反应方程式,第一个反应方程式中N 不足,第二个反应方程式中Fe不足,Fe 3+ 过量,反应后溶液中 n (Fe 3+ )=0.6 mol、 n (Fe 2+ )=0.3 mol,A错误;根据选项A的分析,没有氢气产生,B错误;根据选项A的 分析, n (Fe 2+ )+ n (Fe 3+ )=0.3 mol+0.6 mol=0.9 mol,C正确;根据选项A的分析,先发 生反应Fe+4H + +N Fe 3+ +2H 2 O+NO↑,有气体生成,D错误。 考点二 “铁三角”及亚铁离子、铁离子的检验 1.“铁三角”中的转化关系 完成下列变化的离子方程式,体会Fe 2+ 与Fe 3+ 转化的条件。 (1)将H 2 S气体通入FeCl 3 溶液中产生淡黄色沉淀: ① 2Fe 3+ +H 2 S 2Fe 2+ +S↓+2H + 。 (2)将FeCl 3 溶液滴入KI-淀粉溶液中,溶液变蓝: ② 2Fe 3+ +2I - 2Fe 2+ +I 2 。 (3)向FeCl 2 酸性溶液中滴入H 2 O 2 溶液: ③ 2Fe 2+ +H 2 O 2 +2H + 2Fe 3+ +2H 2 O 。 (4)FeSO 4 可使酸性KMnO 4 溶液褪色: ④ 5Fe 2+ +Mn +8H + 5Fe 3+ +Mn 2+ +4H 2 O 。 (5)将FeCl 2 溶液滴入HNO 3 溶液中,有无色气体放出: ⑤ 3Fe 2+ +4H + +N 3Fe 3+ +NO↑+2H 2 O 。 2.Fe 2+ 、Fe 3+ 的检验 Ⅰ.Fe 2+ 的检验 (1)样品溶液 ⑥ 无明显现象 溶液变⑦ 红色 ,说明含有Fe 2+ (2)样品溶液 产生⑧ 白色絮状 沉淀,迅速变成灰绿色, 最终变为⑨ 红褐 色,说明含有Fe 2+ Ⅱ.Fe 3+ 的检验 a.样品溶液 溶液变 红色 ,说明含有Fe 3+ b.样品溶液 产生 红褐色 沉淀,说明含有Fe 3+ Ⅲ.混合溶液中Fe 3+ 、Fe 2+ 的检验 (1)Fe 3+ 的检验 a.混合溶液 溶液变 红色 ,说明含有Fe 3+ b.混合溶液 试纸变 蓝色 ,说明含有Fe 3+ (2)Fe 2+ 的检验 a.混合溶液 酸性KMnO 4 溶液 紫红色褪去 ,说明含有Fe 2+ b.混合溶液 溴水 褪色 ,说明含有Fe 2+ c.混合溶液 生成蓝色沉淀,说明含有Fe 2+ 1. 易错易混辨析(正确的画“√”,错误的画“ ✕ ”)。 (1)向FeCl 3 溶液中加入Mg(OH) 2 :3Mg(OH) 2 +2Fe 3+ 2Fe(OH) 3 +3Mg 2+ ( √ ) (2)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液呈血红色,该溶液 中一定含Fe 2+ ( √ ) (3)在氢氧化铁胶体中下列离子能大量共存:H + 、K + 、 、Br - ( ✕ ) (4)因为Fe 3+ 具有氧化性,所以用KSCN溶液可以鉴别Fe 3+ ( ✕ ) (5)除去MgCl 2 溶液中的Fe 3+ ,可向混合液中加入MgCO 3 ( √ ) (6)在pH=7的溶液中Cl - 、Na + 、Fe 3+ 可大量共存 ( ✕ ) 2. 常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反 应。 (1)铁粉与水蒸气反应的化学方程式: 。 (2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充 分反应,过滤。简述检验所得滤液中Fe 3+ 的操作方法: 。 (3)经检验上述滤液中不含Fe 3+ ,这不能说明铁粉与水蒸气反应所得产物中不 含+3价的铁。原因是(用化学方程式说明) 。 答案 (1)3Fe+4H 2 O(g) Fe 3 O 4 +4H 2 (2)取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色。如果溶液颜色 变为红色,说明溶液中含有Fe 3+ ,否则不含Fe 3+ (3)Fe+Fe 2 (SO 4 ) 3 3FeSO 4 1. (2019陕西渭南中学质检)X、Y、Z三种物质存在如图所示的转化关系(图 中“→”表示一步转化)。下列各组物质中,不能满足此转化关系的是 ( A ) 题组一 “铁三角”中的转化关系 X Y Z A Al Al 2 O 3 NaAlO 2 B Fe FeCl 3 FeCl 2 C C CO CO 2 D Cl 2 HCl NaCl 答案 A 铝与氧气反应生成氧化铝,氧化铝与氢氧化钠反应生成偏铝酸钠, 但偏铝酸钠无法一步制得单质铝,所以不能满足Z→X的一步转化,A符合题意。 2. 金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的 转化关系中不全部是通过一步反应完成的是( D ) A.Na→NaOH→Na 2 CO 3 →NaCl B.Fe→Fe(NO 3 ) 3 →Fe(OH) 3 →Fe 2 O 3 C.Mg→MgCl 2 →Mg(OH) 2 →MgSO 4 D.Al→Al 2 O 3 →Al(OH) 3 →AlCl 3 答案 D 氧化铝不能溶于水直接生成氢氧化铝,所以选项D符合题意。 题组二 亚铁离子、铁离子的检验 3. (2019宁夏育才中学月考)下列试剂中可用于鉴别Fe 2+ 和Fe 3+ 的是 ( B ) ①KI-淀粉溶液 ②酸性KMnO 4 溶液 ③KSCN溶液 ④KBr溶液 A.①③ B.①②③ C.①③④ D.①②③④ 答案 B ①铁离子能将碘离子氧化成碘单质,溶液变成蓝色,能鉴别Fe 2+ 和 Fe 3+ ;②Fe 2+ 具有较强的还原性,能使酸性KMnO 4 溶液褪色,Fe 3+ 不能,能用酸性 KMnO 4 溶液鉴别Fe 2+ 和Fe 3+ ;③加入KSCN溶液,发生反应:Fe 3+ +3SCN - Fe(SCN) 3 ,溶液呈红色,证明含有铁离子,加KSCN溶液没有明显现象,加入氯水, 溶液变成红色,说明溶液只有Fe 2+ ;④KBr溶液与Fe 2+ 和Fe 3+ 均不能反应,不能鉴 别Fe 2+ 和Fe 3+ 。 4. (2019新疆昌吉月考)要证明某溶液中不含有Fe 3+ 而可能含有Fe 2+ ,进行如下 实验操作时最佳顺序为 ( C ) ①加入足量氯水 ②加入足量KMnO 4 溶液 ③加入少量KSCN溶液 A.①③ B.②③ C.③① D.①②③ 5. 选择合适试剂完成甲、乙两组实验: 甲组:检验含Fe 3+ 的溶液中是否含有Fe 2+ ; 乙组:检验含Fe 2+ 的溶液中是否含有Fe 3+ 。 下列试剂选取正确的一项是 ( B ) 甲组 乙组 A 新制氯水、KSCN溶液 NaOH溶液 B 酸性KMnO 4 溶液 KSCN溶液 C NaOH溶液 溴水 D 溴水 酸性KMnO 4 溶液 答案 B Fe 2+ 具有还原性,能使酸性KMnO 4 溶液褪色;Fe 3+ +3SCN - Fe(SCN) 3 (红色)。 题后悟道 检验Fe 2+ 和Fe 3+ 的易错点 氧化性:KMnO 4 (H + )>Cl 2 >Fe 3+ ,故用酸性KMnO 4 溶液检验Fe 2+ 时要防止溶液中 的Cl - 干扰。 1. (不定项)由硫铁矿(主要成分:FeS 2 和SiO 2 )为主要原料得到绿矾(FeSO 4 ·7H 2 O)的流程如下: 真题演练 · 模拟预测 下列说法不正确的是 ( BD ) A.过程1废气中含SO 2 B.过程2试剂a为稀硝酸 C.过程3离子方程式为2Fe 3+ +SO 2 +2H 2 O 2Fe 2+ +S +4H + D.过程4将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 答案 BD 由制备绿矾流程可知,硫铁矿(主要成分:FeS 2 和SiO 2 )高温煅烧后 的烧渣(主要成分:Fe 2 O 3 和SiO 2 )溶于稀硫酸,溶液中含Fe 3+ ,过程2过滤除去二氧 化硅,滤液中通入二氧化硫,将铁离子还原成亚铁离子,过程4为蒸发浓缩、冷 却结晶析出绿矾。根据上述分析,过程1,废气中含SO 2 ,A正确;因绿矾的酸根 离子为硫酸根离子,则过程2用稀硫酸来溶解烧渣,B错误;过程3中二氧化硫将 铁离子还原成亚铁离子,离子方程式为2Fe 3+ +SO 2 +2H 2 O 2Fe 2+ +S +4H + , C正确;过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,蒸干时绿 矾受热失去部分结晶水,得不到纯净绿矾,D错误。 2. (2018课标Ⅰ,7,6分)磷酸亚铁锂(LiFePO 4 )电池是新能源汽车的动力电池之 一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程 如下: 下列叙述错误的是 ( D ) A.合理处理废旧电池有利于保护环境和资源再利用 B.从“正极片”中可回收的金属元素有Al、Fe、Li C.“沉淀”反应的金属离子为Fe 3+ D.上述流程中可用硫酸钠代替碳酸钠 答案 D 合理处理废旧电池可回收有关金属,达到资源再利用的目的,同时 有利于环境保护,A项正确;由流程图可知,“正极片”中含有的金属元素有 Al、Fe、Li,B项正确;LiFePO 4 中铁元素的化合价为+2价,在H 2 SO 4 、HNO 3 作 用下转化为Fe 3+ ,经碱液处理形成Fe(OH) 3 沉淀,C项正确;Li 2 CO 3 难溶于水,而 Li 2 SO 4 可溶于水,故不能用Na 2 SO 4 代替Na 2 CO 3 ,D错误。 3. (2018课标Ⅱ,28,15分)K 3 [Fe(C 2 O 4 ) 3 ]·3H 2 O(三草酸合铁酸钾)为亮绿色晶体, 可用于晒制蓝图。回答下列问题: (1)晒制蓝图时,用K 3 [Fe(C 2 O 4 ) 3 ]·3H 2 O作感光剂,以K 3 [Fe(CN) 6 ]溶液为显色剂。 其光解反应的化学方程式为2K 3 [Fe(C 2 O 4 ) 3 ] 2FeC 2 O 4 +3K 2 C 2 O 4 +2CO 2 ↑;显 色反应的化学方程式为 。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。 ①通入氮气的目的是 。 ②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由 此判断热分解产物中一定含有 、 。 ③为防止倒吸,停止实验时应进行的操作是 。 ④样品完全分解后,装置A中的残留物含有FeO和Fe 2 O 3 ,检验Fe 2 O 3 存在的方法 是 。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量 m g样品于锥形瓶中,溶解后加稀H 2 SO 4 酸化,用 c mol·L -1 KMnO 4 溶液滴 定至终点。滴定终点的现象是 。 ②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全 部收集到锥形瓶中。加稀H 2 SO 4 酸化,用 c mol·L -1 KMnO 4 溶液滴定至终点,消 耗KMnO 4 溶液 V mL。该晶体中铁的质量分数的表达式为 。 答案 (1)3FeC 2 O 4 +2K 3 [Fe(CN) 6 ] Fe 3 [Fe(CN) 6 ] 2 +3K 2 C 2 O 4 (2)①隔绝空气、使反应产生的气体全部进入后续装置 ②CO 2 CO ③先熄灭装置A、E的酒精灯,冷却后停止通入氮气 ④取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红 色,证明含有Fe 2 O 3 (3)①粉红色出现 ② × 100% 解析 (1)Fe 2+ 与[Fe(CN) 6 ] 3- 可反应生成蓝色固体Fe 3 [Fe(CN) 6 ] 2 。 (2)②B中澄清石灰水变浑浊,说明分解产物中有CO 2 ;装置E中固体变为红色,F 中澄清石灰水变浑浊,证明分解产物中有CO。③停止实验时,若先停止通入 氮气,后熄灭酒精灯,会导致装置内气压减小,造成倒吸。④检验Fe 2 O 3 需先将 固体溶于稀硫酸,然后利用Fe 3+ 遇SCN - 会生成红色的Fe(SCN) 3 的性质检验。 (3)②Zn+2Fe 3+ 2Fe 2+ +Zn 2+ 、5Fe 2+ +Mn +8H + 5Fe 3+ +Mn 2+ +4H 2 O,则Fe 3+ ~ Mn ,溶液中Fe 3+ 为[( c × V × 10 -3 ) × 5] mol,即(5 cV × 10 -3 × 56)g,则晶体中铁的质 量分数表达式为 × 100%。 4. (2016课标Ⅱ,28,15分)某班同学用如下实验探究Fe 2+ 、Fe 3+ 的性质。回答下 列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L -1 的溶液。在FeCl 2 溶液中需加入少量铁屑,其目的是 。 (2)甲组同学取2 mL FeCl 2 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变 红,说明Cl 2 可将Fe 2+ 氧化。FeCl 2 溶液与氯水反应的离子方程式为 。 (3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl 2 溶液中先加入 0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油 的作用是 。 (4)丙组同学取10 mL 0.1 mol·L -1 KI溶液,加入6 mL 0.1 mol·L -1 FeCl 3 溶液混 合。分别取2 mL此溶液于3支试管中进行如下实验: ①第一支试管中加入1 mL CCl 4 充分振荡、静置,CCl 4 层显紫色; ②第二支试管中加入1滴K 3 [Fe(CN) 6 ]溶液,生成蓝色沉淀; ③第三支试管中加入1滴KSCN溶液,溶液变红。 实验②检验的离子是 (填离子符号);实验①和③说明:在I - 过量的情 况下,溶液中仍含有 (填离子符号),由此可以证明该氧化还原反应为 。 (5)丁组同学向盛有H 2 O 2 溶液的试管中加入几滴酸化的FeCl 2 溶液,溶液变成棕 黄色,发生反应的离子方程式为 ;一段时 间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因 是 ;生成沉淀的原因是 (用平衡移动原理解释)。 答案 (1)防止Fe 2+ 被氧化 (2)2Fe 2+ +Cl 2 2Fe 3+ +2Cl - (3)隔绝空气(排除氧气对实验的影响) (4)Fe 2+ Fe 3+ 可逆反应 (5)2Fe 2+ +H 2 O 2 +2H + 2Fe 3+ +2H 2 O Fe 3+ 催化H 2 O 2 分解产生O 2 H 2 O 2 分解反 应放热,促进Fe 3+ 的水解平衡正向移动 解析 (1)Fe 2+ 易被空气中的O 2 氧化为Fe 3+ ,加入少量铁屑,可防止Fe 2+ 被氧化。 (2)Cl 2 可将Fe 2+ 氧化,反应的离子方程式为2Fe 2+ +Cl 2 2Fe 3+ +2Cl - 。(3)Fe 2+ 易 被空气中的O 2 氧化,加入煤油,覆盖在溶液上面,阻止空气进入溶液干扰实 验。(4)实验②加入K 3 [Fe(CN) 6 ]溶液,生成蓝色沉淀,说明含有Fe 2+ ;实验①和③ 说明在I - 过量的情况下,溶液中仍含有Fe 3+ ,证明该反应为可逆反应。(5)H 2 O 2 溶液中加入酸化的FeCl 2 溶液,溶液变成棕黄色,说明Fe 2+ 被H 2 O 2 氧化成Fe 3+ ,同 时生成的Fe 3+ 对H 2 O 2 的分解有催化作用,H 2 O 2 的分解反应放热,又对Fe 3+ 的水解 起促进作用。查看更多