- 2021-08-06 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年江西省抚州市临川实验学校高二上学期期中考试化学试题
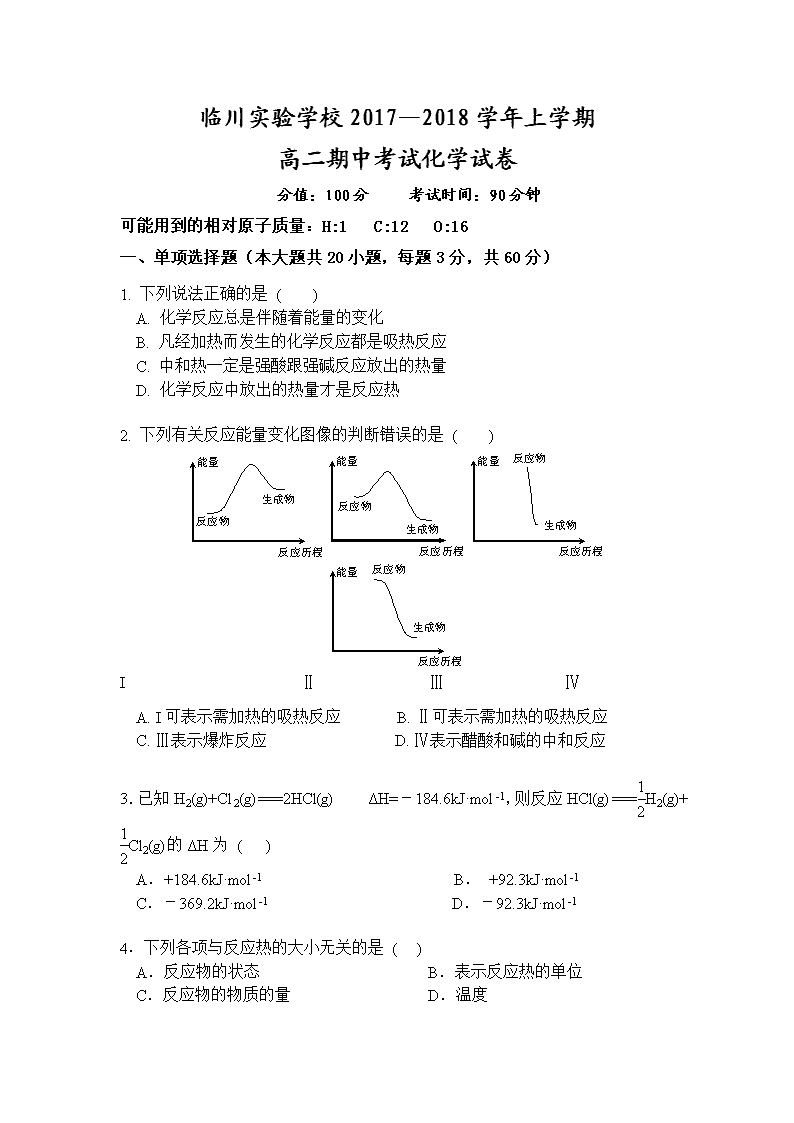
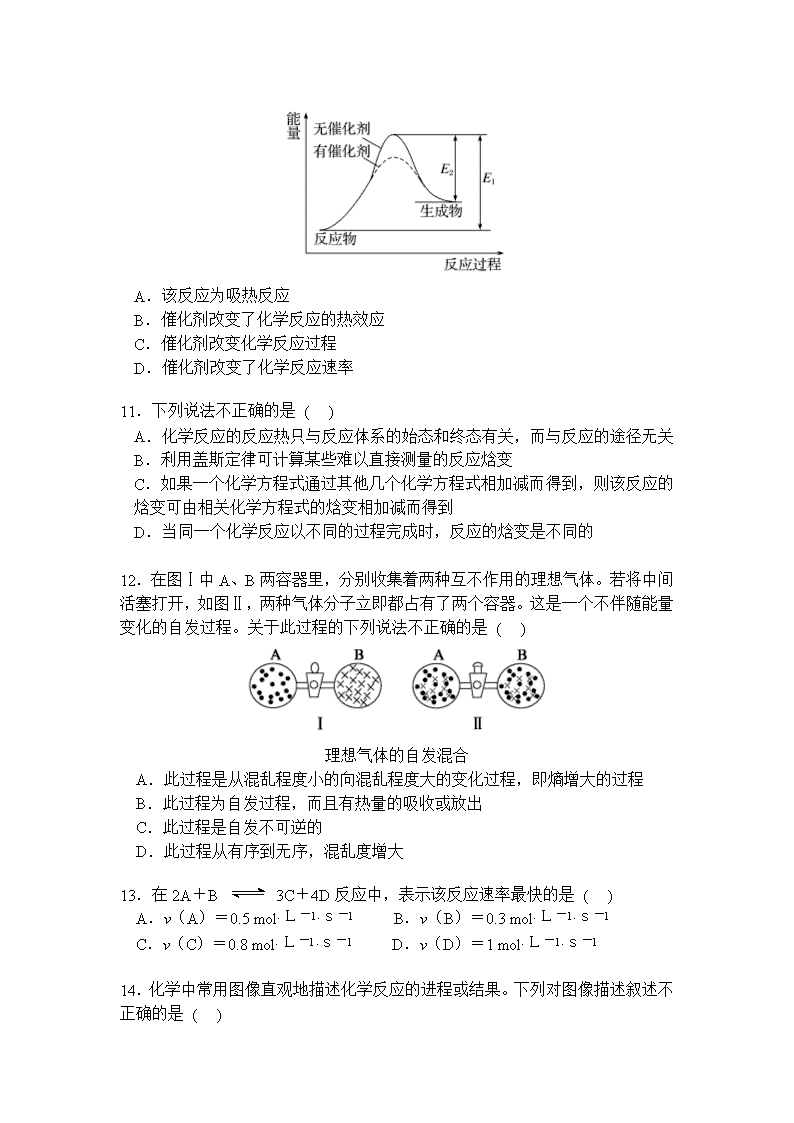
临川实验学校2017—2018学年上学期 高二期中考试化学试卷 分值:100分 考试时间:90分钟 可能用到的相对原子质量:H:1 C:12 O:16 一、单项选择题(本大题共20小题,每题3分,共60分) 1. 下列说法正确的是 ( ) A. 化学反应总是伴随着能量的变化 B. 凡经加热而发生的化学反应都是吸热反应 C. 中和热一定是强酸跟强碱反应放出的热量 D. 化学反应中放出的热量才是反应热 2. 下列有关反应能量变化图像的判断错误的是 ( ) I Ⅱ Ⅲ Ⅳ A. I可表示需加热的吸热反应 B. Ⅱ可表示需加热的吸热反应 C. Ⅲ表示爆炸反应 D. Ⅳ表示醋酸和碱的中和反应 3.已知H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6kJ·mol-1,则反应HCl(g)===H2(g)+Cl2(g)的ΔH为 ( ) A.+184.6kJ·mol-1 B. +92.3kJ·mol-1 C.-369.2kJ·mol-1 D.-92.3kJ·mol-1 4.下列各项与反应热的大小无关的是 ( ) A.反应物的状态 B.表示反应热的单位 C.反应物的物质的量 D.温度 5.1 g氢气燃烧生成液态水时放出142.9 kJ热量,表示该反应的热化学方程式正确的是 ( ) A. 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 B. 2H2+O2=2H2O ΔH=-571.6 kJ·mol-1 C.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6 kJ·mol-1 D. 2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1 6.下列热化学方程式中,ΔH能正确表示物质的燃烧热的是 ( ) A.2CO(g) +O2(g) =2CO2(g) ΔH=-566.0 kJ/mol-1 B.C(s) +1/2O2(g) =CO(g) ΔH=-110.5 kJ/mol-1 C.H2(g) + Cl2(g) = 2HCl(g) ΔH=-184.6kJ/mol-1 D.CH4(g) +2O2(g)=CO2(g)+2H2O(l) ΔH=-890.31 kJ/mol-1 7. 已知: H2O(g)===H2O(l) ΔH=Q1 kJ·mol-1 C2H5OH(g)===C2H5OH(l) ΔH=Q2 kJ·mol-1 C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3 kJ·mol-1 若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 ( ) A.-(0.5Q1-1.5Q2+0.5Q3)kJ B.-(3Q1-Q2+Q3)kJ C.-(Q1+Q2+Q3)kJ D.-0.5(Q1+Q2+Q3)kJ 8.利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和CO的转化率,采取的措施是( ) A.升高温度同时充入N2 B.及时将CO2和N2从反应体系中移走 C.降低温度 D.增大压强同时加催化剂 催化剂 9. 氢气可通过下列反应制得:CO(g)+H2O(g)CO2(g)+H2(g) △H<0,为了提高氢气在平衡体系中所占的比例,可采取的措施是 ( ) A.更换催化剂 B.减小CO的浓度 C.减小压强 D.降低温度 10.某反应过程中能量变化如图所示,下列有关叙述不正确的是 ( ) A.该反应为吸热反应 B.催化剂改变了化学反应的热效应 C.催化剂改变化学反应过程 D.催化剂改变了化学反应速率 11.下列说法不正确的是 ( ) A.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 B.利用盖斯定律可计算某些难以直接测量的反应焓变 C.如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变可由相关化学方程式的焓变相加减而得到 D.当同一个化学反应以不同的过程完成时,反应的焓变是不同的 12.在图Ⅰ中A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开,如图Ⅱ,两种气体分子立即都占有了两个容器。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是 ( ) 理想气体的自发混合 A.此过程是从混乱程度小的向混乱程度大的变化过程,即熵增大的过程 B.此过程为自发过程,而且有热量的吸收或放出 C.此过程是自发不可逆的 D.此过程从有序到无序,混乱度增大 13.在2A+B 3C+4D反应中,表示该反应速率最快的是 ( ) A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1 C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1 14.化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述叙述不正确的是 ( ) A.根据图①可判断可逆反应A2(g)+3B2(g) ⇌2AB3(g)的ΔH<0 B.图②可以表示压强对可逆反应2A(g)+B(g) ⇌3C(g)+D(s)的影响,乙的压强大 C.图③可以表示对某化学平衡体系改变温度后反应速率随时间的变化 D.据图④判断,物质A反应生成物质C的ΔH<0 15. 反应N2O4(g)2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( ) A.a、c两点的反应速率:a>c B.a、c两点气体的颜色:a深,c浅 C.a、c两点气体的平均相对分子质量:a>c D.由状态b到状态a,可以用加热的方法 16.某反应:A===B+C在室温下不能自发进行,在高温下能自发进行,对该反应过程ΔH、ΔS的判断正确的是 ( ) A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0 C.ΔH>0、ΔS>0 D.ΔH<0、ΔS>0 17.下列说法正确的是 ( ) ①光是影响某些化学反应速率的外界条件之一 ②参加反应的物质的性质是影响化学反应速率的主要因素 ③不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率 ④决定化学反应速率的主要因素是浓度 A.①② B.②③ C.③④ D.①④ 18. 已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为:①C(石墨,s)+O2(g)CO2(g) ΔH=-393.51 kJ·mol-1 ②C(金刚石,s)+O2(g)CO2(g) ΔH=-395.41 kJ·mol-1据此判断,下列说法中正确的是 ( ) A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低 B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高 C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低 D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高 19.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是 ( ) A.K值不变,平衡可能移动 B.平衡移动,K值一定变化 C.平衡移动,K值可能不变 D.K值变化,平衡一定移动 20.下列说法中,错误的是 ( ) A. 人类目前所直接利用的能量大部分是由化学反应产生的 B. 煤、石油、天然气是当今世界最重要的三种化石燃料 C. 乙醇做燃料易燃烧,污染小,但不可再生 D. 选择燃料需要考虑燃料热值的大小 二、填空题(共40分) 21.(12分)已知下列热化学方程式: ①H2(g) +O2 (g) =H2O(l) ΔH=-285 kJ·mol-1 ②H2(g) +O2 (g) =H2O(g) ΔH=-241.8 kJ·mol-1 ③C(s) +O2 (g) =CO(g) ΔH=-110.5 kJ·mol-1 ④ C(s) +O2 (g) =CO2(g) ΔH=-393.5 kJ·mol-1 回答下列问题: (1)H2的燃烧热为 ;C的燃烧热为 。 (2)燃烧1gH2生成液态水,放出的热量为 。 (3)写出CO燃烧的热化学方程式 。 22.(12分)在一定体积的密闭容器中,进行如下化学反应: CO2(g)+H2(g) CO(g)+H2O(g), 其化学平衡常数K和温度t的关系如下表: t℃ 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 2.6 回答下列问题: (1)该反应的化学平衡常数表达式为K= 。 (2)该反应为 反应(选填吸热、放热)。 (3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。 a.容器中压强不变 b.混合气体中 c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO) (4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。 高温 23.(16分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3 (s) + 3H2 (g)W (s) + 3H2O (g)。请回答下列问题: (1)上述反应的化学平衡常数表达式为 。 (2) 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为___________;随温度的升高,H2与水蒸气的体积比减小,则该反应为_________反应(填“吸热”或“放热”)。 (3)用H2还原WO2也可得到金属钨。已知: WO2 (s) + 2H2 (g)W (s) + 2H2O (g) ΔH = +66.0 kJ·mol–1 WO2 (g) + 2H2 (g)W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1 则WO2 (s)WO2 (g) 的ΔH = ______________________。 1400℃ 约3000℃ (4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)WI4 (g)。下列说法正确的有________(填序号)。 a.灯管内的I2可循环使用 b.WI4在灯丝上分解,产生的W又沉积在灯丝上 c.WI4在灯管壁上分解,使灯管的寿命延长 d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢 答题卡: 一、单项选择题(本大题共20小题,每题3分,共60分) 题号 01 02 03 04 05 06 07 08 09 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案 二、填空题(共40分) 21. (1) (3分); (3分) (2) (3分) (3) (3分) 22. (1) (3分) (2) (3分) (3) (3分) (4) (3分) 23. (1) (3分) (2) (3分); (3分) (3) (4分) (4) (3分) 一、 单项选择题(本大题共20小题,每题3分,共60分) 1-5.ABBBA 6-10.DBDDB 11-15.DBBCD 16-20.CAABC 题号 01 02 03 04 05 06 07 08 09 10 答案 A B B B A D B D D B 题号 11 12 13 14 15 16 17 18 19 20 答案 D B B C D C A A B C 二、 填空题(40分) 21. (1)285 (3分) ; 393.5 (3分) (2)142.5 (3分) (3)CO(g)+O2 (g)=CO2(g) ΔH=-283 kJ·mol-1 (3分) 22. (1) (3分) (2)吸热 (3分) (3) b c (3分) (4) 830 (3分) 23. (1) K= c3(H2O)/c3(H2) (3分) (2)60% (3分) ; 吸热 (3分) (3) +203.9 kJ/mol (4分) (4)a、b (3分)查看更多