- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习“7+1”小卷练(六)作业(全国通用)
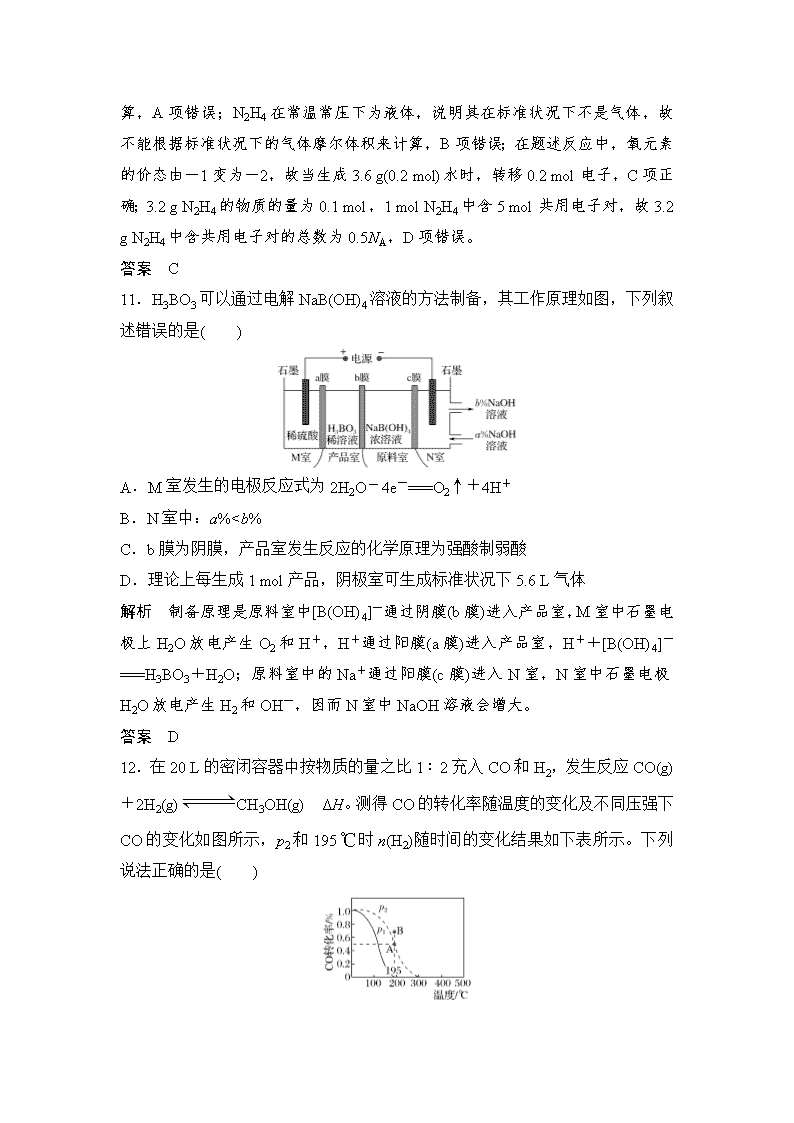
“7+1”小卷练(六) 本试卷分选择题和非选择题两部分。满分57分,考试时间30分钟。 可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 K—39 Cl—35.5 Mn—55 Fe—56 Zn—65 选择题 一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。) 7.化学与生产、生活密切相关。下列叙述正确的是( ) A.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 B.氮的固定只有在高温、高压、催化剂的条件下才能实现 C.喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 D. “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 解析 A、活性炭脱色是利用其吸附性,次氯酸盐漂白是利用次氯酸的强氧化性,故A错误;B、氮的固定有自然固氮和人工固氮,如大豆根瘤菌的固氮为自然固氮,高温、高压、催化剂条件下的固氮为人工固氮,故B错误;C、能被人体吸收的铁元素是亚铁离子,亚铁离子很容易被氧化为三价铁离子,维生素C具有还原性,能将三价铁还原为亚铁离子,故C正确;D、光化学烟雾与氮氧化物有关,故D错误。故选C。 答案 C 8.下列叙述不正确的是( ) A.甲苯分子中所有原子在同一平面上 B.苯、乙酸、乙醇均能发生取代反应 C.分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构) D.可用溴的四氯化碳溶液区分和 解析 甲苯中—CH3中最少有2个H原子不在苯环的平面上,A项错误;苯能与浓硝酸、溴等发生取代反应,乙酸和乙醇发生的酯化反应也属于取代反应,B项正确;C3H6Cl2可看成C3H8 中有2个H原子被2个Cl原子取代的产物,2个Cl原子可取代同一碳原子或不同碳原子上的H原子,各有2种同分异构体,即符合条件的同分异构体共有4种,C项正确;中含有碳碳双键,能使溴的四氯化碳溶液褪色,而不能使溴的四氯化碳溶液褪色,故用溴的四氯化碳溶液可鉴别二者,D项正确。 答案 A 9.(2018·全国名校大联考)为证明铁的金属活动性比铜强,某同学设计了如下一些方案: 方案 现象或产物 ①将铁片置于CuSO4溶液中 铁片上有亮红色物质析出 ②将铁丝和铜丝分别在氯气中燃烧 产物分别为FeCl3和CuCl2 ③将铁片和铜片分别放入热浓硫酸中 产物为Fe2(SO4)3和CuSO4 ④将铜片置于FeCl3溶液中 铜片逐渐溶解 ⑤将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 铁片溶解,铜片上有气泡产生 能根据现象或产物证明铁的金属活动性比铜强的方案一共有( ) A.2种 B. 3种 C.4种 D.5种 解析 ①铁片置CuSO4溶液中,铁片上有亮红色物质析出,说明发生了置换反应Fe+CuSO4===FeSO4+Cu,活泼性Fe>Cu;②、③、④均不能说明活泼性Fe>Cu;⑤铁、铜用导线连接置于稀硫酸中,铁、铜形成原电池,Fe作负极,铁片溶解,铜作正极有H2放出,说明活泼性Fe>Cu,故答案选A。 答案 A 10.肼(N2H4)是火箭常用的高能燃料,常温常压下为液体。肼能与过氧化氢发生反应:N2H4+2H2O2===N2↑+4H2O。设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.11.2 L N2含电子总数为7NA B.标准状况下,22.4 L N2H4中所含原子总数为6NA C.若生成3.6 g H2O,则上述反应转移电子数为0.2NA D.3.2 g N2H4中含有共用电子对的总数为0.6NA 解析 未指出N2 所处的温度和压强,不能用标准状况下的气体摩尔体积进行计算,A项错误;N2H4在常温常压下为液体,说明其在标准状况下不是气体,故不能根据标准状况下的气体摩尔体积来计算,B项错误;在题述反应中,氧元素的价态由-1变为-2,故当生成3.6 g(0.2 mol)水时,转移0.2 mol电子,C项正确;3.2 g N2H4的物质的量为0.1 mol,1 mol N2H4中含5 mol共用电子对,故3.2 g N2H4中含共用电子对的总数为0.5NA,D项错误。 答案 C 11.H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( ) A.M室发生的电极反应式为2H2O-4e-===O2↑+4H+ B.N室中:a%查看更多