化学卷·2018届广西壮族自治区田阳高中高二4月段考(期中)(2017
2017年春季学期田阳高中段考
高二化学试题(理)
命题人:韦龙军 审题人:黄健
试卷卷面分共100分,考试时间90分钟。
一、单项选择题(本题包括16小题,每小题3分,共48分)
1.反应4A(s)+3B(g)===2C(g)+D(g),2min后B的浓度减小0.6mol·L-1。对此反应速率的不正确表示是( )
A.用A表示的反应速率是0.8mol·L-1·min-1
B.用B、C、D分别表示反应速率,其比值是3:2:1
C.在2min内的反应速率,用B表示是0.3mol·L-1·min-1
D.在2min内的反应速率,用D表示是0.1mol·L-1·min-1
2.下列溶液一定是碱性的是 ( )
A.pH=8的某电解质的溶液 B.c(OH-)>1×10-7mol/L
C.溶液中含有OH- D.溶液中c(OH-)>c(H+)
3.反应C(s)+H2O(g)CO(g)+H2(g)在一密闭容器中进行,下列条件的改变能使反应速率减小的是( )
A.减少碳的量 B.保持体积不变,增加水蒸气的量
C.将容器体积缩小一半 D.保持压强不变,充入Ne
4.在下列各说法中,正确的是( )
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
5.已知某温度下,四种一元弱酸的电离平衡常数为:Ka (HCN)=6.2×10-10 mol/L、Ka(HF)=6.8×10-4 mol/L、Ka(CH3COOH)=1.8×10-5 mol/L、Ka(HNO2)=6.4×10-6 mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是 ( )
A.NaCN B.CH3COONa C.NaF D.NaNO2
6.铝与稀硫酸反应中,经过10 s硫酸的浓度减少了0.6mol/L ,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是( )
A.0.02mol/(L·s) B.1.2mol/(L·s) C.1.8mol/(L·s) D.3.6mol/(L·s)
7.有如下三个热化学方程式:
H2(g)+O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.b
0 B.压缩体积增大压强,C(H2)不变
C.升高温度,逆反应速率减小 D.该反应化学方程式为CO+H2OCO2+H2
9.下列各组离子能大量共存且溶液颜色为无色的是( )
A.Na+、MnO4-、K+、NO3-、SO32- B.AL3+、S2-、CO32-、Cl-、NO3-
C.Na+、S2-、OH-、K+、Cl-、NO3- D.Fe2+、H+、Na+、Ca2+、NO3-
10.一定温度下,在固定体积的密闭容器中发生下列反应3A(g) === B(g)+2C (g)。若c(A)由
1mol·L-1降到0.8mol·L-1时,需要10 s,那么c(A)由0.8mol·L-1降到0.4mol·L-1时,
所需反应的时间为( )
A.5 s B.大于20 s C.10 s D.20 s
11.已知25℃时,合成氨反应N2(g)+3H2(g)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的
1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为
23 kJ(假定测量过程中没有能量损失),则N2的转化率为( )
A.25% B.50% C.75% D.无法确定
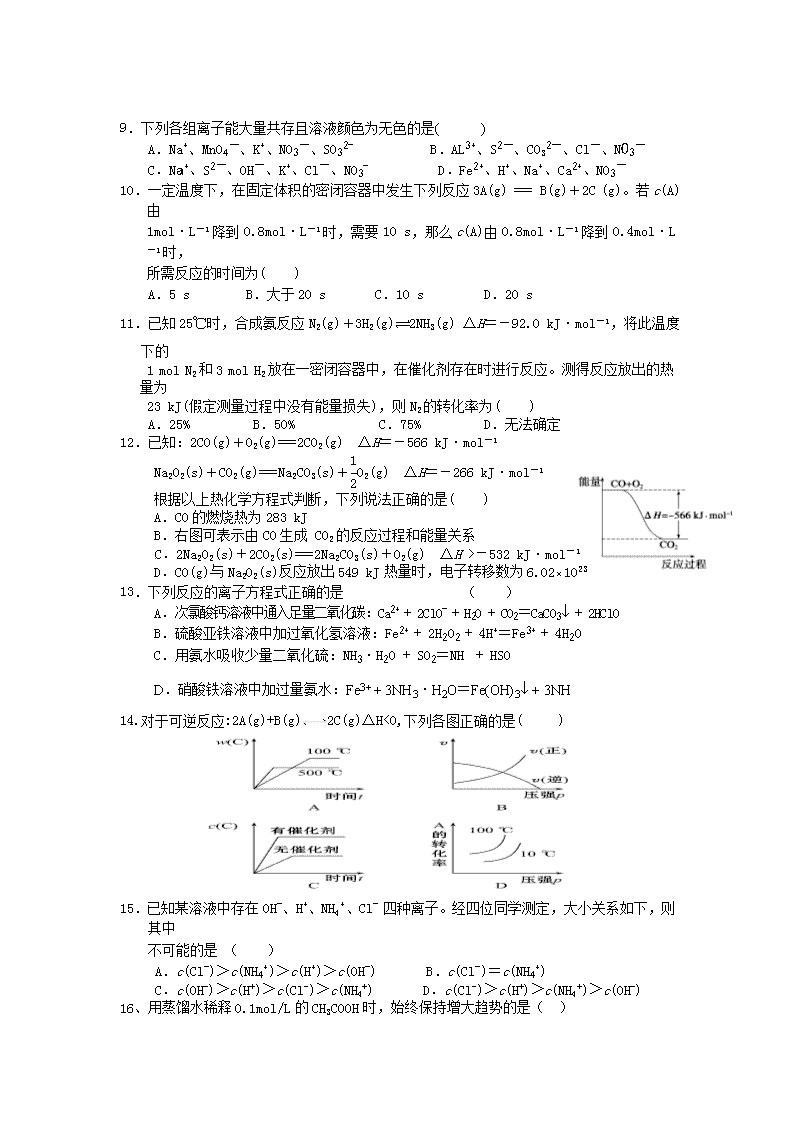
12.已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成 CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH >-532 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
13.下列反应的离子方程式正确的是 ( )
A.次氯酸钙溶液中通入足量二氧化碳:Ca2+ + 2ClO- + H2O + CO2=CaCO3¯ + 2HClO
B.硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+=Fe3+ + 4H2O
C.用氨水吸收少量二氧化硫:NH3·H2O + SO2=NH+ HSO
D.硝酸铁溶液中加过量氨水:Fe3+ + 3NH3·H2O=Fe(OH)3¯ + 3NH
14.对于可逆反应:2A(g)+B(g)2C(g)ΔH<0,下列各图正确的是( )
15.已知某溶液中存在OH-、H+、NH4+、Cl- 四种离子。经四位同学测定,大小关系如下,则其中
不可能的是 ( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)=c(NH4+)
C.c(OH-)>c(H+)>c(Cl-)>c(NH4+) D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
16、用蒸馏水稀释0.1mol/L的CH3COOH时,始终保持增大趋势的是( )
A.c(CH3COOH) B. c(OH-) C. c(H+) D. c(CH3COO-)
二、非选择题(共52分)
17.(14分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是_____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_________,密度________。
(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_________ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度___________ (填“大于”、“小于”或“等于”)原来的2倍。
18、(12分)请完成下列各空:(1)①0.01mol/L CH3COOH溶液的pH 2(填“>”或“<”) ;
②0.1mol/L CH3COONa溶液的pH 7(填“>”或“<”)。
(2)观察以上两个小题,试设计实验证明某酸(HA)是弱电解质
;
(3)用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数
NaOH终点读数
第一次
0.10mL
18.30mL
第二次
0.20mL
18.00mL
①根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
②达到滴定终点的标志是
③以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
19.(12分)试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________________________________________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
请填空:
共价键
H—H
Cl—Cl
H—Cl
键能/(kJ·mol-1)
436
247
________
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、
c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:__________________________________________________________________________。
(3)体积相同、pH值相同的HCI溶液和CH3COOH溶液,与NaOH溶液中和,至溶液恰好呈中性,则
消耗NaOH物质的量HCI CH3COOH(填“<”“>”或“=”)。
20.(14分)【Ⅰ】将FeCL3溶液加热蒸干,再灼烧,写出此过程所发生的两个化学反应方程式: ; 。
【Ⅱ】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
工业上合成甲醇的反应为CO(g)+2H2(g)CH3OH(g)。
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,ΔS 0(填“<”“>”或“=”)。(2)一定温度、固定密闭容器中进行该反应,下列能说明反应已经达到平衡的是( )
A. CO的分解速率等于CH3OH的分解速率 B. 混合气体的密度不再变化
C.容器内压强不再变化 D.混合气体的平均相对分子量保持不变
(3)在300℃,5 MPa条件下,将0.20 mol的CO与0.58 mol H2的混合气体充入2L密闭容器中发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min内,以H2表示的平均
反应速率为 mol·L-1·min-1。
②300℃时该反应的平衡常数K= 。