- 2021-08-06 发布 |
- 37.5 KB |
- 22页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习实验化学课件(22张)
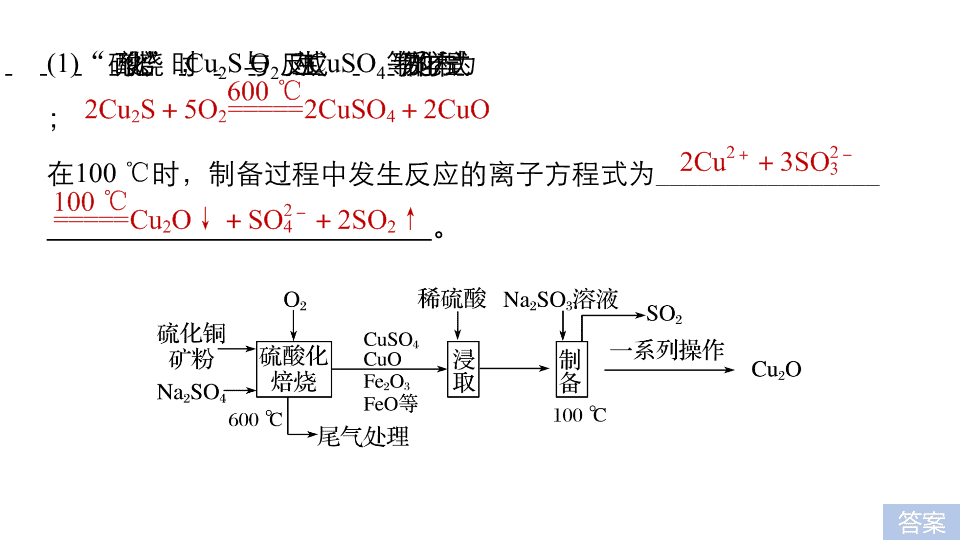
第四编 专题 十三 实验 化学 加试 31 题专练 1.(2018· 余姚中学高三选考模拟 )Cu 2 O 是一种在涂料、玻璃等领域应用非常广泛的红色氧化物。它不溶于水和醇,溶于盐酸、氯化铵、氨水,易被 O 2 、硝酸等氧化。一种以硫化铜矿石 ( 含 CuFeS 2 、 Cu 2 S 等 ) 为原料制取 Cu 2 O 的工艺流程如下: 答案 (1) “ 硫酸化焙烧 ” 时, Cu 2 S 与 O 2 反应生成 CuSO 4 等物质的化学方程式为 ; 在 100 ℃ 时,制备过程中发生反应的离子方程式为 ________________ 。 (2) 加入 Na 2 SO 4 的作用除减小物料间黏结外,另一主要作用是 ________ 。 解析 加入 Na 2 SO 4 的作用除减小物料间黏结外,另一主要作用是提高焙烧产物中 CuSO 4 的比例。 提高焙 烧产物中 CuSO 4 的比例 答案 解析 (3) “ 浸取 ” 时为提高铜的浸取率,除需控制液固物质的量之比外,还需控制 ( 至少列举两点 ) 。 解析 “ 浸取 ” 时为提高铜的浸取率,除需控制液固物质的量之比外,还需控制浸取温度、浸取时间、硫酸的浓度等。 (4) 得到产品 Cu 2 O 的一系列操作主要是 。 浸取温度、浸取时间、硫酸的浓度等 ( 答出两点即可 ) 抽滤、洗涤、干燥 答案 解析 (5) 下列有关说法正确的是 。 A. 焙烧时得到的尾气可用碱液加以处理 B.Cu 2 O 露置于空气中会变黑 C. 经一系列操作得到产品 Cu 2 O 后的副产品,经处理后可作净水剂 D. “ 制备 ” 时,溶液的 pH 越小, Cu 2 O 的产率越高 解析 焙烧时得到的尾气为 SO 2 ,可用碱液加以处理,故 A 正确; Cu 2 O 易被 O 2 氧化,露置于空气中会被氧化为黑色 CuO ,故 B 正确; 经一系列操作得到产品 Cu 2 O 后的副产品硫酸铁,水解产生 Fe(OH) 3 ,可用作净水剂,故 C 正确; Cu 2 O 在酸溶液中会发生自身氧化还原反应生成 Cu 和 Cu 2 + ,故 D 错误。 解析 答案 √ √ √ 2. 为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸 ( 高沸点酸 ) 将样品中的氟元素转化为氟化氢 ( 低沸点酸 ) 蒸出,再通过滴定测量。实验装置如图所示。 (1) 导管 a 的作用是 ,仪器 d 的名称是 。 解析 a 的作用是平衡压强,防止圆底烧瓶中压强过大,引起爆炸, d 的名称是直形冷凝管。 解析 答案 平衡压强 直形冷凝管 (2) 检查装置气密性: ( 填操作 ) ,关闭 K ,微热 c ,导管 e 末端有气泡冒出;停止加热,导管 e 内有一段稳定的水柱,说明装置气密性良好。 答案 在 b 和 f 中加水,水浸没导管 a 和 e 末端 (3)c 中加入一定体积高氯酸和 m g 氟化稀土样品, f 中盛有滴加酚酞的 NaOH 溶液。加热 b 、 c ,使 b 中产生的水蒸气进入 c 。 ① 下列物质可代替高氯酸的是 ( 填字母 ) 。 A. 硝酸 B . 盐酸 C . 硫酸 D. 磷酸 解析 利用高氯酸 ( 高沸点酸 ) 将样品中的氟元素转化为氟化氢 ( 低沸点酸 ) 蒸出;硝酸易挥发,故 A 项错误; 盐酸易挥发,故 B 项错误; 硫酸难挥发,沸点高,故 C 项正确; 磷酸难挥发,沸点高,故 D 项正确; √ √ 解析 答案 ② 实验中除有 HF 气体外,可能还有少量 SiF 4 ( 易水解 ) 气体生成。若有 SiF 4 生成,实验结果将 ( 填 “ 偏高 ”“ 偏低 ” 或 “ 不受影响 ” ) 。 解析 实验中除有 HF 气体外,可能还有少量 SiF 4 ( 易水解 ) 气体生成,若有 SiF 4 生成实验结果将不受影响。 ③ 若观察到 f 中溶液红色褪去,需要向 f 中及时补加 NaOH 溶液,否则会使实验结果偏低,原因是 。 解析 答案 不受影响 充分吸收 HF 气体,防止其挥发损失 (4) 向馏出液中加入 V 1 mL c 1 mol·L - 1 La(NO 3 ) 3 溶液,得到 LaF 3 沉淀,再用 c 2 mol·L - 1 EDTA 标准溶液滴定剩余 La 3 + (La 3 + 与 EDTA 按 1 ∶ 1 络合 ) , 消耗 EDTA 标准溶液 V 2 mL ,则氟化稀土样品中氟的质量分数为 。 解析 答案 (5) 用样品进行实验前,需要用 0.084 g 氟化钠代替样品进行实验,改变条件 ( 高氯酸用量、反应温度、蒸馏时间 ) ,测量并计算出氟元素质量,重复多次。该操作的目的是 。 解析 该操作的目的是通过做对比实验,寻找最佳实验条件。 解析 答案 寻找最佳实验条件 3.(2017· 杭州第二中学高三上学期选考 ) 碘酸钙 [ Ca(IO 3 ) 2 ·6H 2 O ] 可以按照如下反应来制备: I 2 + 2KClO 3 + HCl == =KIO 3 ·HIO 3 + KCl + Cl 2 ↑ KIO 3 ·HIO 3 + KOH == =2KIO 3 + H 2 O CaCl 2 + 2KIO 3 == =Ca(IO 3 ) 2 ↓ + 2KCl 冷却结晶过程中得到的产物随温度不同会带不同数目的结晶水,如下表: 碘酸钙存在形式 Ca(IO 3 ) 2 Ca(IO 3 ) 2 ·H 2 O Ca(IO 3 ) 2 ·6H 2 O 稳定温度 > 57.5 ℃ 32 ~ 57.5 ℃ < 32 ℃ [ 实验步骤 ] Ⅰ . 碘酸钙的制备: 如图 1 接好装置,在圆底烧瓶中依次加入 2.54 g 碘、 2.50 g 氯酸钾和水,滴加盐酸。通电加热搅拌,水浴温度保持在 85 ℃ 左右,直至反应完全。将溶液转入烧杯中,滴加 KOH 溶液至 pH ≈ 10 ,逐渐加入 CaCl 2 溶液,生成白色沉淀,不断搅拌至沉淀完全。反应混合物先用水冷却,再在冰水中静置 10 min ,然后用双层滤纸抽滤,用少量冰水洗涤,再用少量无水乙醇洗涤,干燥后得产品 3.78 g 。 Ⅱ . 产品纯度分析: 准确称取 0.500 0 g 样品,置于烧杯中,加入高氯酸,微热溶解试样,冷却后移入 250 mL 容量瓶中,加水稀释定容,摇匀。移取 25.00 mL 试液置于碘量瓶 ( 如图 2) 中,加入 1 ∶ 1 高氯酸酸化, 一定量 KI 固体,盖上瓶塞,在暗处放置反应 3 min ,加水,用 0.040 00 mol·L - 1 硫代硫酸钠标准溶液滴至溶液呈浅黄色,加淀粉溶液 2 mL ,继续滴定至终点,平行测定多次,实验数据记录如下: 1 2 3 4 滴定起始刻度 /mL 0.20 1.52 0.84 1.16 滴定终止刻度 /mL 31.53 31.50 30.84 31.18 Na 2 S 2 O 3 溶液用量 /mL 附:本题使用的摩尔质量 (g·mol - 1 ) 碘酸钙无水盐: 389.88 一水合物: 407.90 六水合物: 497.99 碘酸钾: 214.00 碘: 253.80 请回答: (1) 本实验中 C 烧杯内装的溶液是 ,作用是 。 (2) 根据 现象,可以判定碘与氯酸钾的反应已进行完全。 (3) 加入 CaCl 2 溶液后需检验沉淀是否完全,写出检验的步骤及方法 ______________________________________________________________ 。 (4) 在进行产品纯度分析的时候,发生了如下反应,请写出第一步的离子方程式: 第一步: ; 第二步: 2Na 2 S 2 O 3 + I 2 ===Na 2 S 4 O 6 + 2NaI 。 答案 氢氧化钠溶液 吸收尾气氯气 反应至溶液无色 取上层清液少许于试管中,加入少量 CaCl 2 溶液,若不变浑浊,说明已沉淀完全 (5) 该实验的产率为 ,产品的纯度为 。 解析 答案 75.91% 99.60% 解析 4 次滴定实验,每次消耗 Na 2 S 2 O 3 的体积分别为 31.53 mL - 0.20 mL = 31.33 mL 31.50 mL - 1.52 mL = 29.98 mL 30.84 mL - 0.84 mL = 30.00 mL 31.18 mL - 1.16 mL = 30.02 mL 第 1 次舍去,平均消耗 Na 2 S 2 O 3 的体积为 30.00 mL 2 × 10 - 4 mol 30.00 × 10 - 3 × 0.040 00 = 1.2 × 10 - 3 mol 所以 Ca(IO 3 ) 2 ·6H 2 O 的质量为 所以 Ca(IO 3 ) 2 ·6H 2 O 的理论产量为 0.01 mol × 497.99 g·mol - 1 = 4.979 9 g (6) 下列操作说法中正确的是 ________ 。 A . 制备过程水浴加热时,冷凝管下口出现固体未作处理会使产率偏低 B . 制备过程未使用冰水浴,会使产率偏高 C . 产品纯度分析时加入稍过量 KI 对实验没有影响 D . 滴定完成后,仰视滴定管读数会使纯度偏高 答案 √ √ √查看更多