- 2021-08-06 发布 |
- 37.5 KB |
- 26页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新教材高中化学第三章自然界中的元素第二节第2课时氨与铵态氮肥课件鲁科版必修1
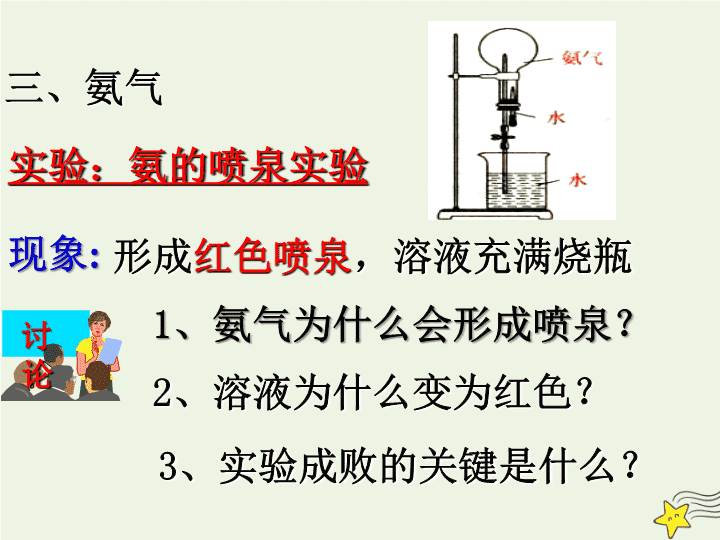
第 2 节 氮的循环 学习目标 认识氨气的溶解性,氨与水的反应,以及氨的还原性。 5.认识铵盐的受热分解、铵盐与碱的反应,认识铵态氮肥的使用问题,了解它们在生产中的应用 第 2 课时 氨与铵态氮肥 一 . 氨气的物理性质 4. 极易液化 , 液氨汽化时要吸收大量热 1. 无色 , 有特殊刺激性气味的气体 3. 极易溶于水 . 常温常压下 ,1V 水 约能溶解 700V 氨气 2. 氨气密度比空气小( M=17g/mol ) 三、氨气 实验:氨的喷泉实验 现象 : 形成 红色喷泉 ,溶液充满烧瓶 讨论 2 、溶液为什么变为红色? 3 、实验成败的关键是什么? 1 、氨气为什么会形成喷泉? 2 、溶液为什么变为红色? 3 、实验成败的关键是什么? 1 、氨为什么会形成喷泉? a.NH 3 纯度尽可能高,且装满 b. 烧瓶干燥; c. 装置气密性好; 氨水溶液显碱性 氨极易溶于水,使烧瓶内压强迅速减小,形成较大的压强差 结论: 氨气 溶于水,氨气溶于水显 。 规律: 烧瓶内外形成较大的压强差,均可形成喷泉 极易 碱性 喷泉实验: 现象 : 形成红色喷泉,溶液充满烧瓶 操作: 打开止水夹 , 挤压 胶头滴管使水进入圆底烧瓶。 是否只有极易溶于水的气体才能进行喷泉实验?若不是,还有哪些气体可以? 提示 : ① 极易溶解于水的气体,如 NH 3 、 HCl 等可进行喷泉实验。②气体极易与某种溶液反应,如 SO 2 、 CO 2 、 Cl 2 与浓 NaOH 溶液, NH 3 与稀盐酸; 为何氨气溶于水显碱性? 氨水 中存在的微粒: NH 3 、 H 2 O 、 NH 3 · H 2 O 、 NH 4 + 、 OH - 、 H + ① 与水反应 NH 3 +H 2 O NH 3 ·H 2 O NH 4 + +OH - NH 3 ·H 2 O 氨水是混合物,液氨(非)、一水合氨(弱)是纯净物 一水合氨 ② 与酸反应 NH 3 + HCl = NH 4 Cl 现象: 生成大量 白烟 实验:浓氨水与浓盐酸 浓盐酸、浓氨水易挥发 1 、说明盐酸和浓氨水具有什么性质? 2. 将蘸有 浓氨水 和 浓硝酸 的玻璃棒靠近,有何现象? 白烟 3. 将蘸有 浓氨水 和 浓硫酸 的玻璃棒靠近,有何现象? 无明显现象 浓氨水与 挥发性酸 相遇时均有 白烟生成 。 NH 3 + HNO 3 = NH 4 NO 3 2NH 3 + H 2 SO 4 = ( NH 4 ) 2 SO 4 实质: NH 3 + H + == NH 4 + 写出与酸反应的方程式 NH 3 + HCl = NH 4 Cl 氨气是一种碱性气体 , 它能使 湿润的红色石蕊试纸变蓝 。 ③ 与 O 2 反应 ( 氨的催化氧化 ) ? 氧化剂、还原剂分别是?转移电子数为? 4 NH 3 + 5 O 2 4 NO + 6 H 2 O 高温 催化剂 氨中氮元素化合价为最低价,具有 还原性 ,能与具有氧化性的物质发生反应。 氨的催化氧化(工业制硝酸的一步) 实验操作 实验现象 结论 加热氯化铵固体 加热碳酸氢铵固体 ① 试管中固体逐渐 消失, ②试管口有 白色固体 生成 氯化铵固体受热分解,生成的 NH 3 和 HCl 在试管口反应生成 NH 4 Cl ① 试管中固体逐渐消失; ②试管口有 水珠 生成; ③石灰水 变浑浊 碳酸氢铵固体受热易分解生成 H 2 O 和 CO 2 , NH 3 加热氯化铵固体的实验 加热碳酸氢铵固体的实验 实验操作 实验现象 结论 氯化铵固体与 NaOH 溶液反应 湿润的红色石蕊试纸变 蓝 色 氯化铵固体与 NaOH 溶液反应 产生 NH 3 【 思考 】 1. 如何检验某溶液中是否含有 NH 4 + ? 2. 从离子反应的角度分析铵盐与强碱溶液反应的实质(写出铵盐和强碱溶液反应的离子方程式) ①铵盐与强碱溶液 ②铵盐与浓强碱溶液加热 取溶液少许于试管中,加入浓氢氧化钠溶液, 加热 ,若生成的气体使湿润的红色石蕊试纸变蓝,说明溶液中含有 NH 4 + NH 4 + +OH - ==NH 3 ·H 2 O NH 4 + +OH - NH 3 ↑ +H 2 O 3 、铵态氮肥不能与草木灰等碱性物质混合施用的原因是什么? 4 、如何除去氯化钠中混有的氯化铵固体? 铵态氮肥中的铵根离子与碱性物质中的氢氧根离子能反应生成氨气逸出,降低氮肥肥效。 加热法 a. 受热易分解: NH 4 Cl NH 3 ↑+HCl↑ NH 4 HCO 3 NH 3 ↑ +CO 2 ↑+H 2 O b. 与碱溶液反应: NH 4 + +OH - NH 3 ↑+H 2 O NH 4 + +OH - == NH 3 . H 2 O 【 小结 】 铵盐的化学性质 (二)实验室制氨气 1 、反应原理: 2 、反应装置: 2NH 4 Cl+Ca(OH) 2 CaCl 2 +2NH 3 ↑ +2H 2 O 反应原理决定反应装置 复分解反应 1 、 实验室制氨气时不用氢氧化钠固体来代替氢氧化钙固体 2 、图中的反应装置和收集装置,应注意哪些问题? 反应装置:试管口向下倾斜 收集装置:导气管插到试管底部 若将棉花换为一个单孔橡皮塞可以吗? 3 、装置中收集氨气的试管口的棉花的作用是什么?你在以前学过的哪个实验中也用过棉花? 4 、从反应原理分析,氨气中可能混有的杂质?如何除去? 防止氨气与空气对流,提高氨气的纯度 。 混有水蒸气 CaO 、碱石灰等碱性干燥剂 NaOH 和 CaO 的混合物 无水 CaCl 2 不能用来干燥 NH 3 (形成 CaCl 2 · 8NH 3 ) 干燥氨气装置图 大进小出 5 、氨气如何验满? 6 、多余的氨气如何处理? 常用的尾气处理方法有哪些? ① 用湿润的红色石蕊试纸靠近瓶口,看试纸是否变蓝 ② 用玻璃棒一端蘸取浓盐酸靠近瓶口,看是否产生白烟 用水吸收。 通常有毒和有污染的尾气必须适当处理。常用仪器有: 氨气尾气吸收常采用的防倒吸装置有: 8 、实验室其他快速制氨气的方法 ① 加热浓氨水法 ② 浓氨水和 NaOH 固体法 反应装置:固液不加热制气装置。 NaOH 浓氨水 ③ 浓氨水加碱石灰法 1. 氨气与铵盐的性质 2. 氨气的制备查看更多