- 2021-08-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖南省武冈二中2018-2019学年高二上学期期中考试化学(理)试卷 Word版缺答案
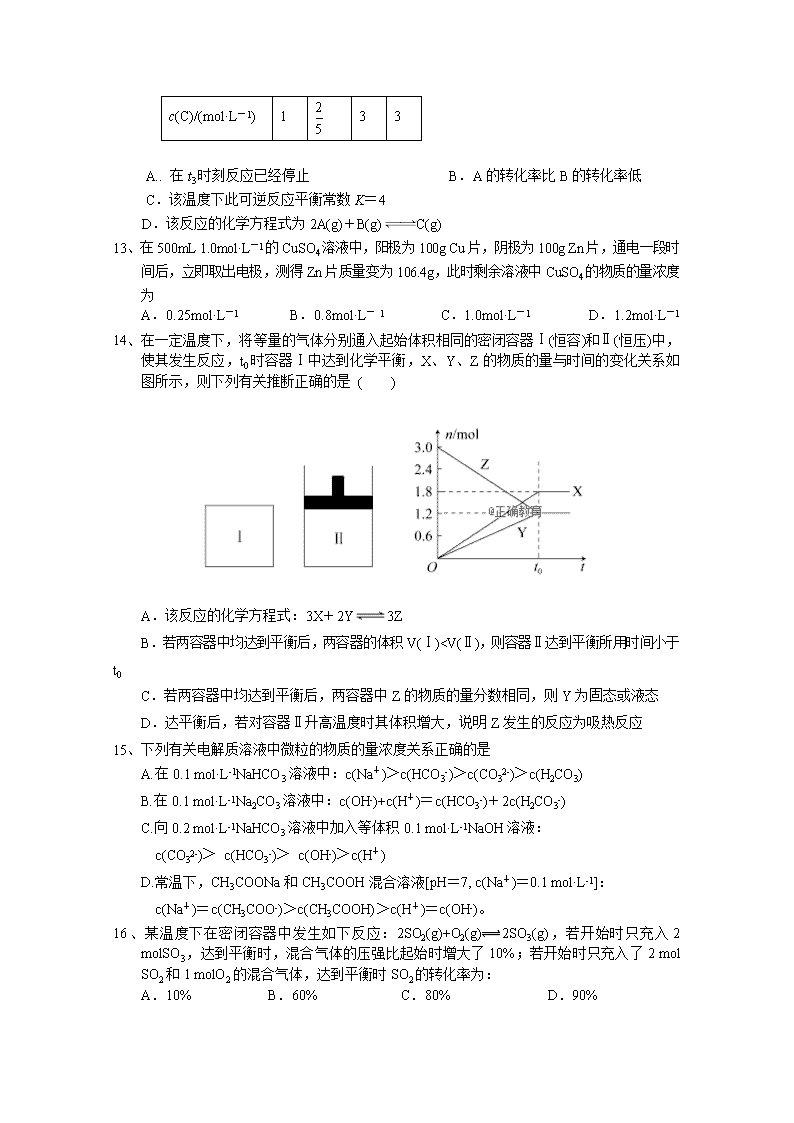
武冈二中高二年级年下学期期中考试 化学试题(理科) 时量:90分钟 满分:100分 命题人:邓南夫 本试卷分选择题和非选择题两部分,满分100分,考试用时90分钟。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 Cu 64 Zn 65 Ba137 第一部分 选择题(共48分) 一、选择题(本题包括小题,每小题3分,共48分。每小题只有一个选项符合题意) 1、某学生的实验报告所列出的下列数据中合理的是 A.用10mL量筒量取9.23mL稀盐酸 B.用托盘天平称量15.20g NaCl C.用广泛pH试纸测得某溶液的pH为5.3 D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液23.70mL 2、下列溶液加热蒸干后,能析出该溶质固体的是 A.FeCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3 3、锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环境无污染。电池总反应式为V2O5+xLi===LixV2O5。下列说法不正确的是 A.正极材料为锂,负极材料为V2O5 B.向外供电时,锂离子在凝胶中向正极移动 C.正极的电极反应式为:xLi++V2O5+xe-===LixV2O5 D.负极的电极反应式为:xLi-xe-===xLi+ 4、有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是 A.Y>Z>W>X B.Z>Y>W>X C.W>Z>Y>X D.X>Y>Z>W 5.、常温下在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为 A. A>B B. A=10-4 B C. B=10-4 A D. A=B 6、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液 A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥ 7、常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于 A. 9.0 B. 9.5 C. 10.5 D. 11.5 8、已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 KJ/mol 2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol 2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol 常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少KJ A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2 9、根据以下3个热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q1 kJ/mol 2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol 2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=―Q3 kJ/mol 判断Q1、Q2、Q3三者关系正确的是 A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3 10.、已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气 体通入 一容积为2 L的密闭容器中,反应物浓度随时间 变化关系如右图。下列说法不正确的是 A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线 B.前10 min内用v(N2O4)表示的化学反应速率为0.02 mol/(L·min) C.25 min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L D.前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L·min) 11、如图是温度和压强对X+Y2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( ) A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气体 C.X和Y中只有一种为气态,Z为气态 D.上述反应的逆反应ΔH>0 12、在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是 ( ) 测定时刻/s t1 t2 t3 t4 c(A)/(mol·L-1) 6 3 2 2 c(B)/(mol·L-1) 5 3.5 3 3 c(C)/(mol·L-1) 1 3 3 A.. 在t3时刻反应已经停止 B.A的转化率比B的转化率低 C.该温度下此可逆反应平衡常数K=4 D.该反应的化学方程式为2A(g)+B(g)C(g) 13、在500mL 1.0mol·L-1的CuSO4溶液中,阳极为100g Cu片,阴极为100g Zn片,通电一段时间后,立即取出电极,测得Zn片质量变为106.4g,此时剩余溶液中CuSO4的物质的量浓度为 A.0.25mol·L-1 B.0.8mol·L- 1 C.1.0mol·L-1 D.1.2mol·L-1 14、在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ(恒容)和Ⅱ(恒压)中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量与时间的变化关系如图所示,则下列有关推断正确的是 ( ) A.该反应的化学方程式:3X+2Y3Z B.若两容器中均达到平衡后,两容器的体积V(Ⅰ)查看更多
- 当前文档收益归属上传用户