2017-2018学年河南省林州市第一中学高二3月调研考试化学试题 Word版
河南省林州市第一中学2017-2018学年高二3月调研考试
化学
(时间:90 分钟 满分:100 分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1.一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S2)为电解质,该锂电池能在-100℃ 至100℃之间的超宽温度范围内工作,下列说法不正确的是
A.Li的原子结构示意图为 B.原子半径:P>S
C.酸性:H3PO4
S的实验依据是酸性HCl>H2S
B.碳元素的电负性小于氧元素,每个CO2 分子中有4 个σ键
C.同周期主族元素的原子形成的简单离子的电子层结构一定相同
D.C、N、O三种元素,其第-电离能由大到小的顺序为N>O>C
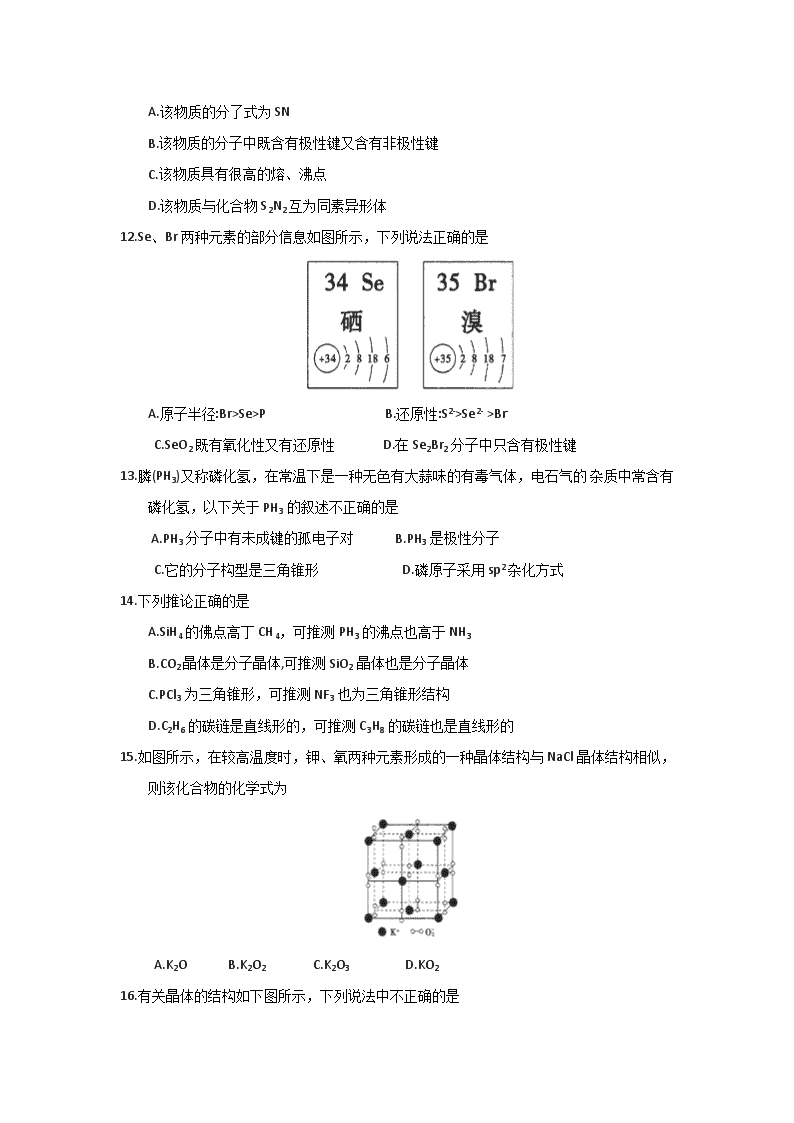
11.现代无机化学对硫一氮化合物的研究是最为活跃的领域之一。如图是已经合成的最著名的硫—氮化合物的分子结构,下列说法正确的是
A.该物质的分了式为SN
B.该物质的分子中既含有极性键又含有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
12.Se、Br 两种元素的部分信息如图所示,下列说法正确的是
A.原子半径:Br>Se>P B.还原性:S2->Se2- >Br-
C.SeO2 既有氧化性又有还原性 D.在Se2Br2分子中只含有极性键
13.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜味的有毒气体,电石气的 杂质中常含有磷化氢,以下关于PH3的叙述不正确的是
A.PH3分子中有未成键的孤电子对 B.PH3 是极性分子
C.它的分子构型是三角锥形 D.磷原子采用sp2杂化方式
14.下列推论正确的是
A.SiH4的佛点高丁CH4,可推测PH3 的沸点也高于NH3
B.CO2 晶体是分子晶体,可推测SiO2 晶体也是分子晶体
C.PCl3 为三角锥形,可推测NF3 也为三角锥形结构
D.C2H6的碳链是直线形的,可推测C3H8 的碳链也是直线形的
15.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl 晶体结构相似,则该化合物的化学式为
A.K2O B.K2O2 C.K2O3 D.KO2
16.有关晶体的结构如下图所示,下列说法中不正确的是
A.在NaCl 晶体中,距Na +最近的Cl -形成正八面体
B.在CaF2 晶体中,每个晶胞平均占有4 个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1: 2
D.该气态团簇分子的分子式为EF或FE
17.下列原子或原子团不属于官能团的是
A.—CH3 B.—F C.—OH D.
18.历史上最早应用的还原性染料是靛蓝,其结构简式为,下列关于靛蓝的叙述中 错误的是
A.靛蓝由碳、氢、氧、氮四种元素组成 B.它的分子式是C16H10N2O2
C.该物质属于芳香化合物 D.它含有碳碳双键和酯基
19.键线式可以简明扼要地表示碳氢化合物,如表示CH3CH2CH2CH2CH3,则表示的物质是
A.丁烷 B.丙烷 C.丁烯 D.丙烯
20.甲烷分子中的4 个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述 不正确的是
A.分子式为C25H20
B.该化合物为芳香烃
C.该化合物分子中所有原子不可能处于同一平面
D.分子中所有原子一定处于同一平面
21某烃的结构简式为, 分子中处于四面体结构中心的碳原子数为a,一定在同一平面内的碳原子数为b,一定在同一直线上的碳原子数为c,则a、b、c 依次为
A.4、5、3 B.4、6、3 C.2、4、5 D.4、4、6
22.下列各组有机物中,互为同分异构体的是
A 和 B. 和
C. 和 D. 和
23.下列烷烃在光照下与Cl2 反应只生成一种一氯代物的是
A.CH3CH2CH2CH3 B.
C. D.
24.下列每组中各有三对物质,它们都能用分液漏斗分离的是
A.乙酸乙酯和水,酒精和水,植物油和水 B.四氯化碳和水,溴苯和苯,硝基苯和水
C.甘油和水,乙酸和水,乙酸和乙醇 D.汽油和水,苯和水,已烷和水
25.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.核磁共振氢谱通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
二、填空题(本题包括四小题,共50分)
26.(14 分)决定物质性质的重要因素是物质的结构。请回答下列问题。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ/mol )
I1
I2
I3
I4
X
578
1817
2745
11578
Y
738
1451
7733
10540
X通常显_____价,X 的电负性____Y 的电负性 (填“>”“ =”或“<”)。
(2)紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________。
共价键
C-C键
C-N键
C-S键
键能/(kJ/mol)
347
305
259
组成蛋白质的最简单的氨基酸中的碳原子的杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN 这四种晶体的结构与NaCl 晶体结构相似(如图),其中3种离子晶体的晶格能数据如下表:
离子晶体
NaCl
KCl
CaO
晶格能/(kJ.mol-1 )
786
715
3401
则这四种离子晶体的熔点从高到低的顺序是_______。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型化合物V2O5和CrO2 中,适合作录音带磁粉原料的是_________。
27.(14分)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示:
(1)基态硼原子的电子排布式为_________________。
(2)关于这两种晶体的说法,正确的是______(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N 键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为______,其结构与石墨相似却不导电,原因是________________________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为________。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是________。
(5)NH4BF(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF 含有____mol 配位键。
28.(12 分)(1)写出下列化合物的名称或结构简式:
①_______________;
②CH2=C(CH3)CH=CH2 _______________;
③CH2=CHCOOH_______________;
④2,5-二甲基-2,4-己二烯的结构简式: _______________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如下:
①麻黄素中含氧官能团的名称是_______,属于_________(填“醇”或“ 酚” )类。
②下列各物质:
A. B.
C. D.
E.
与麻黄素互为同分异构体的是_______(填字母,下同),互为同系物的是_______。
29.(10 分)为测定某有机化合物A 的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 gCO2,消耗氧气6.72L.(标准状况下),则该物质的实验式是_____________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为________,该物质的分子式是___________。
(3)根据价键埋论;预测A的可能结构并写出结构简式:_______________________________。
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如甲基氯甲基醚(Cl-CH2-O-CH3,有2 种氢原于)的核磁共振氢谱如图1所示:
经测定;有机物A 的核磁共振氢谱图如图2 所示,则A的结构简式为________。
1-10:DCCAC BDCAD 11-20:BCDCD DADCD 21-25:BBCDC
26.(1)+3 >;
(2)紫外光具有的能量比蛋白质分子中的主要化学键C-C键、C-N键和C-S键的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;sp2和sp3
(3) TiN>MgO>CaO>KCl;12
(4 )CrO2
27. (1)1s22s22p1;(2)bc;(3)平面三角形;层状结构中没有自由移动的电子
(4)sp3;高温高压;(5)2
28.(1) ①2,4,5,7,7—五甲基—3,3,4-三乙基辛烷;
②2—甲基—1,3—丁二烯;③丙烯酸
④;
(2) ①羟基;醇;②D、E C
29.(1)C2H6O;(2)46、C2H6O;
(3)CH3CH2OH、CH3-O-CH3;(4)CH3CH2OH