- 2021-08-06 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学课时作业6分子的性质二含解析 人教版选修3
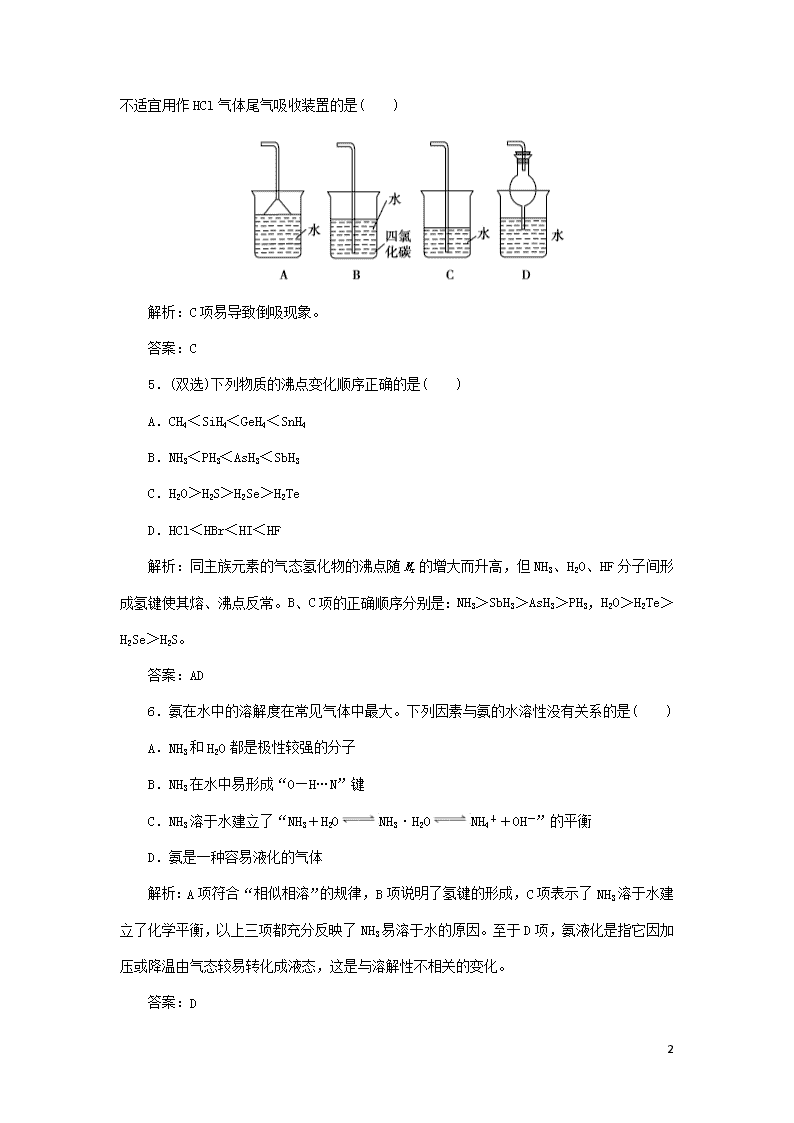
课时作业6 分子的性质(二) 1.乙醇固体中不存在的作用力是( ) A.离子键 B.极性键 C.非极性键 D.范德华力 解析:C2H5OH分子内存在极性键和非极性键(C—C键),分子间存在范德华力和氢键。 答案:A 2.下列叙述与分子间作用力无关的是( ) A.气体物质加压或降温时能凝结或凝固 B.干冰易升华 C.氟、氯、溴、碘单质的熔、沸点依次升高 D.氯化钠的熔点较高 解析:A、B、C三个选项中涉及的物质都是分子,故其表现的物理性质与分子间作用力的大小有关系。只有D选项中的NaCl是离子化合物,不存在小分子,其物理性质与分子间作用力无关。 答案:D 3.下列几种氢键:①O-H…O,②N-H…N,③F-H…F,④O-H…N,按氢键从强到弱的顺序正确的是( ) A.③>①>④>② B.①>②>③>④ C.③>②>①>④ D.①>④>③>② 解析:F、O、N电负性依次降低,F-H、O-H、N-H键的极性依次降低,故F-H…F中氢键最强,其次为O-H…O,再次是O-H…N,最弱的为N-H…N。 答案:A 4.判断物质在不同溶剂中的溶解性时,有一条经验规律:极性分子组成的溶剂易溶解极性分子组成的溶质;非极性分子组成的溶剂易溶解非极性分子组成的溶质。下图的装置中, 10 不适宜用作HCl气体尾气吸收装置的是( ) 解析:C项易导致倒吸现象。 答案:C 5.(双选)下列物质的沸点变化顺序正确的是( ) A.CH4<SiH4<GeH4<SnH4 B.NH3<PH3<AsH3<SbH3 C.H2O>H2S>H2Se>H2Te D.HCl<HBr<HI<HF 解析:同主族元素的气态氢化物的沸点随Mr的增大而升高,但NH3、H2O、HF分子间形成氢键使其熔、沸点反常。B、C项的正确顺序分别是:NH3>SbH3>AsH3>PH3,H2O>H2Te>H2Se>H2S。 答案:AD 6.氨在水中的溶解度在常见气体中最大。下列因素与氨的水溶性没有关系的是( ) A.NH3和H2O都是极性较强的分子 B.NH3在水中易形成“O—H…N”键 C.NH3溶于水建立了“NH3+H2ONH3·H2ONH4++OH-”的平衡 D.氨是一种容易液化的气体 解析:A项符合“相似相溶”的规律,B项说明了氢键的形成,C项表示了NH3溶于水建立了化学平衡,以上三项都充分反映了NH3易溶于水的原因。至于D项,氨液化是指它因加压或降温由气态较易转化成液态,这是与溶解性不相关的变化。 答案:D 10 7.关于氢键的下列说法中正确的是( ) A.每个水分子内含有两个氢键 B.在水蒸气、水和冰中都含有氢键 C.分子间能形成氢键使物质的熔点和沸点升高 D.HF的稳定性很强,是因为其分子间能形成氢键 解析:氢键属于分子间作用力,它主要影响物质的物理性质,与化学性质如稳定性等无关,D项不对;A项中说“水分子内”显然不对;B项中水蒸气分子间距离太远而不能形成氢键。 答案:C 8.与两者可以称作一对手性分子,是因为( ) A.它们一定有相同的组成 B.它们结构几乎一样 C.它们可以相互叠合成镜像 D.它们组成和排列相同却无法叠合 解析:A、B项说法没有反映手性异构体的本质关系;C项说法自相矛盾,因为既然互为镜像,就不可能叠合;只有D项,两者组成和排列顺序虽相同,却无法叠合,就只能互为镜像了。 答案:D 9.下列同组物质两种含氧酸中,前者比后者酸性弱的是( ) A.H2SO4和H2SO3 B.(HO)2RO2和(HO)2RO3 C.HNO3和HNO2 D.H2SiO3和H4SiO4 解析:(HO)2RO2和(HO)2RO3比较,前者的非羟基氧原子数少,酸性比后者弱。 答案:B 10.砷为第四周期第ⅤA族元素,依据它在周期表中的位置, 10 推测砷不可能具有的性质是( ) A.砷在通常状况下是固体 B.砷常见的化合价有-3、+3、+5 C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)弱 D.砷化氢(AsH3)不稳定,还原性比氨(NH3)弱 解析:As元素的非金属性比P元素弱,H3AsO4的酸性比H3PO4弱;AsH3的还原性比NH3强。 答案:D 11.L多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式为。这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果。下列关于L多巴的叙述不正确的是( ) A.有1个手性碳原子 B.含有—COOH,能与NaOH溶液反应 C.氨基(—NH2)中的氮原子还有一对孤对电子,能与H+形成配位键 D.分子式为C9H9NO4 解析:与—COOH相连的碳原子是手性碳原子,—COOH能与NaOH溶液反应:—COOH+OH-―→—COO-+H2O,—NH2能与强酸反应:—NH2+H+―→—NH3+(形成配位键),所以A、B、C项均正确。其分子式为C9H11NO4,D项不正确。 答案:D 12.A、B、C、D为原子序数依次增大的同周期的短周期元素。已知A、C、D三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是( ) A.A、C、D三种元素的最高价氧化物对应的水化物有两种是强碱、一种是强酸, 10 或两种是强酸、一种是强碱 B.A、C、D三种元素有两种是金属、一种是非金属 C.D元素在第三周期第ⅥA族 D.A、B、C三种元素的单质熔沸点依次降低 解析:A为Na,B为Mg,C为Al,D为Cl。 答案:B 13.已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子是XY4。 试回答: (1)X元素原子的基态电子排布式为______; Y元素原子最外层电子的电子排布图为______。 (2)若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。 (3)该化合物的空间结构为______,中心原子的杂化类型为______,分子为______(填“极性”或“非极性”)分子。 (4)该化合物在常温下为液体,它存在的分子间作用力是______。 (5)该化合物的沸点与SiCl4的比较,______(填化学式)的高,原因是______________________________________。 解析:由题意知,X元素为Ge元素,Y元素为Cl元素,原子结构示意图为。 (1)Ge元素原子的基态电子排布式为:1s22s22p63s23p63d104s24p2;Cl元素原子最外层电子排布图为 。 (2)Ge、Cl两元素的电负性差值为0.75,数值较小,所以二者形成共价键。 (3)GeCl4的结构与CCl4的结构相似,其空间结构为正四面体形,中心原子Ge采取sp3杂化,形成4条杂化轨道,该分子为非极性分子。 10 (4)分子间存在的作用力为范德华力。 (5)GeCl4与SiCl4都是分子晶体,且结构相似,但GeCl4的相对分子质量大,分子间作用力强,熔、沸点高。 答案:(1)1s22s22p63s23p63d104s24p2 (2)共价键 (3)正四面体 sp3杂化 非极性 (4)范德华力 (5)GeCl4 二者都为分子晶体结构相似,但GeCl4相对分子质量大,分子间作用力强,熔、沸点高 14.(2018年高考·课标全国卷Ⅰ)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题: (1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为______、______(填标号)。 (2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是________________。 (3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为__________________。LiAlH4中,存在______________(填标号)。 A.离子键 B.σ键 C.π键 D.氢键 解析:(1)根据能级能量E(1s)查看更多