- 2021-08-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学必修一全册课后优化训练:2-2-1含解析
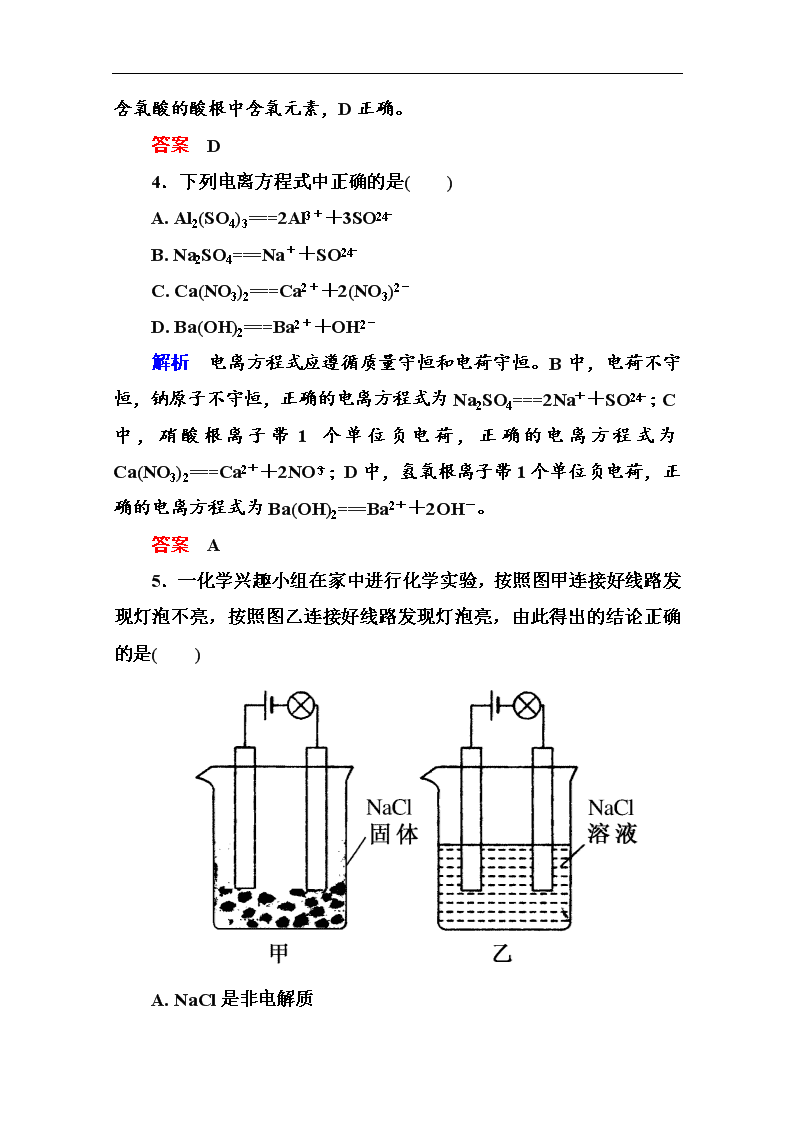
课后优化训练 基 础 强 化 1.下列状态的物质,既能导电又属于电解质的是( ) A. 氯化钠固体 B. 硫酸钾溶液 C. 碳棒 D. 熔融氢氧化钾 解析 本题有两个限制条件:一是能导电,二是属于电解质。A中氯化钠固体属于电解质,但固体中离子不能自由移动,故不能导电;B中硫酸钾溶液能导电,但属于混合物,不属于电解质;C中碳棒主要成分是石墨,是一种单质,能导电,但不是电解质。 答案 D 2.下列物质中,不能电离出酸根离子的是( ) A.Ca(OH)2 B.KMnO4 C.KCl D.NaHSO4 解析 Ca(OH)2是碱,电离出的是钙离子和氢氧根离子,其他三种物质均能电离出酸根离子。 答案 A 3.关于酸、碱、盐的下列各种说法中,正确的是( ) A. 化合物电离时,生成的阳离子是氢离子的是酸 B. 化合物电离时,生成的阴离子是氢氧根离子的是碱 C. 化合物电离时,只生成金属阳离子和酸根离子的是盐 D. 酸根中可能含有氧元素 解析 根据酸(碱)概念中的“全部”二字,可判断A、B错;C中应表述为“电离时,有金属(或铵根)离子和酸根离子生成的化合物叫盐”,如NaHSO4电离时,除生成Na+、SO外,还有H+ ,但它仍是一种盐;D中酸有含氧酸与非含氧酸之分,非含氧酸的酸根中不含氧元素,含氧酸的酸根中含氧元素,D正确。 答案 D 4.下列电离方程式中正确的是( ) A. Al2(SO4)3===2Al3++3SO B. Na2SO4===Na++SO C. Ca(NO3)2===Ca2++2(NO3)2- D. Ba(OH)2===Ba2++OH2- 解析 电离方程式应遵循质量守恒和电荷守恒。B中,电荷不守恒,钠原子不守恒,正确的电离方程式为Na2SO4===2Na++SO;C中,硝酸根离子带1个单位负电荷,正确的电离方程式为Ca(NO3)2===Ca2++2NO;D中,氢氧根离子带1个单位负电荷,正确的电离方程式为Ba(OH)2===Ba2++2OH-。 答案 A 5.一化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是( ) A. NaCl是非电解质 B. NaCl溶液是电解质 C. NaCl在溶液中电离出了可以自由移动的离子 D. NaCl溶液中的水电离出大量的离子 解析 甲中不导电是因为NaCl固体中没有自由移动的离子;乙中导电是因为NaCl在水中电离出自由移动的离子,NaCl是电解质,NaCl溶液是混合物不是电解质也不是非电解质。 答案 C 6.有关电解质的下列叙述正确的是( ) A. Na2O、CaO等物质熔融状态时都导电,因此它们都是电解质 B. HCl、H2SO4液态时都不导电,因此它们都是非电解质 C. 易溶于水的化合物都是电解质 D. 浓溶液的导电能力一定强 解析 Na2O、CaO是化合物,熔融状态能导电,故它们是电解质,A正确;HCl、H2SO4溶于水能导电,它们是电解质,B错误;NH3、蔗糖易溶于水,但它们均为非电解质,C错误;蔗糖的浓溶液不导电,导电与离子浓度等有关,D错误。 答案 A 7.以下反应会导致溶液导电性减弱的是( ) A. Na2SO4溶液加入BaCl2固体 B. Ba(OH)2溶液中加入CuSO4(少量)固体 C. NaOH溶液通入HCl D. H2O中加入NaCl固体 解析 导电性与溶液中自由移动离子的浓度及所带的电荷有关,在A中虽然生成了BaSO4 沉淀,但在溶液中的离子浓度增大了,导电性并没有减弱;B项中生成了两种不溶物,溶液中离子浓度显著降低,故B中导电性减弱;C中NaOH与HCl反应生成了NaCl和水,而溶液中离子浓度变化不大,因此导电性变化不大;D中溶液离子浓度会增加,导电性会增强。 答案 B 8.以下12种为中学化学中常见的物质: ①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH(酒精) ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2 ⑩Fe(OH)3 ⑪NaOH ⑫NH3·H2O 请按下列分类标准回答问题。 (1)属于电解质的是________。 (2)能电离出H+的是________,属于酸的是________。 (3)属于碱的是________,其中属于难溶性碱的是________。 (4)属于难溶的盐是________。 答案 (1)②③⑤⑦⑧⑨⑩⑪⑫ (2)③⑤ ⑤ (3)⑨⑩⑪⑫ ⑨⑩ (4)⑦⑧ 能 力 提 升 1.物质M在水中发生如下电离:M===X2++2Y-,则下列判断正确的是( ) A. M可能是酸 B. X2+一定是金属离子 C. Y-是OH- D. M一定属于盐 解析 根据离子所带电荷分析,可知X2+不是H+、NH,必定为金属离子;M不一定为盐,如Ba(OH)2===Ba2++2OH-,电离形式与题干相同;Y-不一定是OH-,如BaCl2===Ba2++2Cl- ,电离形式与题干相同,故只有B正确。 答案 B 2.下列说法正确的是( ) A. 水导电性很差,所以水是非电解质 B. 电解质与非电解质的本质区别,是在一定条件下能否电离 C. 酸、碱和盐类都属于电解质,其他化合物都是非电解质 D. NaCl和HCl都是电解质,所以它们熔融状态下都能导电 解析 水是电解质能电离出H+与OH-,A错;部分氧化物也属于电解质,如Na2O、CaO,C错;HCl在熔融状态下只存在HCl分子,无自由移动的离子,不能导电,D错。 答案 B 3.下列有关混合物、纯净物、电解质、非电解质的正确组合为( ) 纯净物 混合物 电解质 非电解质 A. 纯盐酸 水煤气 硫酸 干冰 B. 蒸馏水 蔗糖溶液 氧化铝 二氧化硫 C. 胆矾 氢氧化铁胶体 铁 碳酸钙 D. 水银 澄清石灰水 氯化铜 碳酸钠 解析 纯净物是由同一种分子组成的物质;混合物是由不同种分子组成的物质;电解质是在水溶液里或熔融状态下能导电的化合物,而在两种状态下都不能导电的化合物为非电解质。盐酸为HCl的水溶液,一定为混合物,则A错;C项中铁为单质,既不是电解质,也不是非电解质,则C错;D项中Na2CO3为电解质,则D错。 答案 B 4.已知Ca(OH)2、CaCO3和Ca(HCO3)2都是电解质,进行如图所示的实验,请将实验现象填入下表中的空格处。 实验操作 灯泡亮度变化 (1)通入CO2之前 亮 (2)开始通入CO2时 (3)恰好完全沉淀 (4)沉淀完全后,继续通入过量CO2 (5)再通入CO2 解析 通CO2之前溶液中含有Ca(OH)2电离产生的Ca2+、OH-,灯泡亮;通入CO2发生反应CO2+Ca(OH)2===CaCO3↓+H2O,溶液中自由移动的离子减少灯泡由亮变暗;当CO2与Ca(OH)2恰好反应时,溶液中的离子很少,灯泡熄灭;当沉淀完全后,继续通入过量CO2,发生反应CO2+H2O+CaCO3===Ca(HCO3)2,Ca(HCO3)易溶于水,且能电离出Ca2+、HCO,溶液又变亮;再通入CO2,溶液中离子浓度几乎不变,灯泡明亮程度与操作前几乎不变。 答案 (2)由亮变暗 (3)熄灭 (4)又变亮 (5)明亮程度与操作前几乎不变 查看更多