- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江苏省扬州中学高二下学期4月月考试题 化学 Word版
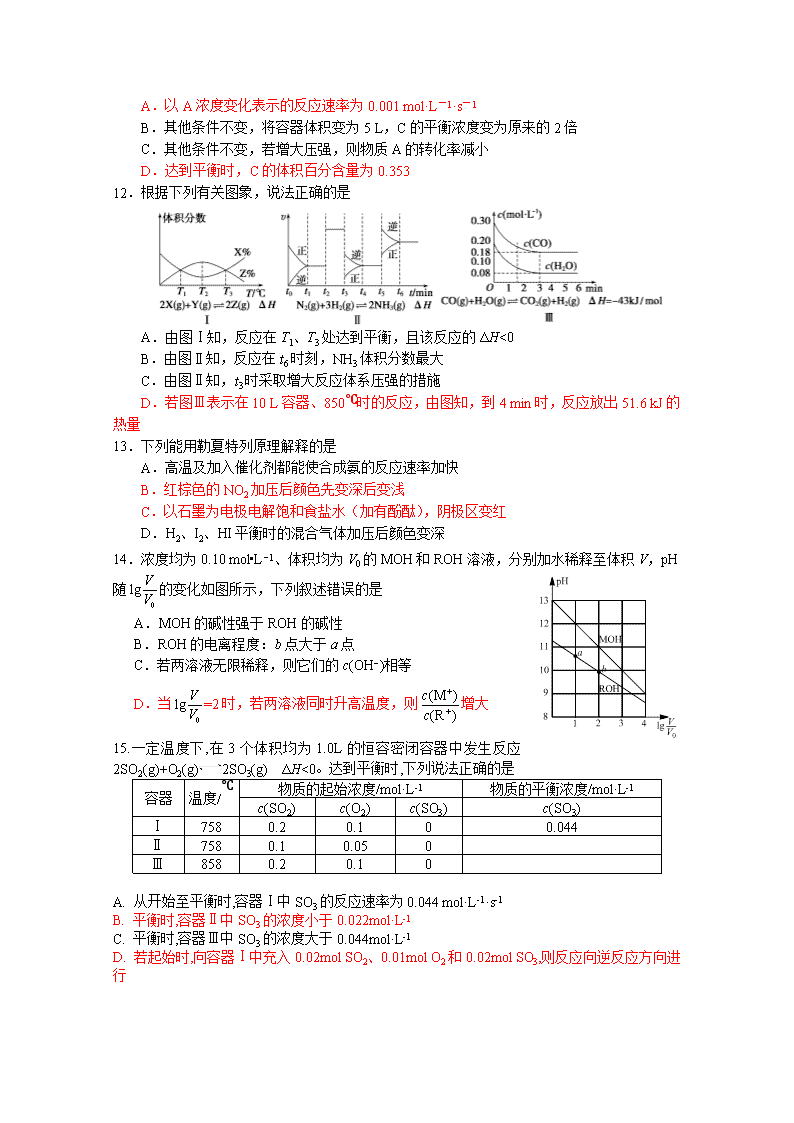
2018-2019 学年江苏省扬州中学高二下学期 4 月月考 化学试题 2019.4 本卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Cr-52 选择题(共 40 分) 单项选择题(本题包括 10 小题,每题 2 分,共 20 分。每小题只有一个选项符合题意) 1.下列有关工业生产叙述正确的是 A.工业上通常使用电解法制备金属钠、镁、铝等 B.合成氨工业中,将 NH3 及时液化分离有利于加快反应速率 C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 D.电解精炼铜时,将粗铜与电源的负极相连 2.一定温度下,满足下列条件的溶液一定呈酸性的是 A.能与金属 Al 反应放出 H2 的溶液 B.加酚酞后显无色的溶液 C.pH=6 的某溶液 D.c(H+)>c(OH—)的任意水溶液 3.用标准盐酸滴定未知浓度的 NaOH 溶液,下列各操作中,不会引起实验误差的是 A.用蒸馏水冼净滴定管后,装入标准盐酸进行滴定 B.用蒸馏水冼净锥形瓶后,再用 NaOH 液润洗,而后装入一定体积的 NaOH 溶液 C.用甲基橙做指示剂,当溶液由黄色变成橙色,立刻读数盐酸体积 D.用碱式滴定管取 10.00 mLNaOH 溶液放入用蒸馏水洗净的锥形瓶中,加入适量蒸馏水 后再进行滴定 4.NA 为阿伏伽德罗常数的值。下列说法正确的是 A.18g D2O 和 18g H2O 中含有的质子数均为 10NA B.2 L 0.5mol•L−1 亚硫酸溶液中含有的 H+离子数为 2NA C.过氧化钠与水反应时,生成 0.1mol 氧气转移的电子数为 0.2NA D.密闭容器中,催化剂作用下 2mol SO2 与 1mol O2 充分反应,产物的分子数为 2NA 5.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.能使甲基橙试液显红色的溶液:Na+、NH4+、Fe3+、NO3— B.能使苯酚变紫色的溶液:K+、Mg2+、I-、SO42- C.加入铝粉能产生氢气的溶液中:NH4+、K+、HCO3-、Cl- D.水电离产生的 c(OH-)=1×10-11mol/L 的溶液:Cu 2+、SO42-、NO3-、Cl- 6.下列事实能说明 NH3·H2O 一定是弱电解质的是 ①常温下,NH3·H2O 溶液能使酚酞变红; ②用 NH3·H2O 溶液做导电性实验,灯泡很暗; ③常温下,0.1mol / L 的氨水 pH 约为 11 ④常温下,体积相同且 pH 相同的 NH3·H2O 溶液和 NaOH 溶液,与相同浓度的 HCl 溶液 中和时,消耗 HCl 溶液的体积:前者>后者 A.①②③④ B.②③④ C.③④ D.②④ 7.下列离子方程式中,正确的是 A.用惰性电极电解 MgCl2 溶液:2Cl—+H2O 通电 2OH—+Cl2↑+H2↑ B.SO2 通入碘水中,反应的离子方程式为 SO2+I2+2H2O=SO42-+2I-+4H+ C.氯气通入冷水中:Cl2 +H2O Cl- +ClO- +2H+ D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O 8.一种微生物燃料电池如图所示,下列关于该电池的说法正确的是 A. a 电极发生还原反应 B. H+由右室通过质子交换膜进入左室 C. b 电极反应式为 2NO3-+10e-+12H+ N2↑+6H2O D. 电池工作时,电流由 a 电极沿导线流向 b 电极 9.三室式电渗析法处理含 Na2SO4 废水的原理如图所示,采用惰 性电极,ab、cd 均为离子交换膜,在直流电场的作用下,两膜中间的 Na+和 SO42-可通过离子交换膜, 而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 A. 通电后中间隔室的 SO42-向正极迁移,正极区溶液 pH 增大 B. 该法在处理含 Na2SO4 废水时可以得到 NaOH 和 H2SO4 产品 C. 负极区反应为 2H2O-4e- O2↑+4H+,负极区溶液 pH 降低 D. 当电路中通过 1 mol 电子的电量时,会有 0.5 mol O2 生成 10. 下列关于焓变(ΔH)的叙述或判断错误的是 图 1 图 2 A. 2NO(g)+2CO(g) N2(g)+2CO2(g)在常温下能自发进行,则该反应的 ΔH<0 B. 500 ℃、30 MPa 下,0.5 mol N 2 和 1.5 mol H2 充分反应放出 19.3 kJ 热量,则反应 N2(g)+3H2(g) 2NH3(g)的 ΔH=-38.6 kJ·mol-1 C. 据图 1 知:ΔH1=ΔH2+ΔH3 D. 据图 2 知:E 的大小对该反应的 ΔH 无影响 不定项选择题(本题包括 5 小题,每小题 4 分,共 20 分。每小题只有一个或两个选项符合题 意。若正确答案只包括一个选项,多选时,该题为 0 分;若正确答案包括两个选项,只选一 个且正确的得 2 分,选两个且都正确的得满分,但只要选错一个,该小题就为 0 分。) 11.一定条件下,在体积为 10 L 的密闭容器中,1 mol A 和 1 mol B 进行反应:2A(g)+B(g) 2C(g),经 60 s 达到平衡,生成 0.6 mol C。下列说法正确的是 A.以 A 浓度变化表示的反应速率为 0.001 mol·L-1·s-1 B.其他条件不变,将容器体积变为 5 L,C 的平衡浓度变为原来的 2 倍 C.其他条件不变,若增大压强,则物质 A 的转化率减小 D.达到平衡时,C 的体积百分含量为 0.353 12.根据下列有关图象,说法正确的是 A.由图Ⅰ知,反应在 T1、T3 处达到平衡,且该反应的 ΔH<0 B.由图Ⅱ知,反应在 t6 时刻,NH3 体积分数最大 C.由图Ⅱ知,t3 时采取增大反应体系压强的措施 D.若图Ⅲ表示在 10 L 容器、850℃时的反应,由图知,到 4 min 时,反应放出 51.6 kJ 的 热量 13.下列能用勒夏特列原理解释的是 A.高温及加入催化剂都能使合成氨的反应速率加快 B.红棕色的 NO2 加压后颜色先变深后变浅 C.以石墨为电极电解饱和食盐水(加有酚酞),阴极区变红 D.H2、I2、HI 平衡时的混合气体加压后颜色变深 14.浓度均为 0.10 mol•L−1、体积均为 V0 的 MOH 和 ROH 溶液,分别加水稀释至体积 V,pH 随 的变化如图所示,下列叙述错误的是 A.MOH 的碱性强于 ROH 的碱性 B.ROH 的电离程度:b 点大于 a 点 C.若两溶液无限稀释,则它们的 c(OH−)相等 D.当 =2 时,若两溶液同时升高温度,则 增大 15.一定温度下,在 3 个体积均为 1.0L 的恒容密闭容器中发生反应 2SO2(g)+O2(g) 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是 物质的起始浓度/mol·L-1 物质的平衡浓度/mol·L-1 容器 温度/℃ c(SO2) c(O2) c(SO3) c(SO3) Ⅰ 758 0.2 0.1 0 0.044 Ⅱ 758 0.1 0.05 0 Ⅲ 858 0.2 0.1 0 A. 从开始至平衡时,容器Ⅰ中 SO3 的反应速率为 0.044 mol·L-1·s-1 B. 平衡时,容器Ⅱ中 SO3 的浓度小于 0.022mol·L-1 C. 平衡时,容器Ⅲ中 SO3 的浓度大于 0.044mol·L-1 D. 若起始时,向容器Ⅰ中充入 0.02mol SO2、0.01mol O2 和 0.02mol SO3,则反应向逆反应方向进 行 0 lg V V 0 lg V V (M ) (R ) + + c c a b ROH MOH lg V V0 pH 8 9 10 11 12 13 1 2 3 4 非 选 择 题 (共 80 分) 16.(8 分)图 a 是 1 mol NO2 和 1 mol CO 反应生成 CO2 和 NO 过程中能量变化示意图,图 b 是反应中的 CO 和 NO 的浓度随时间变化的示意图。根据图意回答下列问题: a b (1)写出 NO2 和 CO 反应的热化学方程式 。 (2)从反应开始到平衡,用 NO2 浓度变化表示平均反应速率 v(NO2)= 。 (3)此温度下该反应的平衡常数 K= ;温度降低,K (填“变大”、“变小” 或“不变”) 17. (12分)已知25 ℃时部分弱电解质的电离平衡常数如下表所示: 化学式 CH3COOH H2CO3 HClO 平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8 回答下列问题: (1)物质的量浓度均为0.1 mol·L-1的四种溶液: a. CH3COOH b. H2CO3 c. NaHCO3 d. HClO pH由小到大的排列顺序是 (填字母)。 (2)常温下,0.1 mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是 (填字母)。 A. c(H+) B. C. c(H+)·c(OH-) D. E. (3)体积均为100 mL、pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如 下图所示,则HX的电离平衡常数 (填“大于”、“小于”或“等于”)CH3COOH的电离平衡 常数,理由是 。 在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况的 体积大小关系为:CH3COOH (填“大于”、“小于”或“等于”)HX 3 ( ) ( ) c H c CH COOH + -( ) ( ) c OH c H + - 3 3 ( ) ( ) ( ) c H c CH COO c CH COOH + ⋅ CO NO C /( mol/L) 2.00 1.50 1.00 0.50 t1 t/ min0 18.(16 分)NaClO2 是一种重要的杀菌消毒剂,也常用来漂白织物等。其一种生产工艺如下: (1) 写出“反应”步骤中生成 ClO2 的化学方程式: 。 (2) “电解”中阴极反应的主要产物是 。 (3) “电解”所用食盐水由粗盐水精制而成。精制时,为除去 Mg2+和 Ca2+,要加入的试剂分别为 溶液、 溶液。(填化学式) (4) “ 尾 气 吸 收 ” 是 吸 收 “ 电 解 ” 过 程 排 出 的 少 量 ClO2 。 写 出 “ 尾 气 吸 收 ” 的 离 子 方 程 式: 。此吸收反应中,氧化剂与还原剂的物质的量之比 为 。 (5) “有效氯含量”可用来衡量含氯消毒剂的消毒能力。其定义是:每克含氯消毒剂的氧化能力相 当于多少克 Cl2 的氧化能力。NaClO2 的有效氯含量为 g(计算结果保留两位小数)。 19.(16 分)在 2 L 的密闭容器内,500℃时反应 2SO2(g)+O2(g) 2SO3(g)ΔH<0 体系中, n(SO2)随时间的变化如表: 时间(s) 0 1 2 3 4 5 n(SO2)(mol) 0.020 0.010 0.008 0.007 0.007 0.007 (1) 写出该反应的平衡常数表达式:K=______________________。 (2) 下图表示 SO3 的变化的曲线是__________。 用 O2 表示从 0~2 s 内该反应的平均速率 v=______________。 (3)能说明该反应已达到平衡状态的是________。 a.v(SO3)=2v(O2) b.容器内压强保持不变 c.v 逆(SO2)=2v 正(O2) d.容器内密度保持不变 (4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。 a.及时分离出 SO3 气体 b.适当升高温度 c.增大 O2 的浓度 d.选择高效催化剂 (5)若在容积均为 2 L 的密闭容器内,500℃时按不同方式投入反应物,发生反应 2SO2(g)+O2(g) 2SO3(g) ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关 数据如下: 实验 甲 乙 丙 初始投料 2molSO2、 1molO2 2molSO3 4molSO2、 2molO2 平衡时 n(SO3) 0.5mol n2 n3 反应的能量变化 放出 Q1kJ 吸收 Q2kJ 放出 Q3kJ 体系的压强 p1 p2 p3 反应物的转化率 α1 α2 α3 三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。 A.α1+α2=1 B. Q1+Q2=Q C. α3<α1 D. p3<2p1=2p2 E. n2查看更多