- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年黑龙江齐齐哈尔市第八中学高一6月月考化学试题
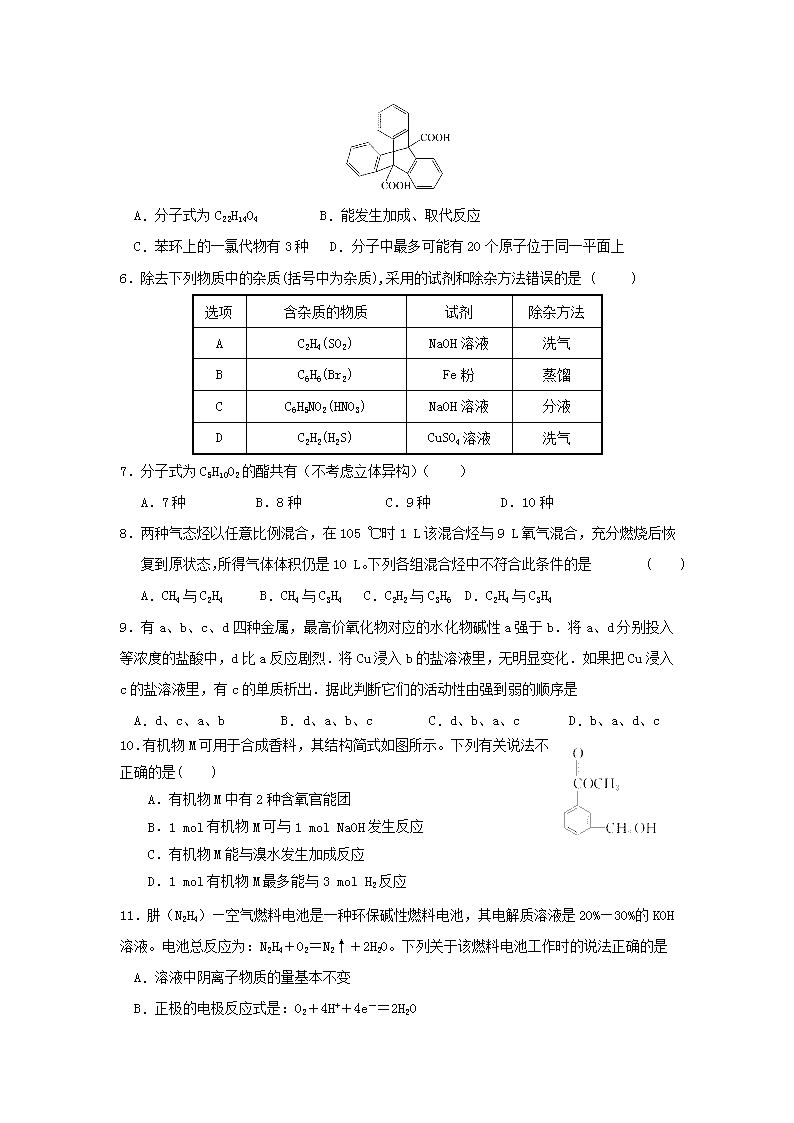
2018-2019学年黑龙江齐齐哈尔市第八中学高一6月月考化学试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 第Ⅰ卷(选择题 共48分) 一、选择题(本题包括16小题,每小题3分,共48分;每小题只有一个选项符合题意) 1.下列反应属于吸热反应的是 ( ) A.酸碱中和反应 B.葡萄糖在人体内氧化分解 C.Ba(OH)2·8H2O与NH4Cl反应 D.锌粒与稀H2SO4反应制取H2 2.下列各组物质中互为同素异形体的是 A.H2O与D2O B.12C和14C C.乙醇与二甲醚(CH3-O-CH3) D.氧气与臭氧 3.在通常条件下,下列各组物质的性质排列正确的是( ) A.熔点:CO2>KCl>SiO2 B. 沸点:乙烷>正丁烷>异丁烷 C.热稳定性:HF>NH3>H2O D.酸性:H2SO4>H2CO3>H2SiO3 4.下列关于化学反应速率的说法正确的是 ( ) A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的 量的增加 B.化学反应速率为0.8 mol /(L·s)是指1s 时某物质的浓度为0.8mol/L C.根据化学反应速率的大小可以知道化学反应进行的快慢 D.决定反应速率的主要因素是反应物的浓度 5.三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是 ( ) A.分子式为C22H14O4 B.能发生加成、取代反应 C.苯环上的一氯代物有3种 D.分子中最多可能有20个原子位于同一平面上 6.除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是 ( ) 选项 含杂质的物质 试剂 除杂方法 A C2H4(SO2) NaOH溶液 洗气 B C6H6(Br2) Fe粉 蒸馏 C C6H5NO2(HNO3) NaOH溶液 分液 D C2H2(H2S) CuSO4溶液 洗气 7.分子式为C5H10O2的酯共有(不考虑立体异构)( ) A.7种 B.8种 C.9种 D.10种 8.两种气态烃以任意比例混合,在105 ℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( ) A.CH4与C2H4 B.CH4与C3H4 C.C2H2与C3H6 D.C2H4与C3H4 9.有a、b、c、d四种金属,最高价氧化物对应的水化物碱性a强于b.将a、d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是 A.d、c、a、b B.d、a、b、c C.d、b、a、c D.b、a、d、c 10.有机物M可用于合成香料,其结构简式如图所示。下列有关说法不正确的是( ) A.有机物M中有2种含氧官能团 B.1 mol有机物M可与1 mol NaOH发生反应 C.有机物M能与溴水发生加成反应 D.1 mol有机物M最多能与3 mol H2反应 11.肼(N2H4)—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是 A.溶液中阴离子物质的量基本不变 B.正极的电极反应式是:O2+4H++4e-=2H2O C.正极的电极反应式是:N2H4+4OH――4e-=H2O+N2↑ D.溶液中阴离子向正极移动 12.一定温度下在一定体积的密闭容器中,下列叙述不能作为可逆反应A(g)+3B(g) 2C(g)达到平衡状态标志的是 ( ) ①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时生成3a mol B ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的总物质的量不再变化 ⑦单位时间消耗a mol A,同时生成3a mol B ⑧A、B、C的分子数之比为1∶3∶2 A.②⑧ B.④⑦ C.①③ D.⑤⑥ 13.下列关于有机物的说法正确的是( ) ①C5H12有2种同分异构体 ②甲烷和氯气光照条件下可制得纯净的一氯甲烷 ③乙烯、聚氯乙烯均能使溴的CCl4溶液褪色 ④乙醇、乙烷、乙酸都能和金属钠反应 ⑤乙醇、乙酸、乙酸乙酯都能发生取代反应 ⑥除去甲烷中含有的乙烯气体,可将混合气体通入装有酸性高锰酸钾溶液的洗气瓶中,再干燥 ⑦乙酸乙酯可水解生成乙醇 ⑧原电池中的负极反应一定是电极材料失电子。 ⑨在铜-锌-稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌。 ⑩任何放热反应在常温条件下一定能发生反应 A.①③⑤⑦⑩ B.②④⑥⑧⑨ C. ⑤⑦ D.②③④⑧ 14.某羧酸酯的分子式为C18H26O5,1 mol该酯完全水解可得到1 mol羧酸和2 mol乙醇,该羧酸的分子式为( ) A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5 15.下列叙述中,错误的是 A.在平衡体系 PCl5(g) PCl3(g) + Cl2(g) 中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中 B.CH3COOH与H18O—CH2CH3发生酯化反应是可逆反应,达到平衡后18O仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里 C.CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构 D.在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃 16.关于有机物a()、b()、c()的说法正确的是( ) A.a、b、c的分子式均为C8H8 B.a、b、c均能与溴水发生反应 C.a、b、c中只有a的所有原子会处于同一平面 D.a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构) 第Ⅱ卷(非选择题 共52分) 二、非选择题(本题包括4小题,共52分) 17.(9分)写出下列反应的化学反应方程式(注明反应条件)并指出反应类型 (1)乙烯在一定条件下与水反应 , (2)苯与浓硝酸反应 , (3)乙酸与丙醇反应 , 18. 19分)某实验小组用如下图所示装置进行乙醇催化氧化实验: (1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式: ,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是 反应。 (2)甲和乙两个水浴作用不相同。甲的作用是 ;乙的作用是 。 (3) .反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 。集气瓶中收集到的气体的主要成分是 。 (4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可先在混合液中加入 (填字母)。 a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳 然后,再通过 (填实验操作名称)即可除去。 19.(12分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答: (1)这四种元素分别是:A________,B________,C________,D________。 (2)这四种元素中在常温常压下的液态或气态简单氢化物的稳定性由大而小的顺序是________。 (3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。 (4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 ________________________________________________________________。 20.(12分)乙酸正丁酯是一种优良的有机溶剂,广泛用于硝化纤维清漆中,在人造革、织物及塑料加工过程中用作溶剂,也用于香料工业。某化学兴趣小组在实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据及实验装置如下所示: 化合物 相对分子质量 密度(g/cm3) 沸点(℃) 溶解度(g/100 g水) 冰醋酸 60 1.045 117.9 互溶 正丁醇 74 0.80 118.0 9 乙酸正丁酯 116 0. 882 126.1 0.7 分水器的操作方法:先将分水器装满水(水位与支管口相平),再打开活塞,准确放出一定体积的水。在制备过程中,随着加热回流,蒸发后冷凝下来的有机液体和水在分水器中滞留分层,水并到下层(反应前加入的)水中;有机层从上面溢出,流回反应容器。当水层增至支管口时,停止反应。 乙酸正丁酯合成和提纯步骤为: 第—步:取18.5 mL正丁醇和15.4 mL冰醋酸混合加热发生酯化反应,反应装置如图Ⅰ所示(加热仪器已省略); 第二步:依次用水、饱和Na2CO3溶液、水对烧瓶中的产品洗涤并干燥; 第三步:用装置Ⅱ蒸馏提纯。 请回答有关问题: (1)第一步装置中除了加正丁醇和冰醋酸外,还需加入 、 。 (2)实验中使用分水器的优点有 、 。根据题中给出的相关数据计算,理论上,应该从分水器中放出来的水的体积约为 。 (3)第二步用饱和Na2CO3溶液洗涤的目的是 。 (4)第三步蒸馏产品时,应收集温度在 左右的馏分。若实验中得到乙酸正丁酯12.76 g,则乙酸正丁酯的产率为 。 答案 CDDCC BCCBC AACAD C 21.答案 (1) CH2===CH2+H2OCH3CH2OH(2分) 加成反应(1分) (2) (2分) 取代(或硝化)反应 (1分) (3) CH3COOH+CH3CH2CH2OHCH3COOCH2CH2CH3+H2O(2分) 酯化(或取代)反应(1分) 22.答案 (1) 2Cu+O2CuO、(2分) CH3CH2OH+CuOCH3CHO+H2O+Cu(2分)。放热(1分) (2) 加热(2分) ; 冷却 (2分)。 (3) 乙醛、乙醇、水 (2分)。 氮气。(2分) (4) 乙酸(2分)。 c(2分) 。 蒸馏(2分) 。 23.答案 (1)C O Si Na (各1分) (2)H2O>CH4>SiH4(2分) (各2分) (4)2CO2+2Na2O2===2Na2CO3+O2(2分) 24.答案(12分,除注明外,每空2分) (1) 浓硫酸(1分)、沸石(碎瓷片)(1分)。 (2) 及时分离出水,有利于酯化反应朝正反应方向移动、根据收集到的水的体积,可以粗略判断是否可以终止反应。3.6mL。 (3) 除去产品中含有的乙酸(硫酸)等杂质。 (4) 126.1℃。55%。查看更多