- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届广东省佛山一中高二上学期第二次段考试题(12月)(2017
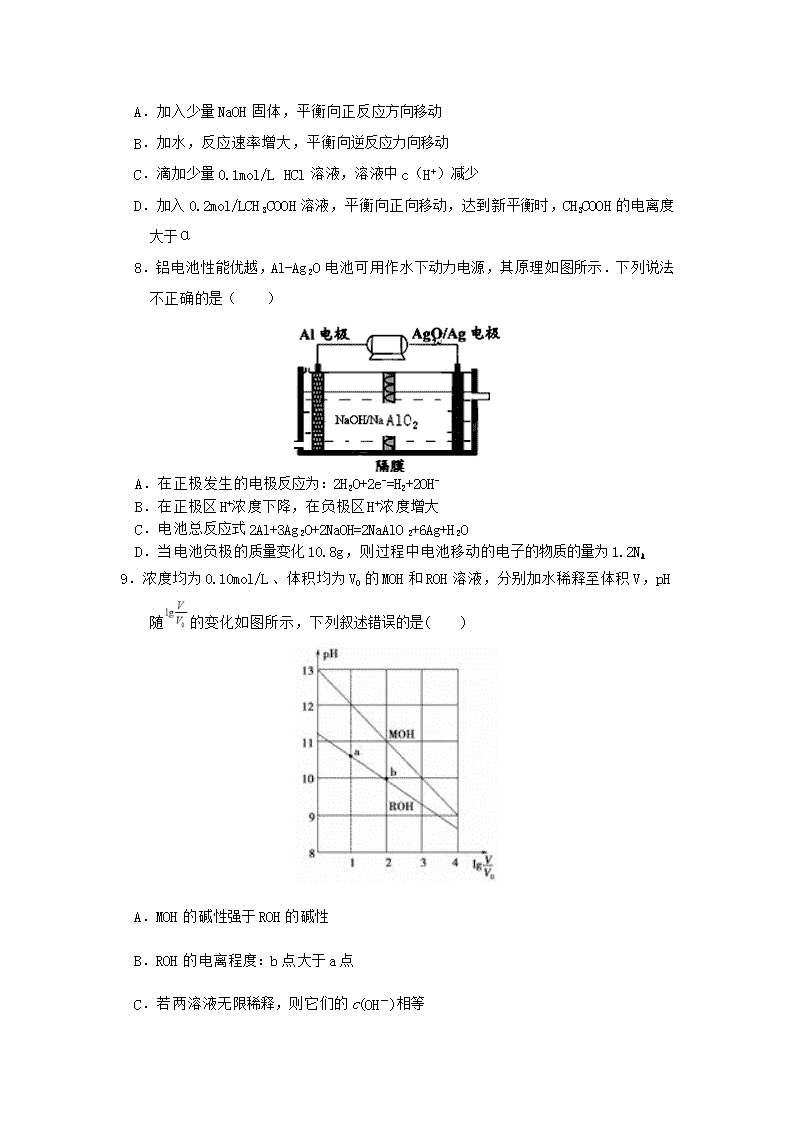
佛山一中2017 ——2018学年上学期第二次段考 高二级理科化学试题 命题人:苏华虹 审题人:郑章福、彭余凤 时间:90分钟,可能需要用到的相对原子质量:Al:27 Zn:65 Li: 7 第一部分 选择题 (共45分) 一、单选题(本题包括15小题,每小题3分,共45分。每小题只有1个选项符合题意。) 1.物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( ) A.HX,HZ,HY B.HX,HY,HZ C.HZ,HY,HX D.HY,HZ,HX 2.下列方程式正确的是( ) A.HCO3-在水溶液中的电离方程式:HCO3-+H2OH3O++CO32- B.H2SO3的电离方程式H2SO32H++SO32- C.CO32-的水解方程式:CO32-+2H2OH2CO3+2OH- D.CaCO3沉淀溶解方程式:CaCO3=Ca2++CO32- 3.室温时,下列混合溶液的pH一定大于7的是( ) A.相同物质的量浓度的草酸(H2C2O4)溶液和氢氧化钠溶液等体积混合 B.相同物质的量浓度的盐酸和氨水等体积混合 C.pH=3的硫酸溶液和pH=11的氨水等体积混合 D.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 4.下列说法正确的是( ) A. Ag2CrO4的Ksp比AgCl的越小,说明Ag2CrO4比AgCl难溶 B. 在碳酸钠溶液中,碳酸钙的溶解度变小 C.往碳酸钠和硫酸钠的混合溶液中滴入氯化钡溶液,一定先产生硫酸钡沉淀(已知Ksp(BaCO3)=2.5810-9;Ksp(BaSO4)=1.0710-10;) D.温度升高,难溶电解质的溶解平衡均向溶解方向移动 5.下列过程或现象不能用水解知识解释的是( ) A.纯碱溶液去油污 B.氯化铁溶液加入烧碱产生红褐色沉淀 C.氯化锌溶液溶解铁锈 D.明矾净水 6.下列各组离子在指定溶液中能大量共存的是( ) ①澄清透明溶液:K+、Na+、MnO4-、SO42- ②常温下,pH=11的溶液中:CO32-、Na+、AlO2-、NO3- ③加入Al能放出H2的溶液中:Cl-、HCO3—、SO42-、NH4+ ④由水电离出的c(OH-)=10-13mol·L-1的溶液中:NH4+、Ba2+、CH3COO-、Cl- ⑤有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3- ⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl- A.①② B.③⑥ C.②③ D.③⑤ 7.在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+,达到平衡时,CH3COOH的电离度为α,对于该平衡,下列叙述正确的是( ) A.加入少量NaOH固体,平衡向正反应方向移动 B.加水,反应速率增大,平衡向逆反应力向移动 C.滴加少量0.1mol/L HCl溶液,溶液中c(H+)减少 D.加入0.2mol/LCH3COOH溶液,平衡向正向移动,达到新平衡时,CH3COOH的电离度大于α 8.铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( ) A.在正极发生的电极反应为:2H2O+2e-=H2+2OH- B.在正极区H+浓度下降,在负极区H+浓度增大 C.电池总反应式2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O D.当电池负极的质量变化10.8g,则过程中电池移动的电子的物质的量为1.2NA 9.浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随的变化如图所示,下列叙述错误的是( ) A.MOH的碱性强于ROH的碱性 B.ROH的电离程度:b点大于a点 C.若两溶液无限稀释,则它们的c(OH-)相等 D.当lg=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大 10. 下列说法中不正确的是( ) ①将Cl2通入水中溶液能导电,但是Cl2是非电解质 ②氨溶于水得到的溶液氨水能导电,所以氨水是电解质 ③相同浓度的CH3COOH溶液的导电性比HCl溶液的弱,说明HCN是弱电解质 ④往FeSO4溶液中通入H2S气体,有FeS沉淀生成 ⑤某溶液中水电离出的c(H+)=110-4mol/L,该溶液只可能是强酸弱碱盐 A.①④ B.②⑤ C.①②④⑤ D.①②③④⑤ 11.用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,下列说法不正确的是( ) A.用标准氢氧化钠溶液润洗碱式滴定管后再盛入标准碱溶液 B.用待测酸溶液润洗锥形瓶后再盛入待测酸溶液 C.用酚酞作指示剂,滴定终点时溶液颜色由无色变浅红色 D.达到滴定终点若仰视读数,则会使测定结果偏大 12.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( ) A.Cl-、Br-、CrO42— B.CrO42— 、Br-、Cl- C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl- 13.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是(提示BaSO4(s)⇌Ba2+(aq)+SO42-(aq)的平衡常数Ksp=[Ba2+]•[SO42-],称为溶度积常数)( ) A.加入Na2SO4可使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp 14.某化学反应 3A(g)2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0。反应物A 的浓度c随时间t的变化情况如下表,下列说法正确的是( ) 实验 序号 0 10 20 30 40 50 1 500 2.0 1.6 1.3 1.0 0.8 0.8 2 500 c2 1.2 0.8 0.8 0.8 0.8 3 500 c3 1.7 1.3 1.0 1.0 1.0 4 600 2.0 1.1 0.9 0.9 0.9 0.9 A.在实验1中,反应在10 min~20 min 内平均速率为0.3 mol/(L·min) B.在实验2中,c2为2.0 mol/L,并且在此实验使用了催化剂 C.在实验3中,c3=2.0 mol/L D.对比实验4和实验1,可知正反应是吸热反应 15. 下列有关电解质溶液中粒子浓度关系正确的是 A.pH相同的①NH3·H20、②NaHCO3、③Na2CO3 三种溶液的浓度大小:①>②>③ B.含等物质的量的Na2HPO4和NaH2PO4的溶液: 3c(Na+)=2[c(HPO42-)+c(PO43-)+c(H2PO4-)] C.pH=3的醋酸溶液与PH=11的氢氧化钠溶液混合至中性,则溶液中 c(Na+)=c(CH3COO -)+c(CH3COOH) D.0.1mol/L NaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中 c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) 第二部分 非选择题 (4小题,共55分) 16.(14分) (1)泡沫灭火器所使用的试剂是Al2(SO)3和NaHCO3,用离子方程式解释泡沫灭火器的原理 (2)人体中的血红蛋白(简写为Hb)可以携带氧气变为氧合血红蛋白(简写为HbO2)。CO可与HbO2反应生成HbCO,并且HbCO比HbO2要稳定得多,其化学平衡方程式可写为:HbO2+COHbCO+O2。 HbCO的形成使得血红蛋白不再携带氧气而造成人员中毒。一旦发生CO中毒,首要的事是让患者____________________________________________ (3)298K时,在12.5mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,回答 下列问题: ①室温下,0.10mol•L-1氨水pH 11(填“>”、“<”或“=”) ②a 12.5mL(填“>”、“<”或“=”) ③该曲线D点时,溶液中各粒子浓度的大小关系: (4)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+=2Fe2++Cu2+”设制一个双电解质溶液的原电池(正极材料用碳棒)则该电池的负极材料是 ,负极区的电解质溶液是 ,写出正极上发生反应的电极反应式 (5)航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,写出该电池负极上的电极反应为_________________ 17.(12分)高炉炼铁是冶炼铁的主要方法,发生的主要反应为: Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=a kJ·mol-1。 (1)已知: ① Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)ΔH1=+489.0 kJ·mol-1; ② C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。 则a=_______ (2)冶炼铁反应的平衡常数表达式K=________ (3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲、乙、丙三个容器中,分别按下表所示加入物质,反应经过一段时间后达到平衡。 Fe2O3 CO Fe CO2 甲/mol 1.0 1.0 1.0 1.0 乙/mol 1.0 2.0 1.0 1.5 丙/mol 2.0 2.0 2.0 2.0 ①甲容器中CO的平衡转化率为________; 乙容器中CO的平衡转化率 甲的平衡转化率(填“>”、“<”、“=”),丙容器中CO的平衡转化率 甲的平衡转化率 ②下列说法正确的是________(填字母)。 a.若容器内气体密度恒定时,标志反应达到平衡状态 b.增加Fe2O3的量,可以提高CO的转化率 c.若容器内气体的平均相对分子质量恒定时,标志反应达到平衡状态 锌粉和KOH MnO2和C 铁皮外壳 碱性锌锰电池构造 + - 铜钉 18.(13分) 碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为: Zn + 2H2O + 2MnO2Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下: 回答下列问题: (1)MnOOH 中,Mn 元素的化合价为________。 (2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH 、MnO2被还原成MnO ),主要原因是“粉料”中含有________。 (3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,写出该反应的离子方程式为 再调节pH使Fe3+完全沉淀。已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算,调节pH的合理范围是________至6。该步骤中,调节pH可加入的物质是 。 化合物 Mn(OH)2 Zn(OH)2 Fe(OH)3 KSP近似值 10-13 10-17 10-38 (离子浓度小于1×10-5mol·L-1即为沉淀完全) (4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。 19.(16分) I.已知部分弱酸的电离平衡常数如表,回答下列问题: 弱酸 HCOOH H2CO3 H2SO3 H3C6H5O7 (柠檬酸) 电离平衡常数(25℃) K=1.810-4 K1=4.410-7 K2=4.710-11 K1=1.210-2 K2=6.610-8 K1=7.410-4 K2=1.7310-5 K3=410-7 (1)常温下,碳酸氢钠溶液的水解平衡常数为 (答案可写分数) (2)写出足量HCOONa溶液与H2SO3反应的离子方程式________。 (3)常温下,柠檬酸一氢钠溶液呈 (“酸性”、“碱性”或“中性”) II.已知25℃时,浓度均为0.1 mol·L-1 的①H2SO4 、②NaHSO4、③CH3COOH、 ④HCl溶液中,某些微粒的电离程度如下表(已知H2SO4第一步电离是完全的): ①H2SO4 溶液中的HSO4- ②NaHSO4溶液中的HSO4- ③HCOOH溶液 ④HCl 10% 29% 4.24% 100% (1)上述四种溶液中c(H+)由大到小的顺序是________(填序号)。 (2)上述H2SO4溶液中HSO4-电离程度小于NaHSO4溶液中HSO4-的电离程度的原因是________。 (3)Na2SO4溶液呈________(填“弱酸性”、“中性”或“弱碱性”),原因是________(用离子方程式表示)。 (4)0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系正确的是________(填标号)。 A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1 mol·L-1 B.2 c(SO42-)+2 c(HSO4-)=c(Na+) C.c(Na+)+ c(H+)=c(OH-)+ c(HSO4-) D.c(Na+)> c(SO42-)> c(OH-)> c(HSO4-) 佛山一中2017-2018学年高二(上)第二次段考理科化学答案 一、 单选题(每题3分,共45分) 1 2 3 4 5 6 7 8 9 10 B A C B B C A A D C 11 12 13 14 15 B C C B D 二、 非选择题(4题,共55分) 16. (共16分) (1)Al3++HCO3—=Al(OH)3 +CO2 (2分) (2)呼吸新鲜空气(2分) (3) ①>(1分); ② <(1分); ③c(NH4+)> c(Cl-) > c(NH3·H2O) > c(OH-)> c(H+)(2分) (4)Cu;(2分)CuSO4;(2分)Fe3++e-=Fe2+(2分) (5)CH4+10OH--8e-===CO+7H2O(2分) 17. (各2分,共12分) (1)-28.5 (2)c3(CO2)/C3(CO) (3)① 60%;<;= ② ac 18. (共11分) (1)+3(1分) (2)C(1分) (3)H2O2、KMnO4(1分,其余答案不给分) H2O2+2Fe2++2H+=2Fe3++2H2O(2分);3(2分); ZnO、Zn(OH)2、ZnCO3、MnO、Mn(OH)2、MnCO3(2分) (4)2MnOOH+6HCl=2MnCl2+Cl2 +4H2O(2分) 19. (各2分,共16分) I.(1)2.310-8或1/4.410-7 (2)HCOO-+H2SO3=HCOOH+HSO3- (3)酸性 II.(1)①>④>②>③ (2)H2SO4第一步电离出的H+抑制了会抑制第二步电离HSO4—H++SO42- (3)弱碱性 H2O+ SO42-H++HSO4—; (4)BD查看更多