- 2021-07-09 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学反应原理学案
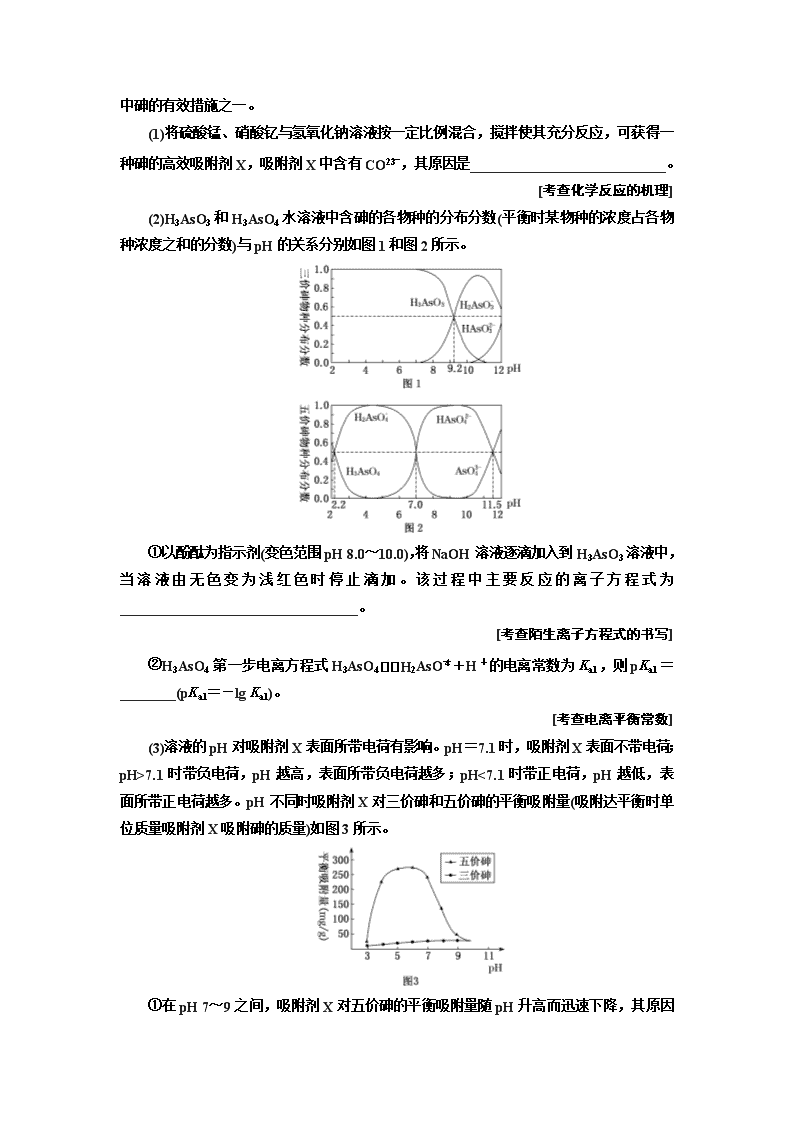
第五题 化学反应原理题型研究 [试题特点] ————————————————————————————————————— 这一类试题将有关化学反应原理融合到化工生产流程中。试题设问较多,考査的内容较多,导致思维转换角度较大;试题的难度较大,对思维能力的要求较高。这类试题具有较大的综合性,能很好地考査考生应用化学知识解决实际问题的能力。主要是由“热化学方程式的书写或反应热计算”“电极反应或电池总反应”“陌生离子方程式或化学方程式的书写”“影响化学反应速率和化学平衡的因素”“根据化学原理回答相关问题”等组成。 [做真题—明考查特点] 1.(2018·江苏高考)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。 (1)用水吸收NOx的相关热化学方程式如下: 2NO2(g)+H2O(l)===HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1 3HNO2(aq)===HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol-1 反应3NO2(g)+H2O(l)===2HNO3(aq)+NO(g)的ΔH=________ kJ·mol-1。 [考查盖斯定律计算反应热] (2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________________。 [考查电解池电极反应式的书写] (3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:_____________________________________________。 [考查陌生化学方程式的书写] (4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。 ①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为________ mol。 [考查陌生氧化还原反应转移电子数的计算] ②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。 反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________。 [考查化学反应速率的影响因素] 解析:(1)将题给三个热化学方程式依次编号为①、②和③,根据盖斯定律可知,③=(①×3+②)/2,则ΔH=(-116.1 kJ·mol-1×3+75.9 kJ·mol-1)/2=-136.2 kJ·mol-1。(2)由题给信息可知,反应物为HNO2(弱酸),生成物为HNO3,因此阳极反应式为HNO2-2e-+H2O===3H++NO。(3)由题给信息可知,反应物为HNO2、(NH2)2CO,生成物为CO2和N2,根据氧化还原反应方程式的配平方法可写出该反应的化学方程式为2HNO2+(NH2)2CO===2N2↑+CO2↑+3H2O。(4)①NH3中N的化合价为-3,NO2中N的化合价为+4,N2中N的化合价为0,每生成1 mol N2,有的N由-3价变为0价,被氧化的N的物质的量为 mol,因此每生成1 mol N2转移的电子数为 mol。②温度升高,反应速率增大,同时催化剂的活性增大也会提高反应速率。一段时间后催化剂活性增大幅度变小,主要是温度升高使反应速率增大。当温度超过一定值时,催化剂的活性下降,同时氨气与氧气能够反应生成NO而使反应速率减小。 答案:(1)-136.2 (2)HNO2-2e-+H2O===3H++NO (3)2HNO2+(NH2)2CO===2N2↑+CO2↑+3H2O (4)① ②迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大 催化剂活性下降;NH3与O2反应生成了NO 2.(2017·江苏高考)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。 (1) 将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有CO,其原因是____________________________。 [考查化学反应的机理] (2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。 ①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________________。 [考查陌生离子方程式的书写] ②H3AsO4第一步电离方程式H3AsO4H2AsO+H+的电离常数为Ka1,则pKa1=________(pKa1=-lg Ka1)。 [考查电离平衡常数] (3)溶液的pH对吸附剂X表面所带电荷有影响。pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图3所示。 ①在pH 7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是____________________________________________________________。 ②在pH 4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为 __________________________________________________________。 提高吸附剂X对三价砷去除效果可采取的措施是______________________________________________________________。 [考查化学反应速率的影响因素] 解析:(1)吸附剂X中含有NaOH溶液,能吸收空气中的CO2生成CO。(2)①图1中pH为8~10时,三价砷物种主要以H3AsO3和H2AsO的形式存在,故滴加NaOH溶液的过程中主要反应的离子方程式为OH-+H3AsO3===H2AsO+H2O。②Ka1=,K仅与温度有关,为方便计算,在图2中取pH=2.2时计算,此时c(H2AsO)=c(H3AsO4),则Ka1=c(H+)=10-2.2,pKa1=2.2。(3)①从图2知,pH由7升至9时,H2AsO转变为HAsO,由题中信息知,pH>7.1时,pH越高,吸附剂X所带负电荷越多,则吸附剂X与HAsO静电斥力增强。②在pH为4~7时,吸附剂X表面带正电荷,从图2知,pH在4~7之间时,吸附剂X吸附H2AsO和HAsO;从图1知,pH在4~7之间时,三价砷主要以分子形式存在,吸附剂X不会吸附分子。加入氧化剂,可以将三价砷转化为五价砷,而被吸附剂X吸附。 答案:(1)碱性溶液吸收了空气中的CO2 (2)①OH-+H3AsO3===H2AsO+H2O ②2.2 (3)①在pH 7~9之间,随pH升高H2AsO转变为HAsO,吸附剂X表面所带负电荷增多,静电斥力增加 ②在pH 4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO和HAsO阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷 3.(2016·江苏高考)铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。 (1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O的酸性废水通过铁炭混合物,在微电池正极上Cr2O转化为Cr3+,其电极反应式为__________________________。 [考查原电池电极反应式的书写] (2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如下图所示。 ①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________________________。 ②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_______________________________________。 [考查化学反应速率的影响因素] (3)纳米铁粉可用于处理地下水中的污染物。 ①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH),其离子方程式为________________________。 [考查陌生离子方程式的书写] ②纳米铁粉与水中NO反应的离子方程式为 4Fe+NO+10H+===4Fe2++NH+3H2O 研究发现,若pH偏低将会导致NO的去除率下降,其原因是________________________________________________________________________。 ③相同条件下,纳米铁粉去除不同水样中NO的速率有较大差异(见下图),产生该差异的可能原因是______________________________________________________。 [考查影响化学反应速率的因素] 解析:(1)由题意知,正极上Cr2O得电子生成Cr3+,其电极反应式为Cr2O+6e-+14H+===2Cr3++7H2O。(2)①活性炭具有较大的表面积,吸附性很强,能吸附废水中少量的Cu2+和Pb2+。②铁的质量分数增加,形成铁炭微电池的数量减少,从而降低了反应效果,导致Cu2+和Pb2+的去除率降低。(3)①因BH中B元素的化合价为+3,则BH中H 元素的化合价为-1。根据题中信息和电子守恒规律可写出该反应的离子方程式:2Fe2++BH+4OH-===2Fe+2H2↑+B(OH)。②pH偏低,即溶液的酸性增强,则易发生副反应:Fe+2H+===Fe2++H2↑,导致NO的去除率降低。③水样Ⅰ和Ⅱ相比较,水样Ⅱ中含有Cu2+。由图可知,相同条件下水样Ⅱ的NO去除速率明显比水样Ⅰ快,可能是Fe与Cu2+反应:Fe+Cu2+===Fe2++Cu,析出的Cu与Fe在溶液中构成原电池,加快了Fe与NO的反应,也可能是析出的Cu或原废水中的Cu2+催化了Fe与NO的反应。 答案:(1)Cr2O+6e-+14H+===2Cr3++7H2O (2)①活性炭对Cu2+和Pb2+有吸附作用 ②铁的质量分数增加,铁炭混合物中微电池数目减少 (3)①2Fe2++BH+4OH-===2Fe+2H2↑+B(OH) ②纳米铁粉与H+反应生成H2 ③Cu或Cu2+催化纳米铁粉去除NO的反应(或形成的FeCu原电池增大纳米铁粉去除NO的反应速率) [研热点—找解题策略] 年份 试题 知识点 分值 2018 第20题 ①应用盖斯定律计算反应热;②电解池电极反应式的书写;③陌生化学方程式的书写;④陌生氧化还原反应转移电子数的计算;⑤化学反应速率的影响因素 14分 2017 第20题 ①化学反应的机理;②陌生离子方程式的书写;③电离平衡常数;④化学反应速率的影响因素 14分 2016 第20题 ①原电池电极反应式的书写;②化学反应速率的影响因素;③陌生离子方程式的书写 14分 1.热化学方程式的书写和运用盖斯定律求算反应热 (1)计算步骤 (2)计算方法 2.电化学知识的应用 (1)化学电源与电极 原电池中负极发生氧化反应,常出现电极材料溶解、质量减轻等现象;正极发生还原反应,常出现质量不变或增重、有气体产生等现象。电解池中与电源负极连接的阴极材料不反应,与电源正极连接的阳极(除惰性电极外)材料发生氧化反应,可能出现电极溶解、质量减轻等现象。 (2)注意变价金属电极材料 Fe在原电池与电解池反应中发生氧化反应时只能失去2个电子生成Fe2+。 (3)可充电电池 可充电电池的放电反应是原电池反应,充电反应是电解池反应。放电过程中原电池的负极发生氧化反应,充电过程中电解池的阴极发生还原反应。 3.有关化学反应速率问题 (1)计算v(X)=,即v(X)==,计算时一定要注意容器或溶液的体积,不能忽视容器或溶液的体积V,盲目地把Δn当作Δc代入公式进行计算。 (2)外界条件对化学反应速率的影响 4.有关化学平衡问题 (1)化学平衡的标志 ①直接判断依据 ②间接判断依据 a.对于有有色气体存在的反应体系,如2NO2(g)N2O4(g)等,若体系的颜色不再发生改变,则反应已达平衡状态。 b.对于有气体存在且反应前后气体的物质的量发生改变的反应,如N2(g)+3H2(g)2NH3(g),若反应体系的压强不再发生变化或平均相对分子质量不再发生变化,则说明反应已达平衡状态。 c.对于有气体存在且反应前后气体的物质的量不发生改变的反应,如2HI(g)H2(g)+I2(g),反应过程中的任何时刻体系的压强、气体的物质的量、平均相对分子质量都不变,故体系压强、气体的物质的量、平均相对分子质量不变均不能说明反应已达平衡状态。 (2)外界条件对化学平衡移动的影响规律 温度的影响 升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动 浓度的影响 增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动 压强的影响 增大压强会使平衡向气体体积减小的方向移动;减小压强会使平衡向气体体积增大的方向移动 (3)化学平衡常数 ①化学平衡常数只与温度有关,与反应物或生成物的浓度变化无关。 ②反应物或生成物中有固体或纯液体存在时,由于其浓度可看做“1”而不代入化学平衡常数公式。 ③化学平衡常数是指某一具体反应的平衡常数。若方程式中各物质的化学计量数等比例扩大或缩小,尽管是同一反应,平衡常数也会改变。 ④若用任意状态的浓度幂之积的比值(称为浓度商,用Q表示)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。即:对于反应mA(g)+nB(g)pC(g)+qD(g),Q=。 ⑤利用K可判断反应的热效应 若升高温度,K值增大,则正反应为吸热反应; 若升高温度,K值减小,则正反应为放热反应。 ⑥化学平衡常数与转化率的计算 转化率=×100%=×100% 产率=×100% 化学反应原理题在背景材料上呈现新(或陌生)内容,但内在要求或者核心知识考査还是不变的,如运用化学反应原理、化学平衡和水解理论、物质制备和分离的知识等分析实际生产中的各种问题,我们千万不能被新包装所迷惑,注意联系生产实际中的各类反应原理,融会贯通,就能解决所有问题。只要我们采用各个击破的方法,搞清楚各歩知识点对应的化学反应原理,采取先分后合的方法,再根据题目要求,用简洁、准确的化学用语答题即可。 尽管化学反应原理综合题设问较多,考査内容较多,但都是《江苏省考试说明》要求的内容,不会出现偏、怪、难的问题,因此要充满信心,分析时要冷静,不能急于求成。要总结思考的技巧和方法,答题时注意规范细致。该类题的问题设计一般没有递进性,故答题时可跳跃式解答,千万不能放弃。 [练新题—提答题能力] 1.(2019·常州模拟)铜及其化合物在工农业生产及日常生活中应用非常广泛。 (1)由辉铜矿制取铜的反应过程为 2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1 2Cu2O(s)+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1 ①热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH= ________kJ·mol-1。 ②获得的粗铜需电解精炼,精炼时粗铜作________极。 (2)氢化亚铜是一种红色固体,可由下列反应制备: 4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4 ①该反应的还原剂是____________(写化学式)。 ②该反应每转移3 mol电子,生成CuH的物质的量为________。 (3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。 ①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为________________________。 ②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为___________________________,____________________________(任写两个)。 解析:(1)①根据盖斯定律,将两式相加除3,得到Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH= kJ·mol-1=-217.4 kJ·mol-1。②电解精炼铜,粗铜作阳极,纯铜作阴极。(2)①H3PO2中P元素+1价,H3PO4中P元素+5价,化合价升高,被氧化,H3PO2为该反应的还原剂。②该反应中存在关系式:3H3PO2~4CuH~12e-,则每转移3 mol电子,生成CuH的物质的量为1 mol。(3)由图分析可知①当c(Cl-)=9 mol·L-1时,溶液中主要的3 种含铜物种的浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl)。②在c(Cl-)=1 mol·L-1的CuCl2溶液中,含铜物种主要是Cu2+、CuCl+、CuCl2,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl++Ag+===AgCl↓+Cu2+或CuCl2+Ag+===CuCl++AgCl↓或CuCl2+2Ag+===Cu2++2AgCl↓。 答案:(1)①-217.4 ②阳 (2)①H3PO2 ②1 mol (3)①c(CuCl2)>c(CuCl+)>c(CuCl) ②CuCl++Ag+===AgCl↓+Cu2+ CuCl2+Ag+===CuCl++AgCl↓(或CuCl2+2Ag+===Cu2++2AgCl↓) 2.(2019·镇江模拟)以铜为原料可制备应用广泛的氧化亚铜。 (1)向CuCl2溶液中通入SO2可得到CuCl固体,此反应的离子方程式为________________________________________________________________________。 由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为 CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq)。 该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________。 (2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图1所示。 ①阳极的电极反应式为______________________________________________。 ②电解一段时间后,电解液补充一定量的________可恢复到原电解质溶液。 ③溶液中Ⅲ、Ⅳ两步总反应的离子方程式为________________________________。 (3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g)===CH3OH(g) ΔH=a kJ·mol-1。按=2投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。 ①图中压强P1、P2、P3由大到小的关系是______________________________________; ②起始时,c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1。在P3及T1 ℃下反应达到平衡,此时反应的平衡常数为________。 解析:(1) 向CuCl2溶液中通入SO2可得到CuCl固体,铜被还原,则SO2 被氧化,在溶液中生成SO -,根据氧化还原反应的配平原则配平,此反应的离子方程式为2Cu2++SO2+2Cl-+2H2O===2CuCl↓+SO+4H+,CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq),此反应的平衡常数K=c(H+)· c(Cl-)=·=。(2)①由图1分析可知阳极:CuCl--e-+Cl-===CuCl。②阳极及溶液整个过程发生反应:2Cu-2e-+2OH-===Cu2O+H2O,而阴极:2H2O+2e-===H2↑+2OH-,总反应为2Cu+H2OCu2O+H2↑,因此电解一段时间后,电解液补充一定量的H2O就可恢复到原电解质溶液。③溶液中Ⅲ为CuCl+OH-===Cu(OH)Cl-+Cl-。Ⅳ为2Cu(OH)Cl-===Cu2O+2Cl-+H2O,Ⅲ×2+Ⅳ得到两步总反应的离子方程式为2CuCl+2OH-===Cu2O↓+H2O+4Cl-。(3)①相同温度下,压强越大,有利于平衡向正反应方向移动,CO的平衡转化率越大,则P1>P2>P3,②起始时,c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1 ℃下反应, CO(g) + 2H2(g)CH3OH(g) 起始/(mol·L-1) 0.10 0.20 0 转化/(mol·L-1) 0.10×40% 0.08 0.04 平衡/(mol·L-1) 0.06 0.12 0.04 此时反应的平衡常数:K=≈46.3。 答案:(1)2Cu2++SO2+2Cl-+2H2O===2CuCl↓+SO+4H+ Kw× (2)①CuCl--e-+Cl-===CuCl ②H2O ③2CuCl+2OH-===Cu2O↓+H2O+4Cl- (3)①P1>P2>P3 ②46.3 3.(2019·苏州模拟)锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如图所示。 (1)“酸洗”时,一般不选用稀硫酸的原因是____________________________________。 (2)“不溶物”用碳酸钠溶液浸泡的目的是_________________________________(用离子方程式表示)。 (3)为防止洗出液中的Fe3+腐蚀铁质管道,常在洗出液中加入SnCl2溶液,反应中Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为________。 (4) 柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图1所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是__________________________________________(用平衡移动原理解释)。HR2-电离常数为Ka3,请根据图示信息计算出pKa3=________(pKa3=-lg Ka3)。 (5)利用图2所示装置对锅炉水(含Ca2+、Mg2+、HCO)进行预处理,可有效防止锅炉水垢的形成。写出电解过程中,Ca2+形成沉淀的电极反应方程式:___________________________________________________。 解析:(1)“酸洗”时,一般不选用稀硫酸,是因为稀硫酸与碳酸钙反应会生成微溶物硫酸钙,覆盖在反应物表面,阻止反应进一步进行。(2)水垢中CaCO3、Mg(OH)2、Fe2O3均溶于酸,CaSO4不溶,“不溶物”为CaSO4,用碳酸钠溶液浸泡,目的是将CaSO4转化为CaCO3,再用酸溶解可除去,用离子方程式表示为CaSO4+COCaCO3+SO。(3)根据得失电子守恒,Sn2+与Fe3+反应的物质的量之比为1∶2。(4)分析图1,曲线a、b、c、d分别表示H3R、H2R-、HR2-、R3-的含量,随着溶液pH增大,H3R的电离平衡H3RH2R-+ H+向右移动,故H3R的百分含量减小;HR2-的电离表示为HR2-R3- +H+,pH=6时HR2-、R3-各占50%,即c(HR2-)=c(R3-),其电离常数为Ka3==c(H+)=10-6 mol·L-1,因此pKa3=6。(5)电解过程中,Ca2+形成沉淀CaCO3的电极反应方程式为2Ca2++2HCO+2e-===2CaCO3↓+H2↑或2H2O+2e-===H2↑+2OH-、Ca2++OH-+HCO===CaCO3↓+H2O。 答案:(1)稀硫酸与碳酸钙反应会生成微溶物硫酸钙,覆盖在反应物表面,阻止反应进一步进行 (2)CaSO4+COCaCO3+SO (3)1∶2 (4)随溶液pH增大,平衡H3RH2R-+H+向右移动,故H3R的百分含量减小 6 (5)2Ca2++2HCO+2e-===2CaCO3↓+H2↑(或2H2O+2e-===H2↑+2OH-、Ca2++OH-+HCO===CaCO3↓+H2O) 4.(2019·梁丰高中月考)氮氧化物会形成光化学烟雾和酸雨,可采取下列方法对氮氧化物进行处理。 (1)SNCR脱硝技术的原理: 4NO(g)+4NH3(g)+O2(g)===4N2(g)+6H2O(g) ΔH1=-1 627.2 kJ·mol-1 6NO(g)+4NH3(g)===5N2(g)+6H2O(g) ΔH2=-1 807.0 kJ·mol-1 2NO(g)+O2(g)===2NO2(g) ΔH3=-113.0 kJ·mol-1 则6NO2(g)+8NH3(g)===7N2(g)+12H2O(g) ΔH=________ kJ·mol-1 (2)NSR (NOx储存还原)工作原理如图1所示,NOx的储存和还原在不同时段交替进行。 ①NOx储存转化为Ba(NO3)2过程中,参加反应的NO和O2的物质的量之比为 _________。 ②H2还原Ba(NO3)2的过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。第一步反应的化学方程式为____________________________________________。 (3)SCR消除氮氧化物的反应原理:4NO(g)+4NH3(g)+O2(g)===4N2(g)+6H2O(g) ΔH<0,其他条件相同,某密闭容器中分别投入NH3、NO、O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图3所示。在催化剂甲作用下,图中Y点处(对应温度为210 ℃)NO的转化率一定不是该温度下的平衡转化率的原因是 _________________________。工业实际选择催化剂乙的原因是___________________________________。 (4)①用石灰乳吸收氨的氧化物,其原理为 4NO2+2Ca(OH)2===Ca(NO3)2+Ca(NO2)2+2H2O,NO2+NO+Ca(OH)2===Ca(NO2)2+H2O。 为使吸收充分,____________(填“≥”或“≤”)1。 ②目前可采用电解的方法除去废水中的NO,原理如图4所示。写出阴极的电极反应式:________________________________________________________________________。 解析:(1)设三个反应依次为①、②、③,则根据盖斯定律可知(①-③)×3-②即得到反应6NO2(g)+8NH3(g)===7N2(g)+12H2O(g) ΔH=-2 735.6 kJ·mol-1。(2)①反应中氮元素化合价从+2价升高到+5价,失去3个电子,氧气中氧元素化合价从0价降低到-2价,得到2个电子,根据电子得失守恒可知参加反应的NO和O2的物质的量之比为4∶3。② 根据图像可知第一步反应的还原产物是NH3,结合图1可知第一步反应的化学方程式为8H2+Ba(NO3)2BaO+2NH3+5H2O。(3)由于平衡转化率是该温度下的最大转化率,此时Y点NO的转化率明显低于同温度下乙作催化剂时NO的转化率,所以在催化剂甲作用下,图中Y点处(对应温度为210 ℃)NO的转化率一定不是该温度下的平衡转化率。根据图像可知在低温下,使用催化剂乙,NO转化率很高,所以工业实际选择催化剂乙。(4)①由于NO不能与Ca(OH)2反应,而NO2可以,所以为使吸收充分,NO2与NO的体积之比应该≥1。②阴极NO得到电子发生还原反应生成氮气,因此阴极的电极反应式为2NO+4H2O+6e-===N2+8OH-。 答案:(1)-2 735.6 (2)①4∶3 ②8H2+Ba(NO3)2BaO+2NH3+5H2O (3)平衡转化率是该温度下的最大转化率,此时Y点NO的转化率明显低于同温度下乙作催化剂时NO的转化率 在低温下,使用催化剂乙,NO转化率很高 (4)①≥ ②2NO+4H2O+6e- ===N2+8OH- (若答2NO+8H++6e- ===N2+4H2O也正确) 5.(2019·通州高中联考)氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。 (1)一定条件下,水中的氨氮可以转化为氮气而除去。 已知:2NH(aq)+3O2(g)===2NO(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1 2NO(aq)+O2(g)===2NO(aq) ΔH=b kJ·mol-1 5NH(aq)+3NO(aq)===4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1 则4NH(aq)+3O2(g)===2N2(g)+6H2O(l)+4H+(aq) ΔH=________________kJ·mol-1 (2)实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图1所示。增大氯离子浓度可使氨氮去除率________(填“增大”“减小”或“不变”),其主要原因可能是_________________________________________________。 (3)化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4 将NH转化为MgNH4PO4·6H2O沉淀(Ksp=2.5×10-13)去除。25 ℃时,在氨氮初始质量浓度400 mg·L-1,n(Mg)∶n(P)∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图2所示。 ①反应生成MgNH4PO4·6H2O的离子方程式为______________________________。 ②该实验条件下,控制溶液的适宜pH范围为__________;当pH范围在9~11时,溶液中总磷浓度随pH增大而增大的主要原因是(用离子方程式表示)______________________________________________________________________。 解析:(1)设三个反应依次为①②③,根据盖斯定律,反应得到4NH(aq)+3O2(g)===2N2(g)+6H2O(l)+4H+(aq),则ΔH= (3a+3b+2c) kJ·mol-1。(2)由图1可知:增大氯离子浓度,相同时间内剩余氨氮浓度减小,即可使氨氮去除率增大;其主要原因可能是阳极生成的Cl2能够将NH氧化为氮气(或NO)而除去。(3)①加入MgCl2和Na2HPO4将NH转化为MgNH4PO4·6H2O沉淀,反应的离子方程式为Mg2++HPO+NH+6H2O===MgNH4PO4·6H2O↓+H+。②由图2可知:pH在8.5~9.5之间,剩余氨氮浓度和总磷浓度较低,而氨氮去除率却较高,故控制溶液的适宜pH范围为8.5~9.5;当pH范围在9~11时,MgNH4PO4·6H2O沉淀溶解,生成PO,则溶液中总磷浓度随pH增大而增大的主要原因是MgNH4PO4+2OH-===Mg(OH)2+NH+PO 或MgNH4PO4+3OH-===Mg(OH)2+NH3·H2O+PO。 答案:(1)(3a+3b+2c) (2)增大 阳极生成的Cl2能够将NH氧化为氮气(或NO)而除去 (3)①HPO+Mg2++NH+6H2O===MgNH4PO4·6H2O↓+H+ ②8.5~9.5 MgNH4PO4+2OH-===Mg(OH)2+NH+PO(或MgNH4PO4+3OH-===Mg(OH)2+NH3·H2O+PO) 6.采用科学技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。 (1)采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图1所示。 ①反应釜Ⅰ采用“气—液逆流”接触吸收法(如图2),其优点是 ________________________________________________________________________。 ②反应釜Ⅱ中CaSO3转化为CaSO4的化学反应方程式为 ________________________________________________________________________。 (2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图3所示。其中产物Y的化学式是________________________________________________________________________。 (3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧,通过该燃烧技术可收集到高纯度的CO2。 ①与在空气中燃烧相比,利用O2/CO2燃烧技术时,烟气中NOx的排放量明显降低,其主要原因是 __________________________________________。 ②利用太阳能可实现反应:2CO2(g)===2CO(g)+O2(g),该反应能自发进行的原因是______________。 ③700 ℃时,以NiMgOAl2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g)。当反应达平衡时测得CO的体积分数为40%,则CO2的转化率为 ______________。 ④CO2在新型钴基电催化剂作用下,转化为清洁燃料—甲酸。其工作原理如图4所示,写出生成甲酸的电极反应式:______________________________。 解析:(1)①反应釜Ⅰ采用“气—液逆流”接触吸收法,其优点是使气体和石灰乳充分接触,提高气体的吸收效率。②CaSO3转化为CaSO4的化学反应方程式为2NO2+CaSO3+Ca(OH)2===CaSO4+Ca(NO2)2+H2O。(2)分析图3,0.10 mol SO2消耗0.20 mol CO,生成0.05 mol Y和0.20 mol X,则得到反应:2SO2+4CO===Y+4X,根据质量守恒定律,反应前后原子的种类和数目都不变,产物X、Y的化学式分别是CO2、S2。(3)①与在空气中燃烧相比,利用O2/CO2燃烧技术时,烟气中NOx的排放量明显降低,其主要原因是CO2代替了N2,减少了N2与O2反应。②反应2CO2(g)===2CO(g)+O2(g)的ΔH>0,则该反应能自发进行的原因是ΔS>0。③设达到平衡时CO2的转化浓度为x mol·L-1。 CO2(g)+CH4(g)2CO(g)+2H2(g) 初始/(mol·L-1) 1.5 1.5 0 0 转化/(mol·L-1) x x 2x 2x 平衡/(mol·L-1) 1.5-x 1.5-x 2x 2x 当反应达平衡时测得CO的体积分数为40%,即×100%=40%,解得x=1,则CO2的转化率为×100%≈66.7%。④如图4所示,CO2在阴极得到电子生成甲酸。则生成甲酸的电极反应式为CO2+2e-+H2O===HCOOH+O2-。 答案:(1)①使气体和石灰乳充分接触,提高气体的吸收效率 ②2NO2+CaSO3+Ca(OH)2===CaSO4+Ca(NO2)2+H2O (2)S2 (3)①CO2代替了N2,减少了N2与O2反应 ②ΔS>0 ③66.7% ④CO2+2e-+H2O===HCOOH+O2- 7.(2019·盐城中学练兵)废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。 (1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。 ①过硫酸铵与Mn2+反应生成MnO2的离子方程式为____________________________。 ②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示: 实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为______________________________________。 ③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________________________________________________________________。 (2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和____________________。 (3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。 ①吸收初期(图中A点以前)反应的化学方程式为__________________________。 ②C点高于B点的原因是________________________________________________。 解析:(1)①过硫酸铵与Mn2+反应生成MnO2,而本身被还原为SO - ,反应的离子方程式为S2O+2H2O+Mn2+===4H++2SO -+MnO2↓。②根据图1可知:80 ℃时Fe2+、Mn2+氧化程度接近1.0,故实验过程中应将温度控制在80 ℃;Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为吸附胶体粒子形成沉淀。③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是锰的化合物可催化H2O2的分解,使消耗的H2O2增多。(2)根据题图反应可产生A的反应为[(NH4)(HNO2)]+===N2+A+H+,根据原子守恒可推导出A为H2O;反应为[(NH4)(HNO2)]+===N2+2H2O+H+。(3)①吸收初期(图中A点以前)工业上废气中SO2可用Na2CO3溶液吸收,由图中信息可知,NaHCO3 和Na2SO3的量明显增加,则发生反应的化学方程式为2Na2CO3+SO2+H2O===2NaHCO3+Na2SO3。②C点高于B点的原因:根据钠元素守恒, NaHSO3的物质的量是Na2CO3的2倍,所以NaHSO3的质量大,质量分数就大。 答案:(1)①S2O+2H2O+Mn2+===4H++2SO -+MnO2↓ ②80 ℃(80 ℃~90 ℃区间均可) 吸附胶体粒子形成沉淀 ③锰的化合物可催化H2O2的分解,使消耗的H2O2增多 (2)H2O (3)①2Na2CO3+SO2+H2O===2NaHCO3+Na2SO3 ②根据钠元素守恒, NaHSO3的物质的量是Na2CO3的2倍,所以NaHSO3的质量大,质量分数就大 8.(2019·清江中学模拟)含重金属离子(如铬、锰、铅等)废水的常见治理方法有化学还原法、化学氧化法、吸附法等工艺。 (1)化学还原法除Cr2O。取含Cr2O的模拟水样分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定铬去除率,实验结果如图1所示。 ①在酸性条件下,NaHSO3使Cr2O还原成为Cr3+,请写出NaHSO3与Cr2O反应的离子方程式:__________________________________________________。 ②pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是________________________________________________________________________。 ③分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果: Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反; Ⅱ.________________________________________________________________________。 (2)化学氧化法除Mn2+。 ①相同条件下,按Ⅰ、Ⅱ两种方案氧化除去水样中Mn2+,测定不同pH、相同反应时间的c(Mn2+),结果如图2所示,产生该差异的可能原因是_____________________________。 ②氧化实验中除Mn2+的最佳条件为______________________________________。 (3)石墨烯吸附法除Pb2+。不同的pH会使石墨烯吸附剂表面带上不同的电荷,图3为pH对Pb2+吸附率的影响,其原因是_______________________________________________。 解析:(1)①在酸性条件下,NaHSO3使Cr2O还原成为Cr3+,HSO被氧化成SO,根据氧化还原反应的配平原则,NaHSO3与Cr2O反应的离子方程式为3HSO+Cr2O+5H+===2Cr3++3SO+4H2O。②pH>8时,Fe2+转化为Fe(OH)2,而Fe(OH)2易被空气中O2氧化,亚铁盐对+6价Cr的去除效果反而下降。③分析图1比较亚铁盐和亚硫酸盐去除+6价Cr的效果,不难发现:Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;Ⅱ.中性和碱性条件下,亚铁盐对+6价Cr的去除效果明显优于亚硫酸盐的去除效果,在酸性条件下则相反。(2)①分析图2发现:相同条件下,由于Ⅱ方案中加入了MnO2,去除Mn2+既快又好,因此产生该差异的可能原因是MnO2对Mn2+的氧化有催化作用。②氧化实验中除Mn2+的最佳条件为MnO2作催化剂,pH控制在9左右。(3)不同的pH会使石墨烯吸附剂表面带上不同的电荷,随pH值增大,吸附剂表面吸附的OH-越多,带负电荷越多,有利于吸附带正电荷的Pb2+。 答案:(1)①3HSO+Cr2O+5H+===2Cr3++3SO+4H2O ②pH>8时,Fe2+转化为Fe(OH)2,而Fe(OH)2易被空气中O2氧化 ③中性和碱性条件下,亚铁盐对+6价Cr的去除效果明显优于亚硫酸盐的去除效果,在酸性条件下则相反 (2)①MnO2对Mn2+的氧化有催化作用 ②MnO2作催化剂,pH控制在9左右 (3)随pH值增大,吸附剂表面吸附的OH-越多,带负电荷越多,有利于吸附带正电荷的Pb2+查看更多