西南名师联盟2021届高三高考实用性联考卷(二)理科综合化学试题 Word版含答案
西南名师联盟2021届高考实用性联考卷(二)
理科综合化学部分
7.化学在生产和日常生活中有看重要的作用。下列有关说法不正确的是
A.刘禹锡《浪淘沙》诗询“千淘万漉虽辛苦,吹尽黄沙始到金”中“ 淘”相当于“过滤”
B.淀粉、蛋白质、油脂均属于高分子化合物
C.“地沟油”经过加工处理后,可以用来制肥皂利生物柴油
D.只要符合限量,“食用色素”、“ 碘元素”“ 亚硝酸盐”可以作为某些食品的添加剂
8. NA代表阿伏加德罗常数的值,下列叙述正确的是
A.1mol羟基(—OH)所含的电子总数为9NA
B.标准状况下,22. 4L的苯所含分子数为NA
C.25°C,pH=13的1. 0L Ba(OH)2溶液中含有OH—的数目为0. 2NA
D.一定条件下,2molSO2和lmolO2混合在密闭容器中充分反应后容器中的分子数为2NA
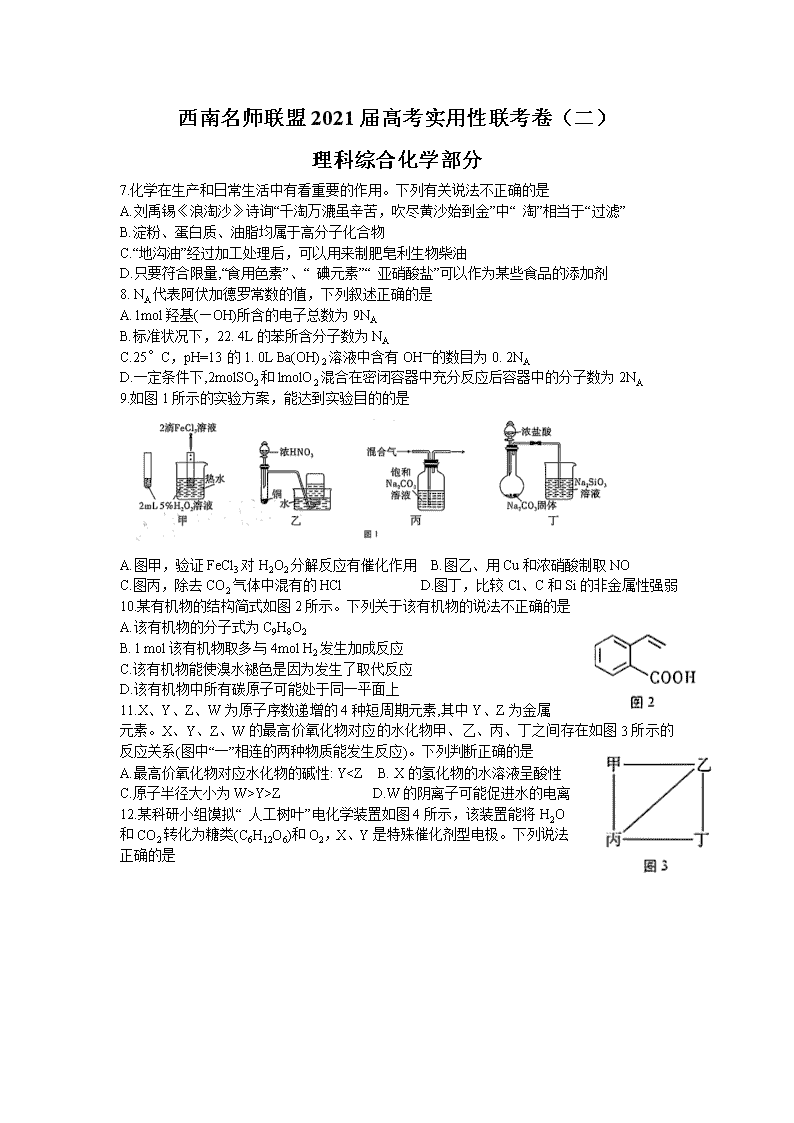
9.如图1所示的实验方案,能达到实验目的的是
A.图甲,验证FeCl3对H2O2分解反应有催化作用 B.图乙、用Cu和浓硝酸制取NO
C.图丙,除去CO2气体中混有的HCl D.图丁,比较Cl、C和Si的非金属性强弱
10.某有机物的结构简式如图2所示。下列关于该有机物的说法不正确的是
A.该有机物的分子式为C9H8O2
B. l mol该有机物取多与4mol H2发生加成反应
C.该有机物能使溴水褪色是因为发生了取代反应
D.该有机物中所有碳原子可能处于同一平面上
11.X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图3所示的反应关系(图中“一”相连的两种物质能发生反应)。下列判断正确的是
A.最高价氧化物对应水化物的碱性: Y
Y>Z D.W的阴离子可能促进水的电离
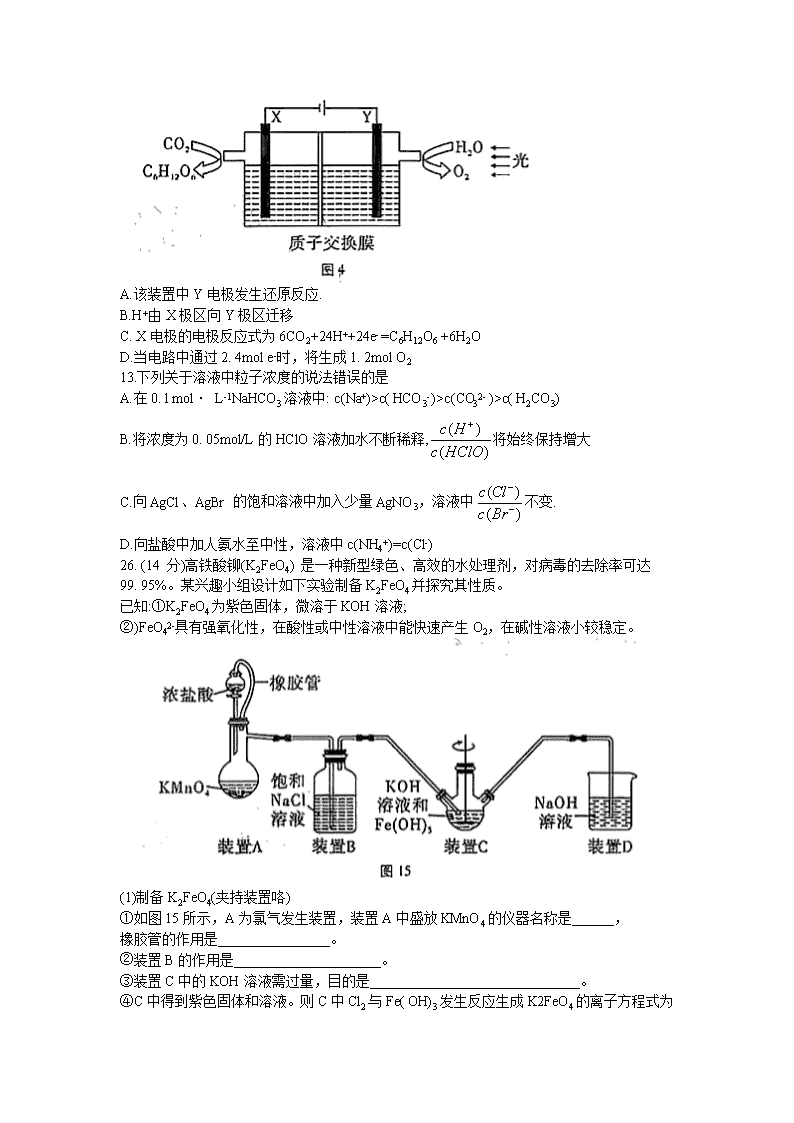
12.某科研小组馍拟“ 人工树叶”电化学装置如图4所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极。下列说法正确的是
A.该装置中Y电极发生还原反应.
B.H+由X极区向Y极区迁移
C. X电极的电极反应式为6CO2+24H++24e- =C6H12O6 +6H2O
D.当电路中通过2. 4mol e-时,将生成1. 2mol O2
13.下列关于溶液中粒子浓度的说法错误的是
A.在0. l mol· L-1NaHCO3溶液中: c(Na+)>c( HCO3-)>c(CO32- )>c( H2CO3)
B.将浓度为0. 05mol/L的HClO溶液加水不断稀释,将始终保持增大
C.向AgCl、AgBr 的饱和溶液中加入少量AgNO3,溶液中不变.
D.向盐酸中加人氨水至中性,溶液中c(NH4+)=c(Cl-)
26. (14 分)高铁酸铆(K2FeO4) 是一种新型绿色、高效的水处理剂,对病毒的去除率可达
99. 95%。某兴趣小组设计如下实验制备K2FeO4并探究其性质。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
②)FeO42-具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液小较稳定。
(1)制备K2FeO4(夹持装置咯)
①如图15所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是______,
橡胶管的作用是________________。
②装置B的作用是_____________________。
③装置C中的KOH溶液需过量,目的是______________________________。
④C中得到紫色固体和溶液。则C中Cl2与Fe( OH)3发生反应生成K2FeO4的离子方程式为
_____________________________。此外Cl2还与过量的KOH反应。
(2)探究K2FeO4的性质
甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象_________(填“能”或“不能”)证明“酸性条件下FeO42- 氧化性强于Cl2”,并说明理由:_________________________________。
(3)测定K2FeO4的产率
若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为_______________。
27. (14 分)马日夫盐[Mn(H2PO4)2•2H2O]用于钢铁制品,特别是大塑机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图16:
(1)“浸锰”过程中,为了提高浸取率可采取的措施有_______(写山两条即可)。
“浸锰”过程中SO2与MnO2发生反应的离子方程式为____________。
(2) “滤渣1”的主要成分为_____。写出该物质在生心生活中的应用_____
(写出一条即可);“滤渣2"的主要成分为__________。
(3)为检验“ 萃取分液”后的水溶液中是否含有Fe3+,可选用的化学试剂为____。
(4)①“沉锰”后溶液中的c(CO32-)= 10-4mol/l, 则锰离子是否沉淀完全?______(填“是”或
“否”)。[巳知Ksp( MnCO3)= 1. 8×10-10,当离子浓度小于10 -5mol/L时认为该离子沉淀完全]
②“沉锰"后需将沉淀进行过滤、洗涤,检验沉淀悬否洗涤干净的方法为__________。
(5)“酸溶”产生马日失盐晶体的化学方检式为___________________。
28.(15分)CO2既是温室气体,也是重要的化工原料,CO2的捕捉和利用是我国能源领域的一个重要战略方向。
(1)已知;①4H2(g) +2O2(g)4H2O(g) △H= -967. 2kJ/mol ; .
②CH4(g) +2O2(g) CO2(g)+2H2O(g) △H= -802.0kJ/mol。
则CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=______kJ/ mol。
(2)在体积为1L的密闭恒容容器中,充入4mol H2和1mol CO2,
发生反应: CO2(g) +4H2(g) CH4(g) +2H2O(g)测得温度对CO2
的平衡转化率( %)和催化剂催化效率的影响如图17所示。
①欲提高CO2的平衡转化率,可采取的揩施有______(填序号) .
A.通入怖性气体 B.升高温度
C.增加CO2浓度 D.增加H2浓度
②下列说法正确的是_____(填序号)。
A.平衡常数大小: KN”或“<”)。
(3) Fe3+ 可以与SCN-形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+ 的存在,KSCN中四种元素的电负性由小到大的顺序为___________(用元素符号表示),SCN-的几何构型为_______________,中心原子的杂化类型为_______。
(4)单质铜及镍都是由_____键形成的晶体;某镍白恫合金的立方晶胞结构如图23所示。
①晶胞中铜原子与镍原子的数量比为______。
②若合金的密度为dg●cm-3,该立方晶胞的边长约为____nm (列出表达式)。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图24为一种超导体的面心立方晶胞,C60 分子占据顶点和面心处,K+占据的是C60分子围成的_______空隙和______空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0)、B(, 0, )、C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为_____________。
36. [化学一选修5: 有机化学基础] (15 分)
有机物F可用于某抗凝血药的制备,工业生成F的一种路线图如图25:
已知:①; ②D与FeCl3溶波能发生显色。
回答下列问题:
(1) E中官能团的名称是________________,B→C的反应类型是_____。
(2) H的结构简式为________________,H与足量氢气反应生成的产物中手性碳有
_____________(碳原子上连有4个不同的原子或基团时,该碳称为手性碳)。
(3)有关F的下列说法正确的是_____________(填序号)。
A.属于芳香烃 B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应 D.1miol F最多可以跟4mol H2反应
(4)写出C+D→E的化学方程式:________________________________。
(5)同时满足下列条件的D的同分异构体共有______种,写出核磁共振氢谱有5组峰的物质的结构简式_________________________________。
①局于芳香族化合物 ②能与NaHCO3溶液反应③能与FeCl3溶液发生显色反应
(6)以2-氣丙酸(CH3CHClCOOH) 、苯酚为原料制备聚丙烯酸苯酚酯(),写出合成路线图(无机试剂自选)。_______________________________________________。