- 2021-07-09 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学推断题(经典)
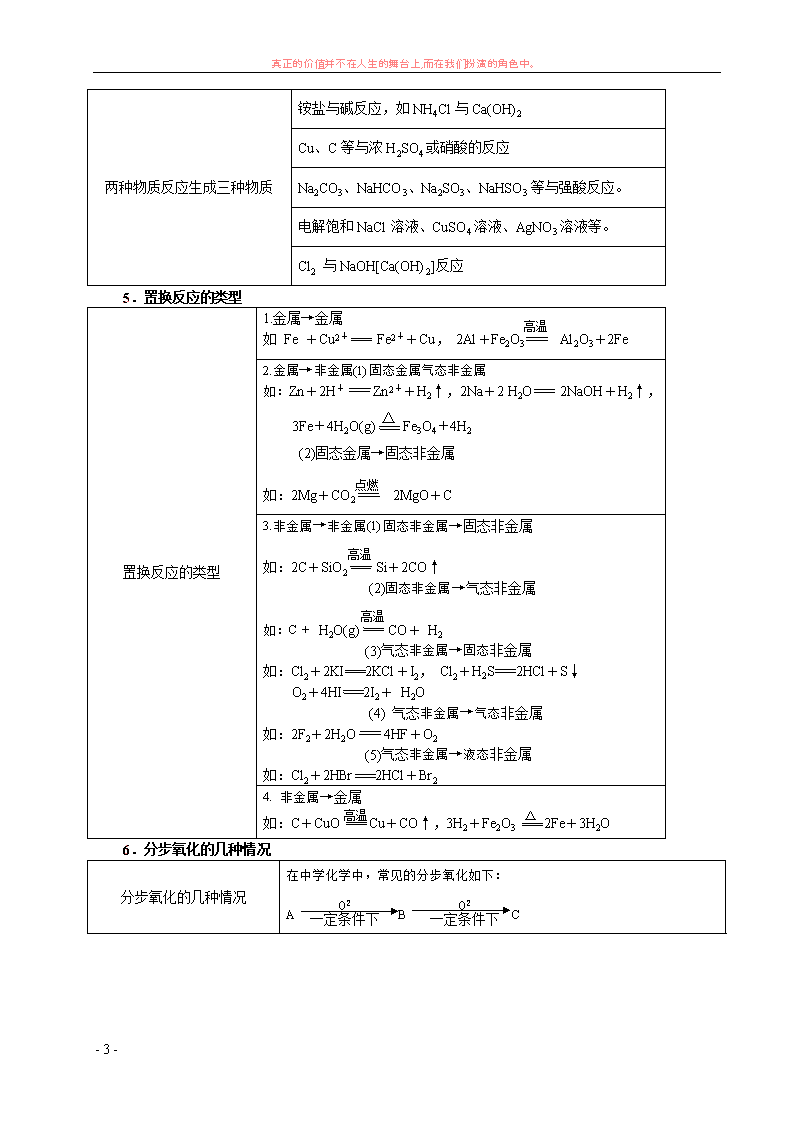
真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 1 - 无机推断题复习 1.颜色状态 状态 常温下呈液态的特殊物质: H2O、H2O2、C6H6 、 C2H6O 、Br2、Hg 等 颜色 有色气体:NO2 (红棕色)、F2(浅 黄绿色)、Cl2(黄 绿色);无色刺激 性气体:SO2、 NH3、HX(F、Cl、 Br、I);无色无 味气体:H2、N2、 O2、CO2、CO、 CH4、C2H2、NO。 溶 液 中 的 有 色 离 子:Cu2+(蓝色)、Fe2 +(浅绿色)、Fe3+(黄 色)、MnO4 -[紫(红) 色]。Br2在水中显黄 (橙)色,在有机溶剂 中显橙(红)色,I2在 水中显黄(褐)色,在 有 机 溶 剂 中 显 紫 (红)色。 有色固体:(淡)黄(棕) 色固体:Na2O2、S、FeS2、 FeCl3 ; 黑 色 固 体 : MnO2、C、CuO、FeO、 Fe3O4、CuS CuS2 ; 紫(黑)色固体:KMnO4、 I2;(紫)红色固体:Cu Fe2O3Cu2OFe(OH)3 Cu; 蓝 ( 绿 ) 色 固 体 : Cu(OH)2CuSO4·5H2O。 有色沉淀:①白色沉淀: H2SiO3、AgCl、BaSO4(不 溶 于 酸 ) 、 BaSO3 、 Mg(OH)2 、 Fe(OH)2 、 Al(OH)3 、 BaCO3 、 CaCO3、CaSO3、MgCO3 等;②(浅)黄色沉淀: AgBr、AgI、S;③红褐 色沉淀:Fe(OH)3;④蓝 色沉淀:Cu(OH)2;⑤黑 色沉淀:CuS、FeS。 2.物质的特征结构 10 电子微粒可能为 N3-、O2-、F-、OH-、NH2 -、Ne、CH4、NH3、H2O、HF、 Na+、Mg2+、Al3+、NH4 +、H3O+等。 18 电子微粒可能为 K+ 、Ca2+、Ar、F2、SiH4、PH3、H2S、HCl、H2O2、N2H4 CH3CH3 CH3F CH3OH HS- 、S2-、Cl-、O22-等。 14 电子微粒可能为 CO、N2 、C22- 常见的正四面体结构有 甲烷、CCl4、白磷、NH4 +;三角锥形有 NH3;直线型的多原 子分子可能为 CO2。 H 的原子核内没有中子。 常见元素中半径最小的是 H。 最外层电子数等于电子层数 的元素有 H、Be、Al、Ge 等。 最外层电子数是次外层电子数 2 倍或 3 倍的元素一定在第二周期 常见的原子晶体单质是 金刚石和晶体硅 3.特殊的反应现象 燃 烧 H2+Cl2(苍白色火焰),C2H2(C6H6)+O2(明亮火焰,浓烈黑烟)。 焰色反应 Na+(黄色)、K+(紫色)。 淀粉遇 I2变蓝,蛋白质遇浓硝酸变黄。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 2 - 使湿润的红色石蕊试纸 变蓝 NH3 使品红溶液褪色 SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。 在空气中由无色变为红 棕色的气体 NO Fe3+遇 OH- 生成红褐色沉淀,遇苯酚显紫色,遇 SCN- 显红色。 Fe2+遇 OH- 生成白色沉淀,并迅速变成灰绿色,最后生成红褐色;Fe2+遇 SCN- 无明显变化, 通入 Cl2后溶液显红色。 与强碱溶液反应产生气体的溶液一般含 NH4 + 与酸反应产生气体的溶液一般可能含:CO32-、HCO3 - 、SO32-、HSO3 -(S2-、HS-)等 4.特征反应(中学) 既能与强酸溶液反应又能与强 碱溶液反应的物质 (1)金属单质:Al (2)两性物质:两性氧化物如 Al2O3,两性氢氧化物如 Al(OH)3、氨基酸等。 (3)弱酸弱碱盐:如(NH4)2CO3、CH3COONH4等。 (4)弱酸的酸式盐:如 NaHCO3、Ca(HCO3)2、AaHSO3等 固体加热后不留残渣的物质 I2、NH4Cl、(NH4)2CO3、NH4HCO3。 常温与水反应产生气体的物质 Na、K、F2、Na2O2、CaC2。 有 MnO2参与的化学反应 (1)2H2O2 MnO2 2H2O+O2↑ (2)2KClO3 MnO2 △ 2KCl+3O2↑ (3)MnO2+4HCl(浓) △ MnCl2+2H2O+Cl2↑ 一种物质反应生成三种物质 2KMnO4 △ K2MnO4+MnO2+O2↑ 2NaHCO3 △ Na2CO3+H2O+CO2↑ Ca(HCO3)2 △ CaCO3+H2O+CO2↑ NH4HCO3 △ NH3↑+H2O↑+CO2↑ (NH4)2CO3 △ 2NH3↑+H2O↑+CO2↑ 4HNO3 △ 或光照 H2O+4NO2↑+O2↑ 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 3 - 两种物质反应生成三种物质 铵盐与碱反应,如 NH4Cl 与 Ca(OH)2 Cu、C 等与浓 H2SO4 或硝酸的反应 Na2CO3、NaHCO3、Na2SO3、NaHSO3 等与强酸反应。 电解饱和 NaCl 溶液、CuSO4溶液、AgNO3溶液等。 Cl2 与 NaOH[Ca(OH)2]反应 5.置换反应的类型 置换反应的类型 1.金属→金属 如 Fe +Cu2+ Fe2++Cu, 2Al+Fe2O3 Al2O3+2Fe 2.金属→非金属(1)固态金属气态非金属 如:Zn+2H+ Zn2++H2↑,2Na+2 H2O 2NaOH+H2↑, 3Fe+4H2O(g) △ Fe3O4+4H2 (2)固态金属→固态非金属 如:2Mg+CO2 2MgO+C 3.非金属→非金属(1)固态非金属→固态非金属 如:2C+SiO2 Si+2CO↑ (2)固态非金属→气态非金属 如:C+ H2O(g) CO+ H2 (3)气态非金属→固态非金属 如:Cl2+2KI 2KCl+I2, Cl2+H2S 2HCl+S↓ O2+4HI 2I2+ H2O (4) 气态非金属→气态非金属 如:2F2+2H2O 4HF+O2 (5)气态非金属→液态非金属 如:Cl2+2HBr 2HCl+Br2 4. 非金属→金属 如:C+CuO Cu+CO↑,3H2+Fe2O3 2Fe+3H2O 6.分步氧化的几种情况 分步氧化的几种情况 在中学化学中,常见的分步氧化如下: A O2 一定条件下 B O2 一定条件下 C 高温 高温 点燃 高温 △ 高温 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 4 - 1、掌握一些特别的连续变化关系 (1) )(222 酸或碱DCBA OHOO ① 323 222 HNONONONH OHOO (气体) ② 42322 222 SOHSOSOSH OHOO (气体) ③ 322 222 COHCOCOC OHOO (固体) ④ NaOHONaONaNa OHOO 222 222(固体) (2)A— C B 气体 强碱 气体 强酸 A 为弱酸的铵盐:(NH4)2CO3 或 NH4HCO3 ;(NH4)2S 或 NH4HS;(NH4)2SO3、 NH4HSO3 2. NH3 NO NO2 3. N2 NO NO2 4.C CO CO2 5. Na Na2O Na2O2 6.RCH2OH RCHO RCOOH 7.特殊的反应条件 放电 N2+O2 2NO;3O2 2O3 光照 H2+Cl 2HCl; 2HClO 2HCl+O2↑ ; 4HNO3 4NO2↑+O2↑+2H2O 催化剂 2H2O2 2H2O+O2↑ 2KClO3 2KCl+3O2↑;2SO2+O2 2SO3; N2+3H2 2NH3; 2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CH2OH +O2 2CH3COOH CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 8 (1)与碱反应产生气体 O2 O2 O2 O2 O2 O2 O2 O2 O2 O2 放电 放电 光照光照 光照 MnO2 MnO2 △ MnO2 △ 催化剂 高温、高压 Cu △ 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 5 - 2322 222 2 22 32222 HSiONaOHNaOHSi HNaAlOOHNaOHAl HSiAl OH、 单质 铵盐: OHNHNH 234 碱 (2)与酸反应产生气体 ① 22 2 22 22 2 2 2 3 42 3 42 3 42 NOSO SO S CONO COSO C NONO SO H HNO SOH HNO SOH HNO SOH HCl 、 、 、 非金属 、 金属 单质 浓 浓 浓 浓 浓 ② 23 2 3 2 2 23 2 3 SOHSOSO SHHSS COHCOCO H H H 化合物 9.物质组成的特殊配比 能形成原子个数比为 2:1 或 1:1 的特殊化合物有:Na2O、Na2O2类,H2O、H2O2 类,CaC2、C2H4、 C2H2、C6H6 类。 10.物质间的一些特殊转化关系 物质间的转化关系是解无机推断题的精髓,除了熟记一般的转化网络如“铝三角”、“铁三角”等外, 还要了解一些特殊的转化关系,例如: H2 HCl HNO3 H2O H2O H2O O2 Na2O NaOH Na Na2O NaOH NaCl NaCl NaCl Cl2 HCl MgCl2 Mg MgO MgSO4 MgCl2 MgCl2 MgCl2(或把 Mg 换成 Cu) Cl2 HCl BaCl2 11.与工业生产相关的主要反应 工业制漂白粉 2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O 工业合成氨 N2+3H2 2NH3 氨的催化氧化 4NH3+5O2 4NO+6H2O 催化剂 高温、高压 催化剂 △ 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 6 - 电解饱和食盐水 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 电解制镁、铝 MgCl2 Mg+Cl2↑;2Al2O3 4Al+3O2↑ 工业制玻璃 Na2CO3+SiO2 Na2SiO3+CO2↑; CaCO3+SiO2 CaSiO3+CO2↑ 工业制硫酸 4FeS2+11O2 2Fe2O3+8SO2(或 S+O2 SO2); 2SO2+O2 2SO3;SO3+H2O H2SO4 工业制粗硅 SiO2+2C Si+2CO↑ 12.三角转化关系: 一、卤素 二、 碳族元素 电解 电解 高温 高温 高温 点燃 催化剂 △ 电解 高温 ①Cl2+H2O=HCl+HClO ②Cl2+2NaOH=NaCl+NaClO+H2O ③ 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ①2Fe2++Cl2=2Fe3++2Cl- ②2I-+Cl2=I2+2Cl- ③S2-+Cl2=S↓+2Cl- ④SO2+Cl2+2H2O=H2SO4+2HCl ⑤8NH3+3Cl2=N2+6NH4Cl HCl HClO (强氧化性) H+ Zn OH- NH3 CaCO H2 H2O NH4+ CO2 Cl- Ag+ MnO2 AgCl Cl2 C2H5OH C2H5Cl 取代 CH2=CH Cl 加成 CH AgNO3 Ca(OH)2光 H+、CO2 电解Na AgNO3 Cl2 (黄绿色 Ca(ClO)2 氧化性 KMnO4、电解 H2S、HBr、HI 还原性 化合物 金属 ①2Fe+3Cl2=2FeCl3 ②Cu+Cl2=CuCl2 (生成高价) 非 金 ①H2+Cl2=2HCl ②2P+3Cl2=2PCl3 自 身 氧 化 NaClAgCl 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 7 - 【知识网络】 三、氮族元素 【知识网络】 易错指津 1.氨水显弱碱性的理解不全面。 氨气溶于水形成氨水,氨水少部分电离出 OH-、NH4+,所以氨水具有弱碱性。注意以下两点: (1)氨水遇 Al3+、Fe3+、Mg2+分别可以生成 Al(OH)3、Fe(OH)3、Mg(OH)2 沉淀,但氨水中滴加 Ag+ 溶液开始出现沉淀 AgOH,继续滴加沉淀即溶解生成银氨溶液;(2)氨水遇酸、酸性氧化物可以成盐, 又根据氨水与酸的量关系分别得到正盐和酸式盐。如:用氨水吸收少量二氧化硫的离子方程式 NH3.H2O+SO2=NH4++HSO3-是错误的。 2.NO、O2被水吸收的分析错误。 NO、O2 被水吸收实质上发生如下反应:2NO+O2=2NO2,3NO2+2H2O=2HNO3+NO。生成 NO 还可 以继续氧化,生成 NO2再溶于水,这是一个循环反应。如无任何气体剩余,最终产物应为 HNO3,恰好 反应的量的关系:4NO+3O2+2H2O=4HNO3,实际反应中可以有 NO 或 O2剩余,但不能两者兼有之。 CO2 H2SiO3 H+、CO2+H2O NaO C NaO HCl、FeCl3、SiO2Mg O2 HNO3、H2SO4、O2、 CuO 、 O2 Fe2O3 C CO2+ H2OCaCOH2H2OCaC Ca(OH) CaO Ca(HCO3) 2 Δ Na2CO3、Δ C CaO CO CO Na2CO CaCl2 Ca(OH)2 Na2O 、CH4 高温 Si SiO Na2SiO SiCl4 H4SiO SiC O2、FeO CaCOSiO2 SiO H2Cl H2O SiF4 HF O2(高温、催化剂) 4HNO3( 浓 )==4NO2 ↑ +2H2O+O2↑ 强 氧 化 性 不 稳 定 HNO3 NaNO2 NaOH Mg N2O H2O NH3.H2 O NH3 N2 NO NO2 Ag(NH3)2+ NH4Cl AgNO3 NaO H HCl Δ H2O Mg3N2 Cl2、CuO H2 加热加 O2( 放 NH3 O2 SO2 H2O Cu HCl Cu、Fe2+、、I- ①与金属反应:Cu ②与非金属反应:C、S ③Fe、Al 在冷、浓 HNO3 钝化 ④Pt、 Au 能溶解于王水 (浓 HNO3:浓 HCl=1:3) ⑤与还原性化合物反应:Fe2+、SO2、H2S、 HI 有机物 硝化反应:C6H6 酯化反应:C3H5(OH)3 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 8 - 3.氮可以形成多种氧化物。NO2可以与水反应生成硝酸,但 NO2 不是硝酸的酸酐。掌握酸酐的判 断方法。NO2 与溴蒸气不能用湿润的 KI 淀粉试纸检验。 4.NO3-在酸性溶液中具有强氧化性,可以将 Fe2+氧化为 Fe3+、SO32-氧化为 SO42-,将 I-、Br-、S2- 氧化为 I2、Br2、S。 5.检验 NH4+离子,可加入烧碱溶液后,必须加热..,再用湿润的红色石蕊试纸检验 NH3,否则不一 定有 NH3放出。 四、 硫和硫的化合物 【知识网络】 浓 H2SO4 170℃ 酸 NaO H2S 作 干 HCOOH 42SOH浓 CO↑+H2O 制苯 磺酸 C2H5O O2 Cl2+H2O FeS H+ 2H2S+O2( 少 量 )=2H2O+2S 2H2S+3O2( 过可 燃 ①2H2S+O2=2H2O+2S↓ ②H2S+I2=2HI+S↓ ③H2S+2Fe3+=2Fe2++2H++S↓ ④ H2S+H2SO4( 浓 )=S ↓ +SO2+2H2O ⑤ 3H2S+2HNO3=3S ↓ +2NO ↑ 强 还 原 H2S=S+H2 不 稳 定 HNa2S2O3 3S+6KOH=2K2S+K2SO3+3H 氧化性 还原性 S H2+S=H2S Fe+S=FeS 2Cu+S=Cu2S(金属为 氧化性 还原性 S+O2=SO2 S+2H2SO4=3SO2 ↑ ①SiO32-+SO2+H2O=H2SiO3↓+SO32- ②CO32-+ SO2=CO2+ SO32- ③HCO3-+SO2=CO2+HSO3- ④SO32-+ SO2+H2O=2HSO3- 酸 SO2 漂白性:使品红溶液褪色 特性 ①2SO2+O2====2SO3 ②SO2+Cl2+2H2O=H2SO4+2HCl ③ SO2+2Fe3++2H2O=SO42-+2Fe2++4H 强 还 原 ① 3Mg+SO2=MgS+2MgO ②2H2S+SO2=3S+ 2H2O 弱 氧 化 氧化性与还原 H2SO4 Na2SO3 FeS2 H NaO I2CuSOCO2钝化 HICuCFe、Al 催化剂+脱水 与 Ca3(PO4)2 制 H3PO4、 过磷酸钙 脱水性吸水性 强氧化性 磺化剂 Na2SO 4 H C2H4 ↑ + 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 9 - (一)物质转化框图推断题 例:(四川卷)下图是无机物 A~M 在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I 是由第三周期元素组成的单质中熔点最高的金属,K 是一种红棕色气体。 请填写下列空白: (1)在周期表中,组成单质 G 的元素位于第__________周期_________族。 (2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。 (3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_(填写序号)。 (4)反应④ 的离子方程式是:_______________________________________ (5)将化合物 D 与 KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂 K2FeO4 (高铁酸钾).同 时还生成 KNO2 和 H2O 。该反应的化学方程式是: 。 (二)物质结构理论推断题 该类试题常与物质结构、元素周期律(表)有联系,通过阅读第一条信息,往往有多种可能答案,但 把多条信息综合考虑就可逐渐缩小范围,最终确定唯一答案。 例:由短周期元素组成的 A、B、C、D、E、F 六种粒子,其中只有 C、D 是分子,其余四种均是 离子,且每个微粒中都含有 10 个电子。已知 A、E 是由非金属元素组成的阳离子,六种粒子间有下列 关系: ①A、B 两种离子在加热条件下可生成 C、D 两种分子; ②通常状况下 C 的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝; ③1 mol B 离子与 1 mol E 离子作用可生成 2 mol D 分子; ④向含 F 离子的溶液中加入 C 的溶液,可生成白色沉淀 W,C 溶液过量沉淀也不消失,若加入含 大量 B 离子或大量 E 离子的溶液,沉淀 W 都会溶解。 (1)微粒 B 的电子式是_____________;粒子 E 的名称是____________;粒子 F 对应的元素在周期表 中的位置是_________________________________。 (2)写出下列反应的离子方程式: F+过量 C 的溶液:___________________________________________________ W+含大量 B 离子的溶液: (3)六种微粒中的两种可与硫酸根形成一种复盐,向该复盐的浓溶液中滴加浓苛性钠溶液,依次产 生的现象有:a.溶液中出现白色沉淀 b. 沉淀逐渐增多 c. 有刺激性气味气体放出 d. 沉淀逐渐减少 e.沉 淀完全消失 该复盐的化学式为 ,在水溶液中的电离方程式是___________。 例:下图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去)其中常温下 B、D、G、 I、J 为气体,其中 B 可使湿润的红色石蕊试纸变蓝,A~N 的所有物质中只有 G 为单质,其余为化合 物。N 为不溶于水的无机酸。 回答下列问题: (1)A 的名称为 ,F 的化学式是 ; I A C K D F J N MG H B LE +G C 催化剂 高温 △ +G 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 10 - H 的化学式是 ,L 的化学式是 (2)写出实验室制取 I 的离子方程式: (3)写出 G 的一种同素异形体的化学式: 该物质与 G 在化学性质上的 共同点是 。 (4)已知工业上生产 0.1molB 放出 4.62kj 热量,写出该反应的热化学方程式: (5)在反应 C+E→G+F 中,每生成 1molG 转移 mol 电子。 高中化学专题练习——推断题 1.下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下 X 是固体,B 和 G 是液体其余均为气体。根据图中关系推断: (1)化学式 X A B (2)写出 C→E 的化学反应方程式 (3)实验室收集气体 D 和 F 的方法依次是 法和 法。 2 分)有 X、Y、Z 三种单质,X 是金属,常温下 Y 是液体,Z 是气体,反应关系为: (1)据此推断 X、Y、Z 的化学式为:X_________,Y_________,Z__________。 (2)C+Y→A 的离子方程式:___________________________________________ (3)X 元素的核电荷数小于 36,它是不是主族元素,简述理由。 ___________________________________________________________________________ ________________________________ 3.(6 分)下图中每一个方框内的字母代表一种物质,常温常压下,A、B、C、D、均为单质,且 B 为 金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物 E、 F、G、H、I 和 J,这些化合物在常温常压下的状态及颜色已在图中注明, 有关反应的化学计量数为: (1)A 与 B 按物质的量之比 n(A)∶n(B)=1∶2 完全反应生成 G (2)B 与 C 按物质的量之比 n(B)∶n(C)=3∶1 完全反应生成 F (3)C 与 D 按物质的量之比 n(C)∶n(D)=1∶3 完全反应生成 E 请填空: (1)物质 B 是 ,物质 D 是 (2)B 与 C 反应生成 F 的化学方程式为: (3)A 与 H 反应生成 I 的化学方程式为: 。 液 X OH- H+ A B C B Na2O2 D E F G Fe 微热 B E 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 11 - 4. (10 分)有 A、B、C、D 四种单质,在一定条件下,A、B、C 分别跟 D 发生化合反应相应生成甲、 乙、丙(甲、乙、丙每个分子中都含有 10 个电子)而 B 跟 C 发生化合反应生成丁,这些单质和化 合物之间发生如下反应关系: (1)写出下列物质的化学式 甲 ______________ 乙 ___________ 丙 _____________丁_____________ (2)写出反应①②③的化学方程式 ①_______________________________ ②_________________________________________ ③_________________________________________________________。 (3)反应①的化学方程式是 。 5.(14 分) A、B、C、是单质,X、Y、Z、H、J、L 是化合物,组成 B 的元素是绿色植物生活所必需 的微量元素之一,且 B 在空气中燃烧可以得到 X 和 J,X 和 J 均为固体,X 水 解可生成两种碱性物质。在适当条件下,它们相互之间有下图所所示的转化关系: (1)用化学式表示化合物 L 单质 C 。 (2)物质 Z 的分子空间构型是 。 (3)反应①的化学方程式 ________________ 。 (4)反应⑤的化学方程式 。 (5)在常温下用气体密度测定 NO2 的相对分子质量,实验值比理论纸值偏 (填 “高”或“低”),其原因是 。 6.下图所涉及的物质均为中学化学中的常见物质,其中 C、D、E 为单质,其余为化合物。它们存在 如下转化关系,反应中生成的水及次要产物均巳略出。 无 色 气 体 J 棕 色 气 体 I 无 色 气 体 H G白色固体 F固体 E无色气体 A B C D 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 12 - (1)写出化学式:B_____________、E_____________; (2)指出 MnO2在相关反应中的作用;反应①中是________剂,反应②中是_____剂。 (3)完成 F 与 B 发生反应的化学方程式______________________________________。 (4)若反应①是在加热条件下进行,A 是_______;若反应①是在常温条件下进行,A 是_________ 。 若在上述两种条件下得到等量的 C 单质.反应中转移的电子数之比为__________。 7.已知 a、I、e 为三种由短周期元素构成的粒子,它们都有 10 个电子,其结构特点如下: 粒子代码 a I e 原子核数 单核 四核 双核 粒子的电荷数 一个单位正电荷 0 一个单位负电荷 物质 A 由 a、e 构成,B、C、D、K 都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之 间的相互反应转化关系如下图所示: 请填写下列空白: (1)写出下列物质的化学式: 。 (2)写出下列反应的离子方程式: ①H+E(溶液)→M 。 ②I 溶于 G 。 (3)在通常状况下,若 1 g C气体在 B 气体中燃烧生成 H 气体时放出 92.3 kJ热量,则 2 mol H 气体完 全分解生成 C 气体和 B 气体的热化学方程式为 8.(17 分)A、B、C、D、E 五种短周期元素,它们的原子序数依次增大。B 元素原子最外层电子数比 次外层多 2;A、B 两元素的核电荷数之差等于它们的原子最外层电子数之和;D 和 E 的原子序数 和为 30;在元素周期表中,C 是 E 的不同周期邻族元素。 五种元素两两形成的化合物有甲、乙、两、丁四种,分子中原子个数比如下表: 甲 乙 丙 丁 化合物中各元 素原子个比 A:C=1:1 B:A=1:2 D:E=1:3 B:E=1:4 (1)写出元素符合:B E (2)A 元素某原子核内中子数比质子数多 1,则该核素的核组成符合为 。 物质丁的分子为 分子(填“极性”或“非极性”)。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 13 - (3)向甲的水溶液中加入 MnO2,氧化产物是 。 (4)已知有机物乙的分子为平面结构,碳氢键间的夹角约为 120°,实验室制取乙的化学方程式 为 。 (5)丙的水溶液呈酸性,与饱和 NaHCO3 溶液反应会产生大量气体和难溶物,有关离子方程式 为 。 9.A、B、C 是常见单质,X、Y、Z 是氧化物,它们之间有如下转化关系: 请写出符合下列要求的化学方程式: (1)若 X 为 CO2,则: 反应① ; 反应② 。 (2)若 X 为 Fe3O4,则: 反应① ; 反应② 。 10.A、B、C、D、E、F是中学化学中常见的六种物质,它们之间有如下转化关系:其中B、D在 通常情况下是气体物质,F溶液呈强碱性。 (1)写出C的化学式_____________。 (2)写出反应①的化学方程式________________________。 (3)配制F溶液时必须注意:①_____________;②____________;③ (“ ”有示有则填写,无则不填 写) (4)写出F与盐酸反应的离子方程式______________________。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 14 - 11.A、B、C、D是四种人们熟悉的与生命运动密切相关的化合物,它们所含的元素不超过三种,并 有下列关系(反应条件均未注明) 目前化合物B在自然界含量呈上升趋势,对环境产生了不利影响,E是一种生活中常见的化合物,在一 定条件下可与单质N进一步发生如下变化:E+3N→3A+2B (1)A、B、C、D分别是什么物质,常温下,A和B转化为C的途径是什么? (2)假设在上述转化中无损耗,如有 0.1molE 生成,求A和B转化为C时能产生多少克单质N? 12.(6分) 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的摩尔质量比Z 小16,乙与丙的摩尔质量相同,B的摩尔质量比D的小2,B与X的摩尔质量相同,各物质转化关 系如下图(各反应条件已略去)。 (1) 丙、B的分子式分别为 、 。 (2) Y转化为Z的化学方程式 。 (3) E与F反应的离子方程式 。 13.(14 分) 某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO 2 、S2-、CO 2 3 、 SO 2 3 、SO 2 4 ,现取该溶液进行有关实验,实验结果如下图所示: 试回答下列问题: (1) 沉淀甲是____________, (2) 沉淀乙是__________, (3) 由溶液甲生成沉淀乙的离子方程式为:_________________________。 (4) 气体甲成分可能有哪几种?(可以不填满也可以补充,多填要扣分) 1 2 3 4 5 6 (5)综合上述信息,可以肯定存在的离子:_____________________________。 +丙 甲 乙 X A C Y B Z D +丙 +丙 +丙 +丙 +丁 +丁 E F 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 15 - 14、(10 分)一定条件下发生如图所示的转化关系,其中 A、B、C 为中学化学中常见元素的化合 物,甲、乙、丙均为单质。 (1)若 A 是 CO2,甲能在 A 中剧烈燃烧 ①化合物 B 的电子式为 , 单质丙分子式 ;②现有下列药品和制气装置:实验药品:a.氯酸钾 b.大理石 c.过氧化钠 d.二氧化锰 e.甲酸 f.浓硫酸 g.稀硫酸 h.浓硝酸 i.双氧水 j 蒸馏水 选择上述所给的一些药品,既可以制取 CO2,又可以制取气体丙,制取 CO2 应选用的药品 是 ,制取气体丙的化学反应方程式 (2)若 A、B、C 均为溶液,单质乙在常温下为液态,反应均在溶液中进行,写出 A 与甲按物质的量之 比为 1:1 发生反应的离子方程式 。 15.(8 分)A、B、C、D 是中学化学中四种常见的非金属单质,在标准状况下,它们之中有三种呈气 态,只有一种呈固态。B 的相对分子质量很小。甲、乙、丙、X、Y 五种物质都是化合物,这些化合物 和 A、B、C、D 之间有如图所示关系: 且知以上物质的所有组成元素均为短周期元素。根据以上事实,回答下列问题: (1)化合物乙与氢氧化钠按物质的量之比 1:3 恰好完全反应,则乙的化学式是 。 (2)图中的化学反应共有 个化合反应, 个氧化还原反应。 (3)Y与甲反应生成乙和丙的化学方程式为: 。 16.(6 分)根据下列反应框图填空,已知反应①是工业上生产化合物 D 的反应,反应⑤是实验室鉴定 化合物 E 的反应。 C A 乙 A B 乙 不足量丙 足量丙 甲 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 16 - (1)单质 L 是_______________。 (2)化合物 B 是_____________。 (3)图中除反应①外,还有两个用于工业生产的反应是______和_______(填代号) 它们的化学反应方程式分别是____________________和____________________。 17、已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为 35;A-G 是七种常见化合 物:上述各物质间的相互转化关系如下图所示(反应条件和其它生成物略)。 试回答: (1)B 的化学式是:______ ,D 的名称是_________ ; (2)用电子式表示 A: (3)写出①、②两步变化的化学方程式: 18.(13 分)有常见 A、B、C 三种短周期元素,它们的原子序数逐渐增大,B 元素原子最外层电子数 是 C 元素原子最外层电子数的一半,A 元素最外层电子数比 B 多一个。甲、乙、丙是 3 种含氧酸的钠 盐,甲中含 B 元素,乙中含 C 元素,丙中含 A 元素,甲、丙溶液 pH>7,乙溶液 pH<7;丁为气体,戊 为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图: 请回答: ( 1)写出 C 元素的原子结构示意图 _______________,写出丁和戊的电子式 ____________、 _________________; (2)用有关化学用语解释: 乙溶液呈酸性的原因____________________________; 丙溶液呈碱性的原因____________________________; (3)写出有关反应的离子方程式: ①乙溶液+丙溶液→丁______________________________; ②己溶液+丙溶液→丁______________________________。 19.X、Y、A、B、C、D 是中学化学教材中常见的化合物,且有如下转化关系。气体 C 的式量比气体 X 的式量大 2,产物中水已忽略。 甲 B E 丙 乙 C F A D G H2O ② 丙 丙 B 丙 丙 ① 丙 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 17 - 回答下列问题: (1)X 分子的电子式是______________________。 (2)在上述转化过程中作还原剂的物质有(填物质的化学式)___________________ (3)A 与浓 HNO3反应的化学方程式为_______________________________________ (4)测定气体 C 的相对分子质量,测得的数值与气体的相对分子质量有差异的原因是(用化学方程式 表示)_____________________________________________________。 20.(9 分)下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质 (1)①的化学式为 ,⑤和⑥反应的化学方程式为 。 (2)实验室由⑧制取⑨的离子方程式为 ,⑨转变为⑩的化学方程式为 。由⑨转变为 ⑩的反应现象为 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 18 - 参考答案: 1.(1)NH4HCO3 NH3 H2O (2)2CO2+2Na2O2=2Na2CO3+O2↑ (3)排水 向上排空气 2.(8 分)(1)X-Fe Y-Br2 Z-H2(各 1 分) (2)2Fe2++Br2=2Fe3++2Br(2 分) (2)不是(1 分),因 X 是前四周期元素。且在 A 和 C 中显示不同正价。(2 分) 3.(1)Mg(镁),H2(氢) (每空 1 分,共 2 分) (2)3Mg+N2 点 燃 Mg3N2(2 分) (3)O2+2NO 2NO2 (2 分) 4. (1) HF、H2O、NH3、NO( 每空 1 分) (2) 2F2 + 2 H2O ==4HF+ O2 4NH3+ 5O2==4NO +6H2O 4NH3+ NO==5N2 +6H2O 5.(14 分,每空 2 分) (1)NO H2 (2)三角锥型 (3)3Mg+N2 Mg3N2 (4)4NH3+5O2 4NO+6H2O (5)高 NO2分子相互反应有 N2O4 生成(2NO2 N2O4) 6(1)HCl、Fe(2)催化 氧化) (3)Fe3O4 + 8HCl=FeCl2 +2FeCl3 +4H2O (4)KClO3 H2O2 2:1 7.(1)B.Cl2 J.NO (2) ①H+ +ClO - = HClO (3)NH 3 +H 2O NH 3·H 2O NH4 + +OH- (4)2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1 8.(1)B:C E:Cl (2) H3 1 ;非极性 (3)O2 4)CH3CH2OH CH2=CH2↑+H2O (5)Al3++3HCO3 —=Al(OH)3↓+3CO2 9.(1)、2Mg+CO2 点然 2MgO+C, C+2CuO △ 2Cu+CO2 (2)、3Fe3O4 +8Al 点然 9Fe+4Al2O3 3Fe+4H2O(气) △ Fe3O4 +4H2 10.(1)AgCl (2)NH3+HCl=NH4Cl (3)①防止氨水过量 ②随用随配 (4)[Ag(NH3)2]++Cl-+3H++OH-=AgCl↓+H2O+2NH 11.(1)A∶H2O B∶CO2 C∶淀粉 D∶葡萄糖 6CO2+6H2O C6H12O6+6O2, (2)上式再结合 C6H12O6 2C2H5OH+2CO2,可得关系式:C2H5OH~3O2 故生成氧气的质量=0.1×3×32=9.6 (g) 12.(6分)(1)O2 Na2O2(每空1分,共2分) (2) 2Na2SO4+O2=2Na2SO4(2分) 浓硫酸 △ 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 - 19 - (3) H+ +OH- =H2O(2分) 14. (1)甲 S (2)乙 3)(OHAl 、 233 3 3)(3 COOHAlHCOAl (3)丙 3BaCO ,可能 BaSO4 (4) H2S SO2 CO2 H2S、CO2 SO2、CO2 (5) 2S 、 2 3SO 、 2AlO 、 Na 15、(10 分)(1)① Mg2+ [ O ]2- , O2 ②,bhj,2Na2O2 + 2H2O = 4NaOH + O2↑ (2)2Cl2 + 2Fe2+ + 2Br- = 4Cl- + 2Fe3+ + Br2 16.(8 分) (1)H3PO4 (2)5;4 (3)PCl5+4H2O H3PO4+5HCl (每空 2 分) 17.(8 分) (1)H2 (2)H2O (3)②,④ 2NaCl+2H2O ,2Ca(OH)2+2Cl2= 25 (1) Na2O ,D 亚硫酸钠 ;(2) (3) ① 2SO2+O2=2SO3 ,② 2Na2O2+2H2O=4NaOH+O2;。 19.答案:(1) +16 2 8 6 ; O C O ; Na[ O O ]2 + Na ; (2)NaHSO4=Na+ +H+ +SO42-;CO32-+H2O HCO3 - +OH- (3)2H+ +CO32-=H2O+CO2↑; 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 20.(1)略 (2)Mg C (3)C+4HNO3===CO2+4NO2+2H2O (4)2NO2 N2O4查看更多